Физические свойства магния: плотность, теплоемкость, теплопроводность
Представлены физические свойства магния Mg при различных температурах — в интервале от -223 до 1123°С. В таблице даны следующие свойства магния в твердом и расплавленном состояниях:
- плотность магния ρ;
- удельная теплоемкость Cp;
- коэффициент температуропроводности a;
- коэффициент теплопроводности λ.
Температура плавления магния составляет 650°С. Процесс плавления сопровождается значительным изменением физических свойств магния — в особенности таких, как плотность и удельная теплоемкость. Плотность расплава магния становиться значительно ниже. Удельная массовая теплоемкость магния при дальнейшем нагревании расплава слабо снижается.
Магний — легкий металл с низкой плотностью. Плотность магния при комнатной температуре равна 1737 кг/м3 или 1,73 г/см3. Этот металл намного легче железа и алюминия, но в 2-3 раза тяжелее щелочных металлов — таких, как литий, калий и натрий.
Плотность магния ρ уменьшается при нагревании. При увеличении температуры, например на 600°С, она снижается на 6% до значения 1635 кг/м3. Плотность жидкого магния значительно ниже, чем твердого. При температуре плавления плотность магния имеет величину 1580 кг/м3.
Удельная теплоемкость магния при росте температуры увеличивается во всем интервале до температуры плавления. Магний в жидком состоянии имеет обратную зависимость удельной теплоемкости от температуры — теплоемкость жидкого магния при нагревании снижается.
Теплопроводность магния λ достаточно высока. При температуре 27°С она имеет значение 156 Вт/(м·град), что в два раза больше теплопроводности железа. Теплопроводность магния схожа по величине с коэффициентом теплопроводности таких металлов, как бериллий и вольфрам. Зависимость теплопроводности магния от температуры подобна таковой у других металлов — при нагревании происходит снижение ее величины.
Зависимость теплопроводности магния от температуры подобна таковой у других металлов — при нагревании происходит снижение ее величины.
| Температура, °C | ρ, кг/м3 | Cp, Дж/(кг·град) | a·106, м2/с | λ, Вт/(м·град) |
|---|---|---|---|---|
| -223 | — | 418 | — | 465 |
| -173 | — | 648 | 148 | 169 |
| -72 | — | 934 | 97,1 | 159 |
| 27 | 1737 | 1025 | 87,4 | 156 |
| 127 | 1719 | 1072 | 82,8 | 153 |
| 227 | 1702 | 1118 | 79,2 | 151 |
| 327 | 1685 | 1164 | 75,6 | 149 |
| 427 | 1669 | 1209 | 72,2 | 147 |
| 527 | 1651 | 1255 | 68,9 | 146 |
| 627 | 1635 | 1301 | 65,6 | 145 |
| 650 | 1580 | 1410 | — | — |
| 723 | 1576 | 1372 | — | — |
| 923 | 1550 | 1295 | — | — |
| 1123 | — | 1251 | — | — |
Температуропроводность магния при комнатной температуре имеет значение 87,4·10-6 м2/с. Она значительно снижается с повышением температуры. Например, по данным таблицы, при температуре 527°С значение коэффициента температуропроводности этого металла будет равно 68,9·10-6 м2/с.
Примечание: допускается интерполяция значений физических свойств магния в таблице.
Источники:
- В.Е. Зиновьев. Теплофизические свойства металлов при высоких температурах.
- Лариков Л.Н., Юрченко Ю.Ф. Тепловые свойства металлов и сплавов.
О РОЛИ ВЛИЯНИЯ ЛЕГИРУЮЩИХ ДОБАВОК НА СТРУКТУРУ И СВОЙСТВА МАГНИЙ–ЦИНКОВЫХ ФЕРРИТОВ | Андреев
1. Pat. N 8138959 B2. H01F1/34B2, H05K9/00M2, H01F1/36, C04B35/26H (US). Radio wave absorption material and radio wave absorber / Shinroh Itoh, Yasuharu Miyoshi, 18.10.2007.
2. Pat. N US7108799 B2. H01Q17/00, C04B35/26H, C04B35/057, C04B35/626A6H (US). Electromagnetic wave absorber formed of Mn—Zn−ferrite / Osamu Kobayashi, Kiyoshi Ito, Masashi Norizuki, 30.01.2004.
3. Pat. N 6984338 B2. C04B35/26H, H01F1/34B2 (US). A mixed oxides of iron, zinc, titanium, tin, manganese, and calcium; high electrical resistance, permeability, soft magnetism in a high frequency band, stable grain structure; power supply switches, electromagnetic wave absorbers / Osamu Kobayashi, Osamu Yamada, Kiyoshi Ito, 28.01.2004.
4. Kim, D. Developments of new em wave absorbers / D. Kim // Internat. Symp. on Electrical and Electronics Engineering. − HCM City (Vietnam), 2005. − P. 23—29.
5. Лапшин, Э. В. Влияние параметров микроструктуры на радиофизические характеристики Ni—Zn−ферритовых материалов / Э. В. Лапшин, С. Б. Бибиков, М. В. Прокофьев, Р. М. Вергазов // Изв. вузов. Поволжский регион. Технические науки. − 2010. − № 3 (15). − С. 123—135.
6. Goncar, A. Problems of increasing of thermostability of highly permeable Ni—Zn−ferrites and for telecommunications / A.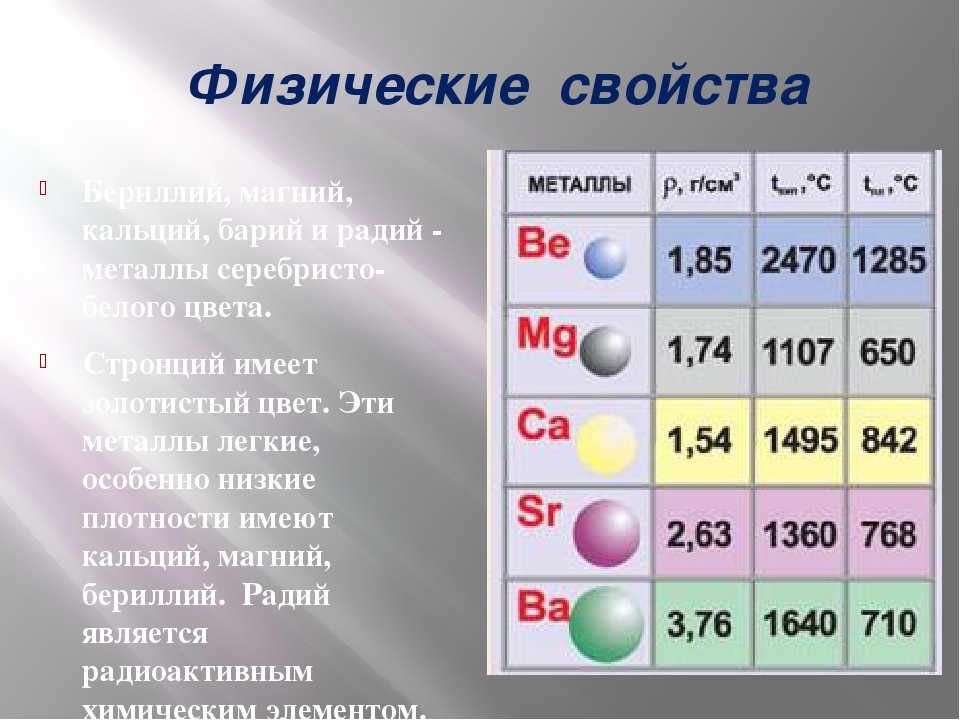 Goncar, V. Andreev, L. Letyuk // J. Magnetism and Magnetic Mater. − 2003. − V. 254–255. − P. 544—546.
Goncar, V. Andreev, L. Letyuk // J. Magnetism and Magnetic Mater. − 2003. − V. 254–255. − P. 544—546.
7. Гончар, А. В. Возможности повышения электромагнитных параметров ферритов для телевизионной техники / А. В. Гончар, В. Г. Андреев, Л. М. Летюк // Изв. вузов. Материалы электрон. техники. − 1998. − № 1. − С. 41—44.
8. Покусин, Д. Н. Комплексная магнитная проницаемость ферритов в области естественного ферромагнитного резонанса / Д. Н. Покусин, Э. А. Чухлебов, М. Ю. Залесский // Радиотехника и электроника. − 1991. − Т. 36, № 11. − С. 2085—2091.
9. Канева, И. И. Исследование возможности получения марганец−цинкового феррита по короткой технологической схеме / И. И. Канева, В. Г. Костишин, В. Г. Андреев, А. Н. Николаев, Е. И. Волкова // Изв. вузов. Материалы электрон. техники. − 2013. − № 1. − С. 23—27. DOI: 10.17073/1609−3577−2013−1−23−27
10. Непомнящий, В. В. Влияние различных технологических методов изготовления порошковых постоянных магнитов на их свойства / В. В. Непомнящий, Т. В. Мосина, А. К. Радченко, В. А. Назаренко // Порошковая металлургия. − 2009. − № 1/2. − С. 143—147.
11. Махнач, Л. В. Влияние оксидных добавок с перовскитоподобной структурой на микроструктуру и некоторые свойства магний−цинкового феррита / Л. В. Махнач, В. А. Ломоносов, В. В. Саевич, М. В. Новицкая, В. В. Паньков // Вестн. БГУ. − Сер. 2. − 2011. − № 1. − С. 10—14.
12. Sunny, V. A flexible microwave absorber based on nickel ferrite nanocomposite / V. Sunny, P. Kurian, P. Mohanan, P. A. Joy, M. R. Anantharaman // J. Alloys and Compounds. − 2010. − V. 489, iss. 1. − P. 297—303.
− 2010. − V. 489, iss. 1. − P. 297—303.
13. Костишин, В. Г. Влияние микроструктуры на свойства радиопоглощающих никель−цинковых ферритов / В. Г. Костишин, Р. М. Вергазов, В. Г. Андреев, С. Б. Бибиков, С. В. Подгорная, А. Т. Морченко // Изв. вузов. Материалы электрон. техники. − 2010. − № 4. − С. 18—22.
14. Kostishyn, V. G. Influence of technological factors on dielectric permeability and radio−wave absorbing characteristics of nickel−zinc ferrites / V. G. Kostishyn, R. M. Vergazov, V. G. Andreev, S. B. Bibikov, A. T. Morchenko, I. I. Kaneva, V. R. Maiorov // Russian Microelectronics. − 2012. − V. 41, N. 8. − P. 31—35.
15. Kostishyn, V. G. Effect of the microstructure on the properties of radio−absorbing nickel−zinc ferrites / V. G. Kostishyn, R. M. Vergazov, V. G. Andreev, S. B. Bibikov, S. V. Podgornaya, A. T. Morchenko // Russian Microelectronics. − 2011. − V. 40, N 8. − P. 574—577.
16. Пат. № 2417268 (РФ). Радиопоглощающий феррит / В. Г. Костишин, Л. В. Кожитов, Р. М. Вергазов, В. Г. Андреев, А. Т. Морченко. Заявл. 27.04.2011 г.
17. Пат. № 2447551 (РФ). Безэховая камера / В. Г. Костишин, Л. В. Кожитов, В. Г. Андреев, А. Т. Морченко, А. Ю. Молчанов. Заявл. от 10.04.2012 г.
Магний в воде — фильтры для очистки воды АКВАФОР
-
Как фильтр-кувшин помогает от накипи и сохраняет в воде полезный для сердца минерал
Основной причиной приобретения кувшинного водоочистителя для большинства покупателей в развитых странах является необходимость удаления из воды солей жесткости (умягчение воды).

-
Больше 60%
людей в мире пьют жесткую водуК солям жесткости относятся соли кальция и магния. Концентрация кальция, как правило, в несколько раз выше, чем концентрация магния. Оба эти иона жесткости в случае их избытка (по данным WHO, более 60% населения в мире пользуются питьевой водой с повышенной жесткостью) ухудшают органолептические свойства воды: при кипячении жесткой воды образуется накипь и появляется пленка на поверхности, ухудшается вкус напитков, особенно чая. Кроме того, высокая жесткость воды создает дополнительную нагрузку на почки.
-
Магний
полезен для работы сердца и сосудовБольшинство фильтров-кувшинов умягчают воду с помощью ионообменной смолы.
Но при этом вместе с уменьшением содержания кальция снижается и концентрация магния, который полезен для работы сердечной мышцы. -
Широко известны два способа добавления магния
в питьевую воду:
-
-
Первый способ основан на том, что значительная часть ионообменной смолы в водоочистителе изначально насыщена ионами магния (находится в магниевой форме). В процессе фильтрации эта смола легко и быстро отдает магний в воду. Например, в одном из вариантов осуществления указанного способа
[патент № EP2094611] от 30% до 70% ионообменной смолы находится в магниевой форме.К сожалению, данный способ существенно уменьшает ресурс модуля по удалению жесткости, и накипь в чайнике начинает выпадать заметно раньше. К тому же, при определенных условиях (высокая соленость или низкий pH), в воду могут попасть значительные количества магния, до 50 мг/л и более, что в случае присутствия сульфат-ионов в исходной воде, сделает ее горькой.

-
-
-
Второй способ основан на добавлении гранул минерала магния в фильтрующую смесь [патент №RU2429067] либо в отдельный контейнер, контактирующий
с очищенной водой [патент №RU2540159]. При контакте с водой гранулы медленно растворяются, и магний переходит в воду.Особенностью этого способа является то, что в воду выделяется относительно небольшое, по сравнению с первым способом, количество магния.
-
-
Обратите внимание
В водоочистителях Аквафор, содержащих магний, использован второй способ добавления небольших и безопасных количеств магния в воду.
Фильтрующая смесь Аквафор
с гранулами минерала магния
МЕТАМОРФОЗЫ МАГНИЯ | Уральское отделение РАН
В лаборатории прочности Института физики металлов УрО РАН разработаны оригинальные методы мегапластической деформации магния и его сплавов при низких температурах. В научный коллектив входят зав. лабораторией прочности ИФМ, главный научный сотрудник, доктор технических наук Алексей Юрьевич Волков, старший научный сотрудник, кандидат физико-математических наук Ольга Владимировна Антонова, инженер-исследователь Владислава Николаевна Петрова, ведущий технолог Александр Леонидович Соколов и ведущий инженер, аспирант Дарья Аркадьевна Комкова. 27-летняя Дарья руководит проектом РФФИ «Структура и механические свойства пластин и фольг, полученных в результате мегапластической деформации магния и его сплавов при различных температурах», которым поддержана работа ученых ИФМ.
Еще студенткой Физико-технологического института УрФУ Дарья Комкова заинтересовалась результатами первых экспериментов по низкотемпературной деформации магния под руководством А. Ю. Волкова. Успешно пройдя летнюю практику, Комкова была приглашена на работу в качестве старшего лаборанта и впоследствии защитила две работы по теме исследований на звание бакалавра и магистра. По окончании УрФУ поступила в аспирантуру ИФМ, которую заканчивает в 2020 году. Ее научный руководитель — А.Ю. Волков. Мы попросили Дарью рассказать о новых методах деформации магния и их преимуществах.
Ю. Волкова. Успешно пройдя летнюю практику, Комкова была приглашена на работу в качестве старшего лаборанта и впоследствии защитила две работы по теме исследований на звание бакалавра и магистра. По окончании УрФУ поступила в аспирантуру ИФМ, которую заканчивает в 2020 году. Ее научный руководитель — А.Ю. Волков. Мы попросили Дарью рассказать о новых методах деформации магния и их преимуществах.
— Магний в прикладном плане — очень перспективный материал. Он имеет высокую удельную прочность и жесткость, обладает хорошими демпфирующими характеристиками (способностью гасить вибрацию) и при этом малой плотностью. Для сравнения: плотность магния равна 1,737 г/см3, что легче железа в 4,5 раза, меди — в 5 раз, титана — в 2,6 раза и алюминия — в 1,5 раза. Благодаря этому магний и его сплавы могут использоваться в авто- и авиастроении для снижения общего веса изделий, что позволит сократить расход топлива и количество вредных выбросов.
Конечно, магний и его сплавы прежде всего известны как конструкционные материалы. Но существуют и другие области применения этого металла. К примеру, разработка новых источников тока на основе магния. Такие батареи могут в будущем стать хорошей заменой для широко распространенных сегодня литий-ионных аккумуляторов (ЛИА). При всех достоинствах ЛИА у них есть недостатки: относительная дороговизна, взрывоопасность, вероятность попадания большого количества вредных веществ в окружающую среду. Магний же обладает высокой энергоемкостью, является недорогим безопасным и экологически чистым материалом. Также магний может использоваться не только для создания источников тока в «традиционной» электронике, но и в активно развивающейся сегодня новой области – транзиентной, или биорастворимой, электронике. Благодаря химической активности и высокой биологической совместимости магния в ультратонкой форме на его основе можно делать биорастворимые транзисторы и простые интегральные схемы, датчики для контроля состояния здоровья, диагностики организма или окружающей среды.
Уже в начале 2000-х гг. израильские ученые сообщили об успешных результатах экспериментов по созданию прототипа твердотельных перезаряжаемых магниевых батарей. Интересно, что в качестве анода в виде пластин толщиной 10–150 мкм планировалось использовать чистый магний. Однако от этой идеи отказались, и анод был изготовлен из магниевого сплава, поскольку получение настолько тонких образцов из чистого металла представляло большую проблему.
Дело в том, что с магнием, при всей его физической «легкости», работать не так-то и легко. Так, получить тонкие листы чрезвычайно трудно из-за малой пластичности магния при комнатной температуре. Это связано с особенностями строения кристаллической решетки металла и деформационных механизмов в процессе обработки. Поэтому прокатка магния, как правило, проводится при повышенных температурах, что вызывает окисление поверхности, укрупнение структуры зерен, развитие острой базисной текстуры. Как следствие, механические свойства материала ухудшаются. Именно поэтому снижение температуры деформации магния и повышение его пластических свойств оказывается важной и непростой научной задачей, которая нас и заинтересовала.
В последнее время изучению влияния различных методов интенсивной пластической (мегапластической) деформации на микроструктуру и механические свойства металлов и сплавов уделяется большое внимание. Результаты показывают, что большие деформационные воздействия могут привести к формированию в магнии ультрамелкозернистой структуры и препятствовать формированию острой текстуры.
Мы разработали несколько новых методов мегапластической деформации магниевых сплавов. Один из них включает два этапа: поперечное выдавливание при комнатной температуре и последующую прокатку. На эту технологию уже получен патент РФ. Цилиндрический образец магния с крупнозернистой структурой помещается в стальной контейнер, у дна которого расположена щель шириной 30 мм и высотой 1 мм. Сверху на образец прикладывается нагрузка, и при достижении определенного давления магний начинает истекать из щели в виде длинной пластины. В результате происходит существенное измельчение зеренной структуры: от нескольких десятков миллиметров в исходной заготовке до ~ 3 мкм в полученной пластине. Структура таких пластин неоднородна: крупные зерна соседствуют с участками более мелких зерен. При этом образцы, вырезанные из полученных пластин, демонстрируют хорошие механические свойства. Мы установили, что степень измельчения и однородность структуры в пластине, а также механические свойства образцов во многом зависят от того, как именно был вырезан цилиндрический образец из крупнокристаллического магниевого слитка, и определили наиболее оптимальный вариант ориентировки исходных заготовок. Пластические свойства полученных 1-миллиметровых магниевых пластин достаточно высоки, и они могут деформироваться прокаткой при комнатной температуре. В результате мы получили магниевые пластины и фольги разной толщины: от 1 мм до 10 мкм. Кроме того, проведены успешные эксперименты по криодеформации магния с получением тонкой магниевой фольги толщиной 30–50 мкм.
В результате происходит существенное измельчение зеренной структуры: от нескольких десятков миллиметров в исходной заготовке до ~ 3 мкм в полученной пластине. Структура таких пластин неоднородна: крупные зерна соседствуют с участками более мелких зерен. При этом образцы, вырезанные из полученных пластин, демонстрируют хорошие механические свойства. Мы установили, что степень измельчения и однородность структуры в пластине, а также механические свойства образцов во многом зависят от того, как именно был вырезан цилиндрический образец из крупнокристаллического магниевого слитка, и определили наиболее оптимальный вариант ориентировки исходных заготовок. Пластические свойства полученных 1-миллиметровых магниевых пластин достаточно высоки, и они могут деформироваться прокаткой при комнатной температуре. В результате мы получили магниевые пластины и фольги разной толщины: от 1 мм до 10 мкм. Кроме того, проведены успешные эксперименты по криодеформации магния с получением тонкой магниевой фольги толщиной 30–50 мкм.
Первые эксперименты по поперечному выдавливанию проводились на технически чистом магнии для отработки методики и изучения фундаментальных особенностей протекания процессов деформации. Однако на практике чаще применяются магниевые сплавы. Между тем эксперименты, проведенные с образцами магниевого деформируемого сплава с содержанием алюминия до 5%, не привели к положительным результатам. Для деформации этого сплава методом поперечного выдавливания при комнатной температуре требовались настолько высокие давления, что не выдерживала оснастка, изготовленная из высокопрочной стали. Мы начали искать другие способы деформации и разработали метод обратного выдавливания с противодавлением. Цилиндрическая заготовка из магниевого сплава также помещается в стальной контейнер, и при воздействии на нее пуансоном (это деталь пресса) сплав начинает течь, заполняя зазор, который имеется между стенкой контейнера и пуансоном. К сожалению, пока нам не удалось провести успешные эксперименты по деформации сплава при комнатной температуре. Требуется предварительный разогрев заготовки до 150°С. В результате получаются образцы в виде стаканчиков с разной толщиной стенки: от 1 до 4 мм. Высота таких стаканчиков — 4–5 см, а диаметр 3–4 см. Стенка, вырезанная из стаканчика, оказалась пластичной для прокатки при комнатной температуре, что позволило получить фольгу из магниевого сплава толщиной 150 мкм и с хорошими прочностными свойствами. Сейчас проводятся эксперименты по получению стаканчиков малого размера высотой от 1 см и диаметром до 8 мм.
Требуется предварительный разогрев заготовки до 150°С. В результате получаются образцы в виде стаканчиков с разной толщиной стенки: от 1 до 4 мм. Высота таких стаканчиков — 4–5 см, а диаметр 3–4 см. Стенка, вырезанная из стаканчика, оказалась пластичной для прокатки при комнатной температуре, что позволило получить фольгу из магниевого сплава толщиной 150 мкм и с хорошими прочностными свойствами. Сейчас проводятся эксперименты по получению стаканчиков малого размера высотой от 1 см и диаметром до 8 мм.
Кроме того, мы разработали метод получения тонких магниевых проволок толщиной до 100 мкм путем химического стравливания оболочек с многожильных медно-магниевых и алюминиево-магниевых композитов разного диаметра. В таких проволоках удается получить зерно с размерами в нанодиапазоне. Мы подробно изучаем структуру и свойства этих уникальных образцов.
Интересно, что полученные нами результаты могут использоваться в медицине при разработке биосовместимых и биоразлагаемых имплантатов. Сегодня основные материалы для ортопедической имплантации — это стали и титановые сплавы, полимерные материалы, которые во многих случаях требуют повторного хирургического вмешательства для извлечения отслужившей конструкции. Кроме того, их механические свойства во многом превосходят свойства человеческой кости, и это может приводить к разрушению и неправильному формированию костной ткани. Магний же обладает плотностью, сопоставимой с плотностью трубчатой кости. Этот элемент в большом количестве присутствует в организме человека, вовлечен во многие биологические механизмы и реакции, может разрушаться с выделением нетоксичных продуктов, имеет высокую биосовместимость с живыми тканями и физиологическими средами. Кстати, применение магния в медицине известно еще с конца XIX века, когда магниевая проволока была использована для сшивания кожных покровов, что приводило к выздоровлению пациента. Пластины и проволоки из магния могут стать хорошим материалом для создания элементов крепежных конструкций, ортопедических имплантатов и сердечно-сосудистых стентов и элементов скрепления тканей, мембран для очистки жидкостей и газов.
Конечно, такие перспективы применения наших методов кажутся пока туманными и вызывают большое количество вопросов. Например, вопрос о коррозионной стойкости материалов, обработанных по предложенным технологиям. У чистого магния достаточно высокая скорость коррозии, что может привести к разрушению имплантата еще до формирования новой здоровой ткани. В связи с этим чаще для медицинских целей рассматривают сплавы с цинком, кальцием, алюминием, которые демонстрируют более высокое сопротивление коррозии. Однако некоторые зарубежные авторы показывают, что создание мелкозернистой структуры в чистом магнии без применения термообработок может положительно сказаться на коррозионной стойкости. Несомненно, впереди у нас еще много работы по изучению влияния различных методов низкотемпературной деформации на структуру и свойства магния и его сплавов, и расстояние между научной разработкой и практическим внедрением зачастую очень велико. Но мы настроены оптимистично, ведь, перефразируя Маяковского, если магний деформируют — значит, это кому-нибудь нужно.
Подготовила
Е. Понизовкина
Месяц:
январь
Номер выпуска:
1-2
Абсолютный номер:
1206
Магний сернокислый /магний сульфат — Новости
| Магний сернокислый (магний сульфат) |
Зачем растениям магний.
- Этот микроэлемент содержится в клетках хлорофилла, его процентное содержание может доходить до 2,7 %. Без него невозможен фотосинтез. Магний необходим для митоза, нормального развития растений, синтеза пектиновых веществ. Активно участвует во всех этапах производства ферментов и активизирует реакции с их участием.

- Ускоряет реакцию превращения кератина в нуклеотид АТФ, который накапливает энергию и распределяет ее по клеткам. Магний улучшает усвоение кальция, фосфора и азота, обеспечивает транспортировку необходимых веществ ко всем частям растения. Способствует производству эфирных масел, сахаров и крахмала, улучшает вкусовые качества зрелых плодов, обеспечивает пышное цветение декоративных растений. С его помощью в растениях синтезируется витамин С.
- Магний концентрируется в интенсивно растущих частях растений, переходя от увядающих частей к молодым. После процесса цветения микроэлемент устремляется к завязи, обеспечивая здоровое развитие плода. В значительных количествах накапливается в семенах, повышенное содержание этого микроэлемента гарантирует хорошую всхожесть.
Признаки дефицита магния.
На недостаточное содержание магния в грунте растение реагирует замедлением всех жизненных процессов. Количество имеющихся клеток хлорофилла сокращается, перестают производиться новые клетки, корневая система перестает расти. Внешне это может выражаться следующими признаками:
- Замедлением роста растения;
- Приобретением нижними листьями светлой окраски, появлением обесцвеченных пятен;
- Скручиванием и опадением листьев;
- Появлением хлороза – светлых участков, расположенных вдоль прожилок листьев;
- Приобретением листьями необычной окраски, например, красной или фиолетовой;
- Измельчанием плодов и цветоносов.
! Ослабленное растение легко поражается грибковыми и бактериальными
заболеваниями. Если не принять вовремя меры, растение погибнет.
Удобрение сульфат магния — состав и свойства.
Основные компоненты удобрения сульфат магния – магний и сера.
Магний – активный участник фотосинтеза, без него растение развиваться не может. Но роль второго компонента – серы, также очень важна.
Сера необходима для поглощения растением азота, при недостатке этого элемента усвоение азота замедляется, снижается эффект от азотистых удобрений. При дефиците серы прожилки листьев становятся светлее, чем окружающая ткань, стебли укорачиваются, теряют эластичность. Замедляется созревание плодов.
При дефиците серы прожилки листьев становятся светлее, чем окружающая ткань, стебли укорачиваются, теряют эластичность. Замедляется созревание плодов.
Сульфат магния — комплексное удобрение, незаменимое в растениеводстве.
Применение сульфата магния в растениеводстве позволяет добиться значительного
улучшения внешнего вида, существенно увеличить урожайность.
! Магний невозможно передозировать – в процессе вегетации растение берет столько, сколько нужно. Остатки удобрения не образуют солей и остаются в неизменном виде, поэтому не ухудшают состояние почвы, а наоборот, улучшают, чем способствуют высокому урожаю в течение нескольких сезонов.
Другие названия сульфата магния – сернокислый магний, кизерит, английская соль, эпсолит, магнезия, горькая соль. В составе удобрения, как правило, содержатся 17 % магния и 13 % серы.
У разных производителей соотношение магния и серы может незначительно отличаться.
Производится в виде небольших кристаллов, обычно белого цвета, иногда с сероватым оттенком. Растворяется без остатка в воде, при температуре воды выше
20 градусов реакция происходит быстрее. Не вызывает сложностей в транспортировке, но требует защиты от прямых солнечных лучей и осадков. Срок годности вещества не ограничен.
Взаимодействие с другими видами удобрений.
Сернокислый магний хорошо взаимодействует с другими видами удобрений, особенно с фосфорными и азотными. Но избыточное содержание магния препятствует нормальному усвоению калия, это необходимо учитывать при внесении химикатов.
! Высокий уровень содержания в почве катионов кальция, азота, калия может замедлить усвоение магния растением, это иногда случается при избыточном внесении калийных удобрений.
Способы внесения.
Основная подкормка.
- Сульфат магния обычно вносят в марте — апреле. Гранулы равномерно распределяют по участку, после чего землю тщательно перекапывают.
 Также возможно внесение удобрений осенью, минусовые температуры не влияют на удобрение.
Также возможно внесение удобрений осенью, минусовые температуры не влияют на удобрение. - Оптимальная температура для растворения сульфата магния – 20 градусов тепла, это необходимо иметь в виду при проведении полива. При низкой температуре почвы кристаллы растворяются медленнее.
- Для внесения магния не имеет значения влажность почвы, но полив необходимо произвести как можно быстрее, чтобы вещество начало действовать, а не лежало бесполезно в земле. В открытых полях наиболее рационально вносить удобрение сульфат магния соответственно прогнозу синоптиков, перед дождем, чтобы сэкономить на поливных работах.
! При высадке рассады или многолетних растений на постоянное место, магнезию вносят в выкопанную лунку вместе с азотсодержащими удобрениями.
- Сернокислый магний хорошо растворяется в воде, поэтому подкормку желательно проводить перед дождем, если дождей не намечается, необходимо обильно полить растения. В течение сезона при необходимости внесение повторяют, используя корневую или внекорневую подкормку.
Прикорневая
- Для проведения подкормки прикорневым способом нужное количество сернокислого магния необходимо тщательно растворить в воде. Температура воды должна быть не ниже 25 градусов. Готовым раствором равномерно поливают участок в радиусе около 50 см от ствола.
- Для удобрения деревьев, кустарников и многолетников возможно внесение сухого вещества. Весной, во время таяния снега, почву вокруг ствола окапывают, сернокислый магний равномерно рассыпают, после чего снова присыпают землей.
Внекорневая
- Магний отлично усваивается не только корнями, но и зелеными листьями. Поэтому опрыскивание листьев раствором магнезии поможет избежать дефицита магния. Это особенно важно во время активного наращивания зеленой массы и в засушливый период.
! Для того, чтобы избежать ожогов листьев, в растворенный магния сульфат добавляют карбамид (мочевину), 5 г на 10 литров воды.
- Проведение внекорневой подкормки следует проводить на рассвете, в пасмурную погоду или вечером. Не рекомендуется проводить при сильном солнечном излучении, повышенных температурах, сильном ветре.
Оксид магния | справочник Пестициды.ru
Информация
Традиционно содержание Магния в удбрениях выражают содержанием Оксида магния. Все свойства Магния, как питательного элемента описаны в статье Магний.
Подробнее »
Химические и физические свойства
Оксид магния – бесцветные кристаллы с кубической кристаллической решеткой.
- Температура плавления – 2827 °С,
- Температура кипения – 3600 °С,
- Плотность при 25 °С составляет 3,58 г/см3.
Свойства оксида магния зависят от температуры его получения. При температуре 500–700 °С получают легкую магнезию – бесцветный порошок. Она легко вступает в реакции с различными кислотами и водой с образованием соответствующих солей и Mg(OH)2, с метанолом дает (CH3O)2Mg.
При взаимодействии с растворами солей легкая магнезия образует основные соли, в частности основные хлориды, которые входят в состав магнезиальных цементов.
В реакции с растворами солей трехвалентных металлов дает двойные основные соли.
Легкая магнезия поглощает влагу и углекислый газ из воздуха. При этом получается основной карбонат магния.
При повышении температуры реакционная способность оксида магния резко снижается. При температуре 1200–1600°С получают тяжелую магнезию или металлургический порошок. Он состоит из крупных кристаллов периклаза, характеризуется стойкостью к кислотам и воде. Тяжелая магнезия при сплавлении с Al2O3, Fe2O3 и другими оксидами металлов образует шпинели, при высокой температуре восстанавливается до металла, в роли восстановителей могут выступать К, Са, Si, CaC2. [2]
[2]
Трехмерная модель молекулы
Трехмерная модель молекулы
Содержание оксида магния в почве и удобрениях
В почве магний содержится в виде сульфатов, карбонатов, хлоридов, силикатов и алюмосиликатов. Преобладают магниевые силикаты. Органическое вещество почвы также имеет в своем составе соединения магния.[1]
Оксид магния содержится в магнийсодержащем сырье, впоследствии непосредственно или после переработки использующемся в качестве удобрения.
Это карбонаты, силикаты магния, его соли, встречающиеся в борных и калийных рудах, а также соли, которые получают из соленых озер и морской воды.
Оксид магния также входит в состав сложных, смешанных и прочих удобрений и отходов промышленности.[1]
Оксид магния получают путем:
- Обжига магнезита MgCO3.
- Обжига домита MgCO3 • CaCO3.
- Обжига основного карбоната Mg.
- Прокаливанием бишофита MgCl2 • 6Н2Oв атмосфере водяного пара.
- Прокаливанием MgCl2 • 6Н2O и других термически нестойких соединений магния.[2]
Оксид магния в растениях
Магний входит в состав хлорофилла. В форме фосфатов присутствует в нуклеинах, фитине и пектиновых веществах.
Неорганические соединения магния обнаружены в клеточном соке растений. Ионы магния активируют ферментную систему киназ, отщепляющих фосфорную кислоту от аденозинтрифосфата и переносящих ее на молекулы сахаров и их производных, на некоторые аминокислоты с образованием новых органических веществ.
Кроме того, магний является составной частью коферментов, активирующих деятельность ферментов группы трансфераз, и участвует в активировании ферментов лимонного цикла.
Существенная роль принадлежит магнию в накоплении аскорбиновой кислоты. Ее молекулы соединяются между собой через магниевый мостик ( – Mg – ), что придает им устойчивость. Очевидно, ионы магния при реакции взаимодействия с нестойкими диэнольными группами аскорбиновой кислоты ослабляют или задерживают ее окисление.
Наиболее сильное стабилизирующее влияние магния наблюдается в кислой среде, за исключением серной кислоты.
Щелочная среда ускоряет разрушение аскорбиновой кислоты, однако и в этом случае присутствие магния, особенно уксуснокислого, уменьшает разрушение.[1]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.
Власюк П.А. Биологические элементы в жизнедеятельности растений. Издательство «Наукова Думка», Киев, 1969
2.
Химическая энциклопедия: в 5 томах: том 2: Даффа – Меди/ Редколлегия: Кнунянц И.Л.(гл.ред) и др. – М.: Советская энциклопедия, 1990. – 671 с.:ил.
Свернуть
Список всех источников
Влияние комбинированного препарата, содержащего магний и пиридоксин, на показатели гемостаза у юношей с первичным пролапсом митрально клапана | Чепурненко
1. Смольнова Т.Ю., Буянова С.Н., Савельев С.В. и др. Фенотипический симптомокомплекс дисплазии соединительной ткани у женщин. Клин мед 2003; 8: 42—8.
2. Суханова Г.А., Баркаган З.С., Котовщикова Е.Ф. Тромботические мезенхимальные дисплазии и их связь с другими тромбофилиями. Гемат трансфуз 2003;6: 13—4.
3. Ягода А.В., Гладких Н.Н. Малые аномалии сердца. Ставрополь, Изд-во СтГМА 2005.
4. Мартынов А.И., Степура О.Б., Шехтер А.Б.и др. Новые подходы к лечению больных с идиопатическим пролабированием митрального клапана. Тер архив 2000; 9: 67—70.
Тер архив 2000; 9: 67—70.
5. Lichodziejewska B, Klos J, Rezler J, et al. Clinical symptoms of mitral valve prolapse are related to hypomagnesemia and attenuated by magnesium supplementation. Am J Cardiol 1997; 79(6): 768-72.
6. Тарасова Н.И. Метод исследования спонтанной агрегации тромбоцитов. Лабораторные методы исследования системы гемостаза. Томск 1980; 94-5.
7. Балуда В.П., Баркаган З.С., Гольдберг Е.Д. Лабораторные методы исследования системы гемостаза. Томск 1980; 219 с.
8. Lazar JMD. Determination of fibrinogen and fibrinolis in small quantities of plasma. Thromb Diath Stutgart 1967; 17: 401.
9. Лычев В.Г. Анализ и методика распознавания основных нарушений гемостаза и условий формирования геморрагического синдрома при лейкозах. Дисс канд мед наук. Барнаул 1975.
10. Lipinski B, Worowski K. Determination of soluble fibrin in small quantities of plasma. Thrombos Diathes Haemorrh 1968; 20(1—2): 44.
11. Бишевский К.М. Антитромбин III и гепаринорезистентность плазмы при ДВС-синдромах, микротромбоваскулитах и тромбозах. Автореф дисс канд мед наук. Новосибирск 1984.
12. Kowalski E, Kopek M, Niwiarowski S. On evaluation of euglobulin method for determination of fibrinolisis. J Clin Pathol 1959; 12: 215-26.
13. Nanigo L, Juet M. Preparation and properties of anticoagulant split producet of fibrinogen and its determination in plasma. Thrombos Diathes Haemorrh 1967; Bd 17(3-4): S440-51.
Thrombos Diathes Haemorrh 1967; Bd 17(3-4): S440-51.
14. Воробьев В.Б., Голубенкова Н.И. Способ определения гепарин-фибриногена в плазме крови. Авторское свидетельство № 1367693 на изобретение 1987.
15. Ваньков Д.Е. Реологические свойства крови при травматическом шоке. Автореф дисс канд мед наук. Ленинград 1971.
16. Сыромятникова Н.В., Гончарова В.А., Котенко Т.В. Метаболическая активность легких. Ленинград 1987.
17. Pierce JB. Heart helthy magnesium. Your nutritional key to cardiovascular wellness. Garden City Park; New York: Avery Publishing Group; 1994.
Магний — Информация об элементе, свойства и применение
Расшифровка:
Химия в ее элементе: магний
(Promo)
Вы слушаете Химию в ее элементе, представленную вам Chemistry World , журнал Королевского химического общества
(конец Promo)
Крис Смит
Привет, на этой неделе мы встречаем вещество, известность которого состоит в том, что в прошлом оно буквально использовалось как лекарство от запора.Но его взрывная роль не ограничивается толстой кишкой, потому что она также является основой зажигательных бомб и даже существования жизни на Земле. И чтобы рассказать историю Магния, вот Джон Эмсли.
Джон Эмсли
Когда-то он был разрушителем городов — теперь он сберегает энергию
Летом 1618 года Англию охватила засуха, но когда Генри Уикер шел по Эпсом-Коммон, он наткнулся на лужу с водой из которого голодный скот отказывался пить. Он обнаружил, что вода горькая на вкус и при испарении выделяется соль, оказывающая замечательный эффект: она действует как слабительное. Она стала известной английской солью (сульфат магния, MgSO 4 ) и стала средством от запора на следующие 350 лет.
Он обнаружил, что вода горькая на вкус и при испарении выделяется соль, оказывающая замечательный эффект: она действует как слабительное. Она стала известной английской солью (сульфат магния, MgSO 4 ) и стала средством от запора на следующие 350 лет.
Первым, кто предположил, что магний является элементом, был Джозеф Блэк из Эдинбурга в 1755 году, а нечистая форма металлического магния была произведена в 1792 году Антоном Рупрехтом, который нагревает магнезию (оксид магния, MgO) с древесным углем.Он назвал элемент austrium в честь своей родной Австрии. Небольшой образец чистого металла был выделен Хамфри Дэви в 1808 году путем электролиза влажного MgO, и он предложил название магний на основе минерального магнезита (MgCO 3 ), который пришел из Магнезии в Греции. Ни одно название не сохранилось, и в конце концов его назвали магнием.
Магний необходим почти для всего живого на Земле — он лежит в основе молекулы хлорофилла, которую растения используют для преобразования углекислого газа в глюкозу, а затем в целлюлозу, крахмал и многие другие молекулы, которые проходят по пищевой цепи.Люди потребляют около 300 мг магния в день, а нам нужно не менее 200 мг, но в организме есть запасы этого элемента в скелете, поэтому дефицит возникает редко.
Миндаль, бразильские орехи, кешью, соевые бобы, пастернак, отруби и даже шоколад богаты магнием. Некоторые марки пива содержат много, например Йоркширский биттер Вебстера — он может быть частично обязан своим вкусом высокому уровню сульфата магния в воде, используемой для его варки.
Магний является седьмым по содержанию элементом в земной коре и третьим по распространенности элементом, если принять во внимание мантию Земли, поскольку он состоит в основном из оливина и пироксена, которые являются силикатами магния.Он также настолько богат морской водой (1200 ppm), что был источником магния для бомб во время Второй мировой войны. Сам металл был получен путем электролиза расплавленного хлорида.
Когда магний начинает гореть, его практически невозможно потушить, поскольку он экзотермически вступает в реакцию с кислородом, азотом и водой. Он горит ярким светом и использовался для фотографических ламп-вспышек. Он стал идеальным зажигательным агентом, и во время некоторых воздушных налетов во время Второй мировой войны целых полмиллиона 2 кг магниевых бомб было бы разбросано по городу в течение часа. .Результатом стали массовые пожары и огненные бури. Объемный металлический магний нелегко воспламеняется, поэтому это должно было происходить с помощью термитной реакции в самом сердце бомбы. В результате термитной реакции между алюминиевым порошком и оксидом железа выделяется более чем достаточно тепла, чтобы магниевый корпус бомбы сильно воспламенился.
Известно много минералов, содержащих магний; но главными из них являются доломит (карбонат кальция и магния, CaMg (CO 3 ) 2 ) и магнезит, добыча которых составляет 10 миллионов тонн в год.Магнезит нагревается, чтобы преобразовать его в магнезию (MgO), и это имеет несколько применений: удобрения; кормовая добавка для крупного рогатого скота; наполнитель пластмасс; и для жаропрочного кирпича для каминов и печей.
Сам металл производится в увеличивающихся количествах. Первоначально он был введен для гоночных велосипедов, которые были первыми транспортными средствами, в которых использовались рамы из чистого магния, обеспечивающие лучшее сочетание прочности и легкости, чем другие металлы. (Стальной каркас почти в пять раз тяжелее магниевого.)
Для использования в качестве металла магний легируется несколькими процентами алюминия плюс следы цинка и марганца для повышения прочности, коррозионной стойкости и сварочных качеств, и этот сплав используется для экономии энергии за счет облегчения деталей. Он используется в сиденьях автомобилей и самолетов, легком багаже, газонокосилках, электроинструментах, дисководах и камерах. По окончании срока службы магний, содержащийся во всех этих продуктах, может быть переработан с очень небольшими затратами. Поскольку это электроположительный металл, магний может действовать как «жертвенный» электрод для защиты железных и стальных конструкций, потому что он предпочтительно разъедает, когда они подвергаются воздействию воды, что в противном случае могло бы вызвать ржавление
Поскольку это электроположительный металл, магний может действовать как «жертвенный» электрод для защиты железных и стальных конструкций, потому что он предпочтительно разъедает, когда они подвергаются воздействию воды, что в противном случае могло бы вызвать ржавление
Крис Смит
Так что лучше велосипеды , лучше бомбы и лучше бомжи.Большое спасибо писателю-ученому Джону Эмсли за рассказ о магнии. На следующей неделе мы расскажем об элементе, который породил лампочку, но над его изображением действительно нужно поработать.
Квентин Купер
Если какой-либо элемент нуждается в изменении PR, то это именно тот. Он хрупкий, склонный к рыхлости и, возможно, глупость периодической таблицы Менделеева. Даже человек, открывший осмий, относился к нему довольно снисходительно. От него воняло — по крайней мере, от некоторых его соединений.Теннант описал «острый и пронзительный запах» как один из «самых отличительных знаков» нового элемента . Он назвал это осмий — осме, что в переводе с греческого означает запах.
Крис Смит
Это Квентин Купер, который будет раздевать осмий для нас на следующей неделе в «Химии в его стихии». Надеюсь, вы присоединитесь к нам. Я Крис Смит, спасибо за внимание, увидимся в следующий раз.
(промо)
(конец промо)
Металлический химический элемент, символ Mg, расположенный в группе IIa периодической таблицы, атомный номер: 12, атомный вес: 24,312.Магний серебристо-белый и очень легкий. Его относительная плотность составляет 1,74, а плотность — 1740 кг / м 3 (0,063 фунта / дюйм 3 или 108,6 фунта / фут 3 ). Магний давно известен в отрасли как более легкий конструкционный металл из-за его небольшого веса и способности образовывать механически стойкие сплавы. Магний очень химически активен, он заменяет водород в кипящей воде, и большое количество металлов может быть произведено термическим восстановлением его солей и окисленных форм магнием.Он соединяется с большинством неметаллов и почти со всеми кислотами. Магний слабо или совсем не реагирует с большинством щелочей и многими органическими веществами, такими как углеводороды, альдегиды, спирты, фенолы, амины, сложные эфиры и большинство масел. Используемый в качестве катализатора магний способствует органическим реакциям конденсации, восстановления, присоединения и дегалогенизации. Его долгое время использовали для синтеза особых и сложных органических компонентов по известной реакции Гриньяра. Основные ингредиенты сплавов: алюминий, марганец, циркон, цинк, редкоземельные металлы и торий.
Применения соединения магния используют в качестве огнеупорного материала в футеровки печей для производства металлов (железо и сталь, цветные металлы), стекло и цемент. Магний в окружающей среде Магний является восьмым по содержанию элементом и составляет около 2% массы земной коры по весу, и это третий по распространенности элемент, растворенный в морской воде. Нет никаких доказательств того, что магний вызывает системное отравление, хотя постоянное чрезмерное потребление добавок и лекарств с магнием может привести к мышечной слабости, вялости и спутанности сознания. Последствия воздействия порошка магния: низкая токсичность и не считается опасным для здоровья.Вдыхание: пыль может раздражать слизистые оболочки или верхние дыхательные пути. Глаза: механическое повреждение или попадание частиц в глаз. Просмотр горящего магниевого порошка без противопожарных стекол может привести к «вспышке сварщика» из-за сильного белого пламени. Кожа: вложение частицы в кожу. Проглатывание: маловероятно; однако прием большого количества порошка магния может вызвать травму. Магний не тестировался, но подозрений на то, что он канцерогенный, мутагенный или тератогенный, не обнаружен. Воздействие дыма оксида магния после сжигания, сварки или работы с расплавленным металлом может вызвать лихорадку от дыма металла со следующими временными симптомами: лихорадка, озноб, тошнота, рвота и мышечные боли.Обычно это происходит через 4-12 часов после воздействия и продолжается до 48 часов. Пары оксида магния являются побочным продуктом горения магния. Физическая опасность: Возможен взрыв пыли, если она в порошковой или гранулированной форме, смешанная с воздухом. В сухом виде оно может заряжаться электростатически в результате завихрения, пневмотранспорта, выливания и т. Д. C Химическая опасность: Вещество может самовоспламеняться при контакте с воздухом или влагой с образованием раздражающих или токсичных паров.Реагирует бурно с сильными окислителями. Реагирует бурно со многими веществами с опасностью пожара и взрыва. Реагирует с кислотами и водой с образованием легковоспламеняющегося газообразного водорода (см. ICSC0001), вызывая опасность пожара и взрыва. Первая помощь: Вдыхание: вынести на свежий воздух. Глаза: тщательно промыть глаза водой. Проконсультируйтесь с врачом. Кожа: тщательно промыть водой с мылом, чтобы удалить частицы. Проглатывание: при проглатывании большого количества порошка магния вызвать рвоту и обратиться к врачу. Примечание для врача: нет специального лечения или противоядия. Рекомендуется поддерживающая терапия. Лечение должно основываться на реакции пациента. Имеется очень мало информации о воздействии дыма оксида магния на окружающую среду. Если другие млекопитающие вдыхают дым оксида магния, они могут испытывать такие же эффекты, как и люди. В спектре окружающей среды 0 — 3 Регистры дыма оксида магния 0.8. Оценка 3 означает очень высокую опасность для окружающей среды, а 0 — незначительную опасность.Факторы, которые принимаются во внимание для получения этого рейтинга, включают степень токсичности материала и / или его отсутствие токсичности, а также меру его способности оставаться активным в окружающей среде и накапливаться ли он в живых организмах. Не учитывает воздействие вещества. Магниевый порошок не считается очень вредным для окружающей среды. Для оксида магния была установлена токсичность для водной среды, равная 1000 ppm. «Характеристики качества воды для опасных материалов», Hann & Jensen, Enviro.Конец. Div., Texas A&M, т. 3 (1974). Подробнее о магнии в воде Вернуться к периодической таблице элементов . Рекомендуемая суточная доза магния |
магний | Описание, свойства и соединения
Магний (Mg) , химический элемент, один из щелочноземельных металлов 2-й группы (IIa) периодической таблицы Менделеева и самый легкий структурный металл.Его соединения широко используются в строительстве и медицине, а магний является одним из элементов, необходимых для всей клеточной жизни.
Encyclopædia Britannica, Inc.
Британская викторина
118 Названия и символы из таблицы Менделеева
Периодическая таблица Менделеева состоит из 118 элементов.Насколько хорошо вы знаете их символы? В этой викторине вам будут показаны все 118 химических символов, и вам нужно будет выбрать название химического элемента, который представляет каждый из них.
| атомный номер | 12 |
|---|---|
| атомный вес | 24,305 |
| точка плавления | 650 ° C (1,202 ° F) |
| 1,994 ° F) | |
| удельный вес | 1.74 при 20 ° C (68 ° F) |
| степень окисления | +2 |
| электронная конфигурация | 1 с 2 2 с 2 2 p 6 с 2 |
Возникновение, свойства и использование
Первоначально известный благодаря таким соединениям, как соли Эпсома (сульфат), магнезия или белая магнезия (оксид) и магнезит (карбонат), сам по себе серебристо-белый элемент не встречается в свободном виде в природе.Впервые он был выделен в 1808 году сэром Хамфри Дэви, который испарил ртуть из амальгамы магния, полученной электролизом смеси влажной магнезии и оксида ртути. Название магний происходит от Магнезии, района Фессалии (Греция), где впервые был обнаружен минерал magnesia alba.
Магний является восьмым по содержанию элементом в земной коре (около 2,5 процента) и третьим по содержанию структурным металлом после алюминия и железа. Его космическая численность оценивается в 9.1 × 10 90 · 10 5 5 90 · 106 атомов (в масштабе, где содержание кремния = 10 90 · 10 5 6 90 · 106 атомов). Он встречается в виде карбонатов — магнезита MgCO 3 и доломита CaMg (CO 3 ) 2 — а также во многих обычных силикатах, включая тальк, оливин и большинство видов асбеста. Он также встречается в виде гидроксида (брусит), хлорида (карналлит, KMgCl 3 ∙ 6H 2 O) и сульфата (кизерит). Он распространен в таких минералах, как серпентин, хризолит и морская вода. В морской воде содержится около 0.13 процентов магния, в основном в виде растворенного хлорида, что придает ему характерный горький вкус.
Магний коммерчески производится электролизом расплавленного хлорида магния (MgCl 2 ), обрабатывается в основном из морской воды и путем прямого восстановления его соединений подходящими восстановителями, например, в результате реакции оксида магния или кальцинированного доломита с ферросилицием ( Пиджион-процесс). ( См. обработка магния.)
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас
Когда-то магний использовался для изготовления ленты и порошка для фотовспышек, потому что в мелкодисперсном виде он горит на воздухе с интенсивным белым светом; он до сих пор находит применение во взрывных и пиротехнических устройствах. Из-за своей низкой плотности (всего две трети от алюминия) он нашел широкое применение в аэрокосмической промышленности. Однако, поскольку чистый металл имеет низкую структурную прочность, магний в основном используется в виде сплавов, в основном с содержанием алюминия, цинка и марганца 10 или менее процентов, для повышения его твердости, прочности на разрыв и способности лить, сваривать. , и обработаны.Для сплавов используются методы литья, прокатки, экструзии и ковки, а дальнейшее изготовление полученного листа, пластины или экструзии осуществляется обычными операциями формования, соединения и механической обработки. Магний является самым легким в обработке конструкционным металлом, и его часто используют, когда требуется большое количество операций механической обработки. Магниевые сплавы имеют ряд применений: они используются для изготовления деталей самолетов, космических кораблей, машин, автомобилей, портативных инструментов и бытовой техники.
По теплопроводности и электропроводности магний и его точка плавления очень похожи на алюминий. В то время как алюминий подвержен действию щелочей, но устойчив к большинству кислот, магний устойчив к большинству щелочей, но легко подвергается воздействию большинства кислот с выделением водорода (важные исключения — хромовая и плавиковая кислоты). При нормальных температурах он устойчив на воздухе и в воде из-за образования тонкой защитной пленки из оксида, но на него воздействует пар.Магний является мощным восстановителем и используется для производства других металлов из их соединений (например, титана, циркония и гафния). Он напрямую реагирует со многими элементами.
Магний встречается в природе в виде смеси трех изотопов: магния-24 (79,0 процентов), магния-26 (11,0 процентов) и магния-25 (10,0 процентов). Изготовлено девятнадцать радиоактивных изотопов; магний-28 имеет самый длительный период полураспада, 20,9 часа, и является бета-излучателем. Хотя магний-26 не является радиоактивным, это дочерний нуклид алюминия-26 с периодом полураспада 7.2 × 10 5 лет. Повышенные уровни магния-26 были обнаружены в некоторых метеоритах, и отношение магния-26 к магнию-24 использовалось для определения их возраста.
Крупнейшие производители магния ко второму десятилетию 21 века включали Китай, Россию, Турцию и Австрию.
Основные соединения
В соединениях магний практически всегда проявляет степень окисления +2 из-за потери или совместного использования двух 3 s электронов.Однако известно небольшое количество координационных соединений со связями магний-магний, LMg ― MgL, в которых центры магния имеют формальную степень окисления +1. Карбонат магния, MgCO 3 , встречается в природе в виде минерального магнезита и является важным источником элементарного магния. Его можно получить искусственно, воздействуя углекислым газом на различные соединения магния. Белый порошок без запаха имеет множество промышленных применений, например, в качестве теплоизолятора для котлов и труб, а также в качестве добавки в пищевых продуктах, фармацевтике, косметике, каучуках, чернилах и стекле.Поскольку карбонат магния гигроскопичен и нерастворим в воде, он был исходной добавкой, которая использовалась для обеспечения сыпучести поваренной соли даже в условиях высокой влажности.
обработка магния
Изделия из магния: разжигатель и стружка, точилка и магниевая лента.
Маркус Бруннер
Гидроксид магния, Mg (OH) 2 , представляет собой белый порошок, получаемый в больших количествах из морской воды путем добавления известкового молока (гидроксида кальция). Он является основным сырьем при производстве металлического магния и используется в качестве антипиреновой добавки.В воде он образует суспензию, известную как молоко магнезии, которое долгое время использовалось как антацидное и слабительное средство.
При действии соляной кислоты на гидроксид магния образуется хлорид магния, MgCl 2 , бесцветное расплывающееся (водопоглощающее) вещество, используемое в производстве металлического магния, в производстве цемента для полов из тяжелых материалов и в качестве добавки. в текстильном производстве. Он также используется для коагуляции соевого молока при производстве тофу.
При обжиге карбоната или гидроксида магния образуется кислородное соединение оксид магния, обычно называемый магнезией, MgO.Это белое твердое вещество, используемое в производстве жаропрочных огнеупорных кирпичей, электрических и теплоизоляционных материалов, цемента, удобрений, резины и пластмасс. Он также используется в медицине как слабительное и антацидное средство.
Сульфат магния, MgSO 4 , представляет собой бесцветное кристаллическое вещество, образующееся в результате реакции гидроксида магния с диоксидом серы и воздухом. Гидратная форма сульфата магния, называемая кизеритом, MgSO 4 ∙ H 2 O, встречается в виде месторождения полезных ископаемых.Синтетически полученный сульфат магния продается как соль Эпсома, MgSO 4 ∙ 7H 2 O. В промышленности сульфат магния используется в производстве цементов и удобрений, а также при дублении и крашении; в медицине служит слабительным средством. Благодаря своей способности легко впитывать воду, безводная форма используется в качестве влагопоглотителя (осушающего агента).
Среди металлоорганических соединений магния важны реактивы Гриньяра, состоящие из органической группы (например, алкилов и арилов), атома галогена, отличного от фтора, и магния.Они используются в производстве многих других видов органических и металлоорганических соединений.
Магний необходим для всех живых клеток, поскольку ион Mg 2+ участвует в жизненно важных биологических полифосфатных соединениях ДНК, РНК и аденозинтрифосфате (АТФ). Функционирование многих ферментов зависит от магния. Магний необходим в качестве катализатора ферментативных реакций в углеводном обмене, примерно в шесть раз меньше калия в клетках человеческого тела.Магний также является важным компонентом зеленого пигмента хлорофилла, который содержится практически во всех растениях, водорослях и цианобактериях. Фотосинтетическая функция растений зависит от действия пигментов хлорофилла, которые содержат магний в центре сложной азотсодержащей кольцевой системы (порфирин). Эти соединения магния позволяют световой энергии управлять преобразованием углекислого газа и воды в углеводы и кислород и, таким образом, прямо или косвенно являются ключом почти ко всем жизненным процессам.
Тимоти П. Хануса
Узнайте больше в этих связанных статьях Britannica:
Магний, Mg
|
Характеристики, свойства и применение магния
Магний является самым легким из всех металлических элементов и в основном используется в конструкционных сплавах из-за его легкости, прочности и устойчивости к коррозии.
Известно более 60 различных минералов с содержанием магния 20% и более, что делает его восьмым по распространенности элементом в земной коре. Но если принять во внимание водные объекты, магний становится самым распространенным элементом на поверхности земли. Это из-за значительного содержания магния в соленой воде, которое в среднем составляет около 1290 частей на миллион (ppm). Тем не менее, несмотря на его изобилие, мировое производство магния составляет всего около 757 000 тонн в год.
Недвижимость
- Атомный символ: Mg
- атомный номер: 12
- Категория элемента: Щелочной металл
- Плотность: 1.738 г / см 3 (20 ° C)
- Точка плавления: 1202 ° F (650 ° C)
- Точка кипения: 1994 ° F (1090 ° C)
- Твердость по Моосу: 2,5
Характеристики
Магний по своим характеристикам похож на его родственный металл — алюминий. Он не только имеет самую низкую плотность среди всех металлических элементов, что делает его самым легким, но также очень прочный, устойчивый к коррозии и легко обрабатывается.
История
Магний был открыт как уникальный элемент в 1808 году сэром Хамфри Дэви, но не производился в металлической форме до 1831 года, когда Антуан Бюсси сделал магний во время эксперимента с дегидратированным хлоридом магния.
Промышленное производство электролитического магния началось в Германии в 1886 году. Страна оставалась единственным производителем до 1916 года, когда военный спрос на магний (для ракетных и трассирующих пуль) привел к производству в США, Великобритании, Франции, Канаде и России.
Мировое производство магния упало между войнами, хотя производство в Германии продолжалось в поддержку нацистской военной экспансии. К 1938 году производство Германии увеличилось до 20 000 тонн, что составляет 60% мирового производства.
Чтобы наверстать упущенное, США поддержали 15 новых предприятий по производству магния, и к 1943 году их производственная мощность составила более 265 000 тонн магния.
После Второй мировой войны производство магния снова упало, поскольку производители изо всех сил пытались найти экономичные методы извлечения металла, чтобы сделать его цену конкурентоспособной со стоимостью алюминия.
Производство
В зависимости от местоположения и типа используемого ресурса для рафинирования металлического магния могут использоваться самые разные методы производства.Это связано как с тем фактом, что магний настолько распространен, что делает возможным производство во многих местах, так и с тем, что конечное использование второстепенного металла настолько чувствительно к цене, что побуждает покупателей постоянно искать источник с наименьшими возможными затратами.
Традиционно магний получают из доломитовой и магнезитовой руды, а также из солевых рассолов, содержащих хлорид магния (естественные солевые месторождения).
Приложения
Из-за своего сходства с алюминием магний может использоваться как замена для многих, если не для большинства, применений алюминия.Однако магний по-прежнему ограничен затратами на его извлечение, из-за чего металл примерно на 20% дороже алюминия. Из-за импортных пошлин на магний, производимый в Китае, цены на магний в США могут почти вдвое превышать цены на алюминий.
Более половины всего магния используется в сплавах с алюминием, которые ценятся за их прочность, легкость и искроустойчивость, и широко используются в автомобильных деталях. Фактически, различные производители автомобилей используют литые магниево-алюминиевые (Mg-Al) сплавы для производства рулевых колес, рулевых колонок, опорных кронштейнов, приборных панелей, педалей и корпусов впускного коллектора, а также многих других деталей.Отливки из Mg-Al в дальнейшем используются для изготовления корпусов трансмиссии и сцепления.
Высокая прочность и коррозионная стойкость имеют решающее значение для аэрокосмических сплавов, а также коробок передач вертолетов и гоночных автомобилей, многие из которых основаны на магниевых сплавах.
Банки из-под пива и содовой не имеют тех же требований, что и аэрокосмические сплавы, но небольшое количество магния используется в алюминиевом сплаве, из которого изготавливаются эти банки. Несмотря на то, что на банку используется лишь небольшое количество магния, эта отрасль по-прежнему остается крупнейшим потребителем металла.
Магниевые сплавы также используются в других отраслях промышленности, где критически важны легкие и прочные сплавы, например, в бензопилах и деталях машин, а также в спортивных товарах, таких как бейсбольные биты и рыболовные катушки.
Сам по себе металлический магний может быть использован в качестве десульферизатора в производстве чугуна и стали, в качестве раскислителя при термическом восстановлении титана, циркония и гафния, а также в качестве шаровидного агента при производстве чугуна с шаровидным графитом.
Также магний используется в качестве анода для катодной защиты в резервуарах для хранения химикатов, трубопроводах и на кораблях, а также в производстве осветительных бомб, зажигательных бомб и фейерверков.
Источники:
Подробную историю магния см. В книге Боба Брауна «История магния», доступной на сайте Magnesium.com. http://www.magnesium.com
USGS. Обзор минерального сырья: магний (2011).
Источник: http://minerals.usgs.gov/minerals/pubs/commodity/magnesium/
Международная магниевая ассоциация. www.intlmag.org
Химия магния (Z = 12) — Chemistry LibreTexts
Магний является элементом второй группы и восьмым по распространенности элементом в земной коре.Магний легкий, серебристо-белый и прочный. Как и алюминий, он образует вокруг себя тонкий слой, предотвращающий ржавление при контакте с воздухом. Мелкие частицы магния также могут загореться при контакте с воздухом. Магний необходим для питания животных и растений. Он также используется в качестве сплава в сочетании с другими металлами, чтобы сделать их легче и легче сваривать, в аэрокосмической промышленности и других отраслях. Он также используется в медицине в форме гидроксидов, сульфатов, хлоридов и цитратов магния.
Общая информация
- Символ: Mg
- атомный номер: 12
- атомная / молярная масса: 24,31
- Точка плавления: 648,8 ° C, 921,8 K
- Точка кипения: 1090 ° C, 1363K
- Плотность: 1,738 г / куб.см
- Степени окисления: +2
- Конфигурация электронной оболочки: [Ne] 3s 2
Характеристики
Магний получил свое название от магнезитовой руды, названной в честь района Магнезия в Фессалии, Греция.Магний — прочный металл, легкий и серебристо-белый. Признанный как элемент еще в 1775 году, он был впервые выделен в чистом виде Дэви в 1805 году. Магний обладает способностью тускнеть, что создает вокруг себя оксидный слой, предотвращающий его ржавление. Он также способен реагировать с водой при комнатной температуре. Под воздействием воды вокруг металла образуются пузырьки. Повышение температуры ускоряет эту реакцию.
Магний Огненный
Одно из свойств магния — высокая воспламеняемость.Как и многие другие вещества, магний более огнеопасен, если у него более высокое отношение площади поверхности к объему. Пример соотношения площади поверхности к объему можно увидеть при розжиге дров. Разжигать растопку и более мелкие ветки легче, чем целое бревно. Это свойство магния используется на войне, фотографии и в лампах. Магний используется на войне для зажигательных бомб, сигнальных ракет и трассирующих пуль. Когда это оружие используется, оно немедленно воспламеняется и вызывает возгорание. Единственный способ потушить огонь магния — это засыпать его песком.Вода не тушит огонь, так как вода вступает в реакцию с горячим магнием и выделяет еще больше водорода.
Приложения
Магний — один из самых легких металлов, и когда он используется в качестве сплава, он обычно используется в автомобильной и авиационной промышленности. Использование магния увеличилось и достигло пика в 1943 году. Одна из причин увеличения использования магния заключается в том, что он полезен в сплавах. Сплавы с магнием лучше свариваются и легче, что идеально подходит для металлов, используемых в производстве самолетов и других товаров военного назначения.
Еще одной характеристикой магния является то, что он помогает в процессе пищеварения. Магний обычно используется в молоке магнезии и английской соли. Эти формы магния могут варьироваться от гидроксида магния, сульфата магния, хлорида магния и цитрата магния. Магний помогает не только людям и животным, но и растениям. Он используется для преобразования солнечного света в энергию для растений в процессе, известном как фотосинтез. Главный компонент этого процесса — хлорофилл.Это молекула пигмента, состоящая из магния. Без магния фотосинтез, как мы знаем, был бы невозможен.
Изотопы
Магний имеет три стабильных изотопа: Mg-24, Mg-25, Mg-26. Самый распространенный изотоп — Mg-24, который составляет 79% всего Mg, обнаруженного на Земле. Mg25 и Mg26 используются для изучения абсорбции и метаболизма магния в организме человека. Их также используют для изучения болезней сердца.
Магний содержит не только стабильные изотопы, но и радиоактивные изотопы, которые представляют собой изотопы с нестабильными ядрами.Это изотопы Mg — 22, Mg23, Mg-27, Mg-28 и Mg-29. Mg-28 обычно использовался на ядерных объектах для научных экспериментов с 1950-х по 1970-е годы.
Реакция с
Вода: При воздействии пара магний превращается из магния в оксид магния и водород.
\ [Mg (s) + H_2O (g) \ rightarrow MgO (s) + H_2 (g) \]
При воздействии холодной воды реакция немного иная. Реакция не прекращается, потому что гидроксид магния не растворяется в воде.
\ [Mg (s) + 2H_2O (g) \ rightarrow Mg (OH) _2 (s) + H_2 (g) \]
Кислород: Под воздействием кислорода магний превращается в оксид магния.
\ [2MgO (s) + O_2 (g) \ rightarrow 2MgO (s) \]
Водород: Под воздействием водорода магний превращается в гидрид магния.
\ [Mg (s) + H_2 (g) \ rightarrow MgH_2 (s) \]
Азот: При взаимодействии с азотом магний превращается в нитрид магния.
\ [3Mg (s) + N_2 (g) \ rightarrow Mg_3N_2 (s) \]
Галогены: При взаимодействии с галогеном магний очень реактивен.- (водн.) + H_2 (г) \]
Основания: При взаимодействии с основаниями реагирует магний.
Список литературы
- Avedesian, M. M. и Hugh Baker. Магний и магниевые сплавы . Парк материалов, Огайо: ASM International, 1999. Печать.
- Коуэн, Дж. А. Биологическая химия магния . Нью-Йорк: ВЧ, 1995. Печать.
Проблемы
- Почему магний не ржавеет?
- Почему нельзя тушить магнием водой?
- Какие изотопы используются для исследований сердца?
- Почему магний обычно используется для создания автомобилей и самолетов?
- Какова обычная степень окисления магния?
Решения
- Потому что он может потускнеть — способность создавать тонкий оксидный слой вокруг металла.
- Потому что вода выделяет водород при воздействии горячего магния.
- Mg25 и Mg26
- Потому что его можно комбинировать с другими металлами, чтобы сделать их легче и легче сваривать.
- +2
Авторы и авторство
- Райан Ким (Калифорнийский университет в Дэвисе)
- Авнет Кахлон (Калифорнийский университет в Дэвисе)
Физические свойства
— Международная ассоциация магния
Документ без названия
Магний используется как в чистом виде, так и в виде сплава.В зависимости от состава металла могут быть заметные различия во многих физических свойствах. Приведенные ниже данные в основном относятся к чистому магнию, однако несколько распространенных сплавов также включены в данные и будут соответственно отмечены.
Об элементе Магний
- Серебристый, белый металл
- Обозначается Mg в таблице Менделеева
- Атомная # 12
- Атомная масса 24,305
- Атомный радиус 0.160 нм (6,3×10-9 дюймов)
- Часть s-блока и группа 2А (щелочноземельные металлы)
- Имеет два валентных электрона
- Имеет 3 природных изотопа с массовыми числами 24,25 и 26
- Имеет гексагональную кристаллическую структуру с плотной упаковкой (ГПУ) в чистом виде
- Стандартное состояние твердое при температуре 298К
- При плотности 1,7 г / см3 (106,13 фунта / фут3) при 20 ° C (68 ° F) он наименее плотный из конструкционных металлов
Тепловые свойства
Точка кипения : 1107 ± 10 ° C (2024.6 ± 50 ° F)
Энтальпия :
| T (° C) | Т (° F) | Энтальпия (кДж / кг) | Энтальпия (БТЕ / фунт) |
| 127 | 260,6 | 107 | 46,0 |
| 227 | 440.6 | 218 | 93,7 |
| 427 | 800,6 | 454 | 195,2 |
| 627 | 1160,6 | 709 | 304,8 |
| 727 | 1340,6 | 1202 | 516,8 |
| 1127 | 2060.6 | 7287 | 3132,8 |
| 1727 | 3140,6 | 7800 | 3353,4 |
| 2727 | 4940,6 | 8656 | 3721,4 |
Энтропия :
| T (° C) | Т (° F) | Энтропия (кДж / кг • К) | Энтропия (БТЕ / фунт • F °) |
| 20 | 68 | 1.34 | .320 |
| 127 | 260,6 | 1,65 | .394 |
| 327 | 620,6 | 2,11 | . 504 |
| 527 | 980,6 | 2,46 | . 588 |
| 727 | 1340.6 | 3,15 | . 752 |
| 927 | 1700,6 | 3,41 | .814 |
| 1027 | 1880,6 | 3,52 | . 840 |
| 1127 | 2060,6 | 7,62 | 1,82 |
| 1727 | 3140.6 | 7,93 | 1,89 |
| 2727 | 4940,6 | 8,27 | 1,98 |
Теплота сгорания : 25,1 МДж / кг (10,791,06 БТЕ / фунт)
Теплота плавления : На удельную теплоту плавления незначительно влияет легирование, что означает, что значения для сплавов и чистого магния близки. Теплота плавления чистого магния равна 0.370 ± 0,015 МДж / кг (159,07 ± ± 6,45 БТЕ / фунт).
Теплота испарения :
| T (° C) | Т (° F) | Теплота испарения |
| Температура кипения | Температура кипения | 5,26–5,65 |
| 438 | 820.4 | 5,69 |
| 829 | 1524,2 | 5,51 |
Точка плавления / Диапазон :
| Сплав | Т (° С) | Т (° F) |
| Чистый магний | 650 | 1202 |
| AZ91D | 470-595 | 875-1105 |
| AZ81 | 490-610 | 915-1130 |
| AM20 | 618-643 | 1145-1190 |
| AM50A | 543-620 | 1010-1150 |
| AM60B | 540-615 | 1005-1140 |
| AE42 | 565-620 | 1050-1150 |
| AE42 | 565-620 | 1050-1150 |
Удельная теплоемкость :
| T (° C) | Т (° F) | Удельная теплоемкость (кДж / кг • K) | Удельная теплоемкость (БТЕ / фунт • ° F) |
| -253 | -423.4 | .015 | .004 |
| 27 | 80,6 | .914 | ,218 |
| 127 | 260,6 | 1.026–1.084 | .245-.259 |
| 327 | 620,6 | 1,178 | . 281 |
| 527 | 980.6 | 1,277-1,278 | .305 |
| 649 (цельный) | 1200,2 (цельный) | 1,361 | . 325 |
| 650 (жидкость) | 1202 (жидкость) | 1,323 | ,316 |
| 727 | 1340,6 | 1,357–1,358 | .324 |
| 827 | 1520,6 | 1,402–1,403 | .335 |
| 1127-2727 (газ) | 2060,6-4940,6 (газ) | 8,563 | 2,045 |
Теплопроводность : Теплопроводность магния незначительно зависит от колебаний температуры. Легирование оказывает большое влияние на теплопроводность.Значения теплопроводности рассчитываются на основе значений электропроводности.
Чистый магн Эсиум:
| Т (° С) | Т (° F) | Теплопроводность (Вт / м • К) | Теплопроводность (БТЕ / ч • фут • ° F) |
| -173 | -279.4 | 169 | 97,65 |
| 0 | 32 | 157 | 90,71 |
| 20 | 68 | 147-168 | 84.94-97.07 |
| 25 | 77 | 156 | 90,14 |
| 50 | 122 | 149 | 86.09 |
| 100 | 212 | 148 | 85,51 |
| 200 | 392 | 146-163 | 84,36-94,18 |
| 300 | 572 | 145 | 83,78 |
| 400 | 752 | 130-143 | 75.11-82,62 |
Коэффициент линейного теплового расширения : Легирование оказывает минимальное влияние на значение коэффициента.
| T (° C) | Т (° F) | Удельная теплоемкость (кДж / кг • K) |
| 0-160 | 32-320 | 27,3 |
| 20–100 | 68-212 | 26.0-26,1 |
| 20-200 | 68-392 | 27,0–27,1 |
| 20-300 | 68-572 | 27-28 |
| 20-400 | 68-752 | 28,9 |
| 20-500 | 68-932 | 29 |
Усадка при затвердевании : Величина усадки, которая возникает, когда чистый магний переходит из жидкого состояния в твердое, относительно объема жидкого металла, составляет 2.96-4,20% жидкого объема.
Электрические характеристики
Электропроводность :
| Сплав | Электропроводность при 20 ° C (68 ° F) (МС / м) |
| AZ31 | 10 |
| 18,5% МАКО | |
| AZ61 | 8.28 |
| 11,6% МАКО | |
| AZ63 | 15% МАКО |
| AZ81 | 7,3 |
| 12% МАКО | |
| AZ91 | 7,1 |
| 10,1% МАКО | |
| AZ8 | 7.5 |
| AZ41 | 9,7 |
Удельное электрическое сопротивление :
| Сплавы при 100 ° C (212 ° F) | Удельное электрическое сопротивление (нОм • м) | Удельное электрическое сопротивление (нОм • дюйм) |
| AM20 | 89 | 3503.9 |
| AE42 | 98 | 3858,3 |
| AS21 | 104 | 4094,5 |
| AM50 | 122 | 4803,1 |
| AZ91 | 163 | 6417,3 |
| Чистый магний | 60 | 2362.0 |
Чистый магний при различных температурах :
| T (° C) | Т (° F) | Удельное электрическое сопротивление (нОм • м) | Электрическое сопротивление (нОм • дюйм) |
| 20 | 68 | 44-45 | 1732.3-1771,7 |
| 50 | 122 | 50,1 | 1972,4 |
| 100 (экструдированный) | 212 (экструдированный) | 58,5 | 2303,1 |
| 100 | 212 | 56 | 2204,7 |
| 300 (экструдированный) | 572 (экструдированный) | 93 | 3661.4 |
| 300 | 572 | 95 | 3740,2 |
| 400 (экструдированный) | 752 (экструдированный) | 121 | 4763,8 |
| 600 | 1112 | 170 | 6692,9 |
| 649 (цельный) | 1200.2 (сплошной) | 154 | 606 |
| 650-900 (жидкость) | 1202-1652 (жидкость) | 274-288 | 10787-11339 |
Другая недвижимость
Скорость звука : В чистом магнии при комнатной температуре — 4602-4800 м / с (15,098,43-15,748,03 фут / с)
Поверхностное натяжение : В чистом магнии оно линейно в диапазоне температур 681-894 ° C (1257.8–1641,2 ° F). Когда добавляются элементы Li, Ca, Sb, Sr, Pb, Ba или Bi, поверхностное натяжение снижается. Для твердого магния поверхностное натяжение, близкое к -273 ° C (-459,4 ° F), составляет 1,447 Н / м (0,099 фунта / фут), а при 25 ° C (77 ° F) оно составляет 0,190 Н / м (0,013 фунта / фут). ).
Значения для жидкого магния :
| T (° C) | Т (° F) | Давление (кПа) | Давление (фунт / дюйм2) |
| 650 | 1202 | .570 | .039 |
| 650 | 1202 | .556 | .038 |
| 681 | 1257,8 | . 563 | .039 |
| 700 | 1292 | . 542 | .037 |
| 700 | 1382 | .550 ± 0,15 | .038 ± .010 |
| 750 | 1382 | . 526 | .036 |
| 894 | 1641,2 | . 502 | .034 |
Давление пара для чистого жидкого магния :
| T (° C) | Т (° F) | Напряжение (Н / м) | Напряжение (фунт / фут) |
| 620 | 1148 | .13 | .019 |
| 727 | 1340,6 | 1,1 | .160 |
| 827 | 1520,6 | 4,5 | .652 |
| 877 | 1610,6 | 8,8 | 1,28 |
| 900 | 1652 | 13 | 1.89 |
| 1027 | 1880,6 | 51 | 7,40 |
| 1190 | 2174 | 203 | 29,44 |
| 1330 | 2426 | 507 | 73,53 |
Динамическая вязкость :



 Также возможно внесение удобрений осенью, минусовые температуры не влияют на удобрение.
Также возможно внесение удобрений осенью, минусовые температуры не влияют на удобрение.