Отзывы Нейромидин, цены, инструкции по применению
Рекомендуемые товары
Нейромидин принимаю во время тренировок для укрепления самочувствия и повышения концентрации мышц и суставов для длительной тренировки или пробежки. Знакомый, который участвует в марафоне также использует данный препарат. Однако использовать его рекомендую по назначению врача, если к его приёму нет противопоказаний. Цена достойна внимания, препарат рекомендую к приобретению.
Уже несколько лет борюсь с остеохондрозом, возник в поясничном отделе. Нейромидин выписал невролог чтобы снизить болевой симптом. Был назначен вместе с другими. Цена хорошая, таблеток в упаковке много. В течении месяца я стал замечать сдвиг. Спина перестала так беспокоить, возникло расслабление в пояснице. Таблетка быстро проникает в кровь, хорошо стимулирует.
Пожаловалась неврологу на усталость и мне прописали нейромидин. Колоть уколы оказалось не больно, а вот эффективность приятно порадовала. Он стоит своей цены, ведь я стала подвижной благодаря ему, правда после инъекций сохраняется легкий успокаивающий эффект, но так и должно быть. После препарата мышцы работают очень хорошо, а у меня как раз с ними проблемы.
org/Review»>Мой сын стоит на учете у психиатра с диагнозом ЗПР, ОНР — умеренное поражение рече-двигательных зон головного мозга. Лечились много чем, но Нейромидин пожалуй показал самый большой эффект, движения стали точнее, начала появляться речь, правда немного появилась общая возбужденность, но мы это гасим успокоительными средствами. По стоимости конечно не мало, но цена оправдана.
Покупаю Нейромидин для мамы, для лечения её нервной системы. Только это и спасает! К счастью, нам попался очень грамотный врач, который индивидуально рассчитывал маме дозировку и потом даже переводил её с инъекций на таблетки для того, чтобы обеспечить хороший эффект. Дай ей Бог здоровья! После этого препарата маме моей наконец-то полегчало, она теперь, по её словам, «чувствует себя полноценным человеком», чего мы и добивались!
После аварии задело нерв на ноге.
 Дошло до того, что не могла нормально вставать с постели, с трудом передвигалась. Врачи посоветовали препарат Нейромидин. Цена, конечно большая, но препарат очень помог. Кололи внутримышечно. Что хочется выделить-так это быстродействие препарата и безболезненный укол.. Быстро ставит на ноги. Так же заметила улучшение памяти.
Дошло до того, что не могла нормально вставать с постели, с трудом передвигалась. Врачи посоветовали препарат Нейромидин. Цена, конечно большая, но препарат очень помог. Кололи внутримышечно. Что хочется выделить-так это быстродействие препарата и безболезненный укол.. Быстро ставит на ноги. Так же заметила улучшение памяти.При неврите доктор сказал принимать препарат Нейромидин. Хорошо, что препарат оказался по приемлемой цене и я смог себе позволить его купить. Препарат оказался без побочных действий и положительный образом повлиял целиком на мой организм. Принимал я препарат по одной таблетке 3 раза в сутки на протяжении двух месяцев. Очень понравился препарат, который помог српвиться с болезнью.
В качестве профилактики атонии кишечника я принимаю Нейромидин, сразу скажу, что очень дорого! Я студентка и позволить себе такое не могу, денег на остальное не хватает, а так препарат хороший, действие его заметно, а то иногда бывает, что и дорогие препараты не помогают. Но здесь совсем другая ситуация, поставила бы твердую пятёрку, если бы не стоимость!
Ипидакрин инструкция по применению, цена, аналоги, показания, совместимость, отзывы
Московское шоссе, д. 191 (3)
Московское шоссе, д. 37 (4)
Московское шоссе, д. 9 (7)
9 (7)
пер. Камчатский, д.1 (4)
пл. Комсомольская, д.6 (6)
пл. Революции, д.5 (7)
пл. Советская, остановка общ.транспорта (4)
пр-кт Гагарина, д. 113 (4)
113 (4)
пр-кт Героев, д. 26 (4)
пр-кт Ленина, д. 2 (7)
пр-кт Ленина, д. 67 (5)
пр-т. Бусыгина, д.19 (5)
пр-т. Бусыгина, д.45А (4)
Бусыгина, д.45А (4)
пр-т. Гагарина, д.107 (5)
пр-т. Гагарина, д.184 (5)
пр-т. Гагарина, д.222 (4)
пр-т. Гагарина, д.4 (3)
пр-т. Гагарина, д.84 (5)
Гагарина, д.84 (5)
пр-т. Кораблестроителей, д.22 (6)
пр-т. Кораблестроителей, д.25 (5)
пр-т. Кораблестроителей, д.4 (7)
пр-т. Ленина, д.16 (6)
пр-т. Ленина, д.28А (6)
Ленина, д.28А (6)
пр-т. Ленина, д.41 (5)
пр-т. Ленина, д.44 (5)
пр-т. Ленина, д.57 (6)
пр-т. Октября, д.13 (2)
пр-т. Октября, д.25 (3)
Октября, д.25 (3)
пр. Гагарина, д. 48 (4)
пр. Кораблестроителей, у д. 22/1 (5)
пр. Молодёжный, д. 19 (5)
ул. 40 лет Победы, д. 4 (6)
ул. Адмирала Васюнина, д.1, к.1 (4)
Адмирала Васюнина, д.1, к.1 (4)
ул. Адмирала Макарова, д.3, к.2 (6)
ул. Академика Сахарова, д.109 (4)
ул. Артельная, д.5А (3)
ул. Базарная, д.8 (6)
ул. Баранова, д. 9 (6)
Баранова, д. 9 (6)
ул. Батумская, д.1А (6)
ул. Бекетова, д. 18 (6)
ул. Бекетова, д. 66 (6)
ул. Белинского, д.118/29 (7)
ул. Белинского, д.87 (5)
Белинского, д.87 (5)
ул. Березовская, д. 111 (6)
ул. Богородского, д.5, к.1 (5)
ул. Большая Покровская, д.29 (3)
ул. Большая Покровская, д.63 (4)
ул. Бориса Корнилова, д.2 (4)
Бориса Корнилова, д.2 (4)
ул. Бориса Панина, д.10 (5)
ул. Бориса Панина, д.4 (6)
ул. Бурденко, д.18 (5)
ул. Буревестника, д.16 (5)
ул. Васенко, д.3 (6)
Васенко, д.3 (6)
ул. Веденяпина, д.10 (4)
ул. Веденяпина, д.18 (3)
ул. Верхне-Печерская, д. 14 (5)
ул. Верхне-Печерская, д.4, к.1 (4)
ул. Верхне-Печерская, д.5 (6)
Верхне-Печерская, д.5 (6)
ул. Военных Комиссаров, д.1 (5)
ул. Волжская Набережная, д.25 (4)
ул. Гаугеля, д.1 (4)
ул. Генерала Зимина, д. 2 (6)
ул. Генерала Ивлиева, д. 39 (3)
Генерала Ивлиева, д. 39 (3)
ул. Генерала Ивлиева, д.33, корп.1 (2)
ул. Героя Прыгунова, д. 10 (5)
ул. Горная, д.11 (6)
ул. Движенцев, д.14 (6)
ул. Долгополова, д.17/38 (5)
Долгополова, д.17/38 (5)
ул. Дьяконова, д.20 (3)
ул. Дьяконова, д.24А (5)
ул. Есенина, д.14 (4)
ул. Есенина, д.41 (5)
ул. Ефремова, д. 16 (4)
Ефремова, д. 16 (4)
ул. Зайцева, д.17 (5)
ул. Звездинка, д.3А (8)
ул. Иванова Василия, д.14, к.1 (6)
ул. Ижорская, д. 18 (5)
ул. Карла Маркса, д. 16 (6)
Карла Маркса, д. 16 (6)
ул. Карла Маркса, д. 20 (6)
ул. Карла Маркса, д.47 (5)
ул. Касьянова, д.1 (4)
ул. Коминтерна, д. 160 (5)
ул. Коминтерна, д. 4/2 (5)
Коминтерна, д. 4/2 (5)
ул. Коминтерна, д.172 (7)
ул. Комсомольская, д.4 (7)
ул. Космическая, д. 34, корп. 2 (6)
ул. Космонавта Комарова, д.16 (4)
ул. Краснодонцев, д.1 (5)
Краснодонцев, д.1 (5)
ул. Краснодонцев, д.23 (5)
ул. Краснодонцев, д.9 (7)
ул. Краснозвездная, д.31 (5)
ул. Куйбышева, д.1 (6)
ул. Культуры, д. 13 (6)
Культуры, д. 13 (6)
ул. Культуры, д.14 (5)
ул. Культуры, д.3 (4)
ул. Львовская, д.3 (4)
ул. Львовская, д.7 (4)
ул. Маршала Рокоссовского, д.4 (4)
Маршала Рокоссовского, д.4 (4)
ул. Маршала Рокоссовского, д.8А (6)
ул. Мончегорская, д. 16А, корп 1, пом п1 (5)
ул. Мончегорская, д.15а (4)
ул. Мончегорская, д.7А (5)
ул. Народная, д.38 (5)
Народная, д.38 (5)
ул. Ногина, д.9 (3)
ул. Окская, д. 2 (3)
ул. Октябрьской революции, д.42 (5)
ул. Переходникова, д. 29 (6)
ул. Переходникова, ст.м. Пролетарская (6)
Переходникова, ст.м. Пролетарская (6)
ул. Планетная, д. 36 (3)
ул. Плотникова, д. 5 (4)
ул. Политбойцов, д.8 (4)
ул. Полтавская, д.16 (5)
ул. Республиканская, д.25 (3)
Республиканская, д.25 (3)
ул. Родионова, д. 165, корп. 10 (7)
ул. Родионова, д. 5 (4)
ул. Родионова, д.189/24 (5)
ул. Родионова, д.195 (7)
ул. Романтиков, д. 5 (5)
Романтиков, д. 5 (5)
ул. Светлоярская, д.24 (6)
ул. Светлоярская, д.32 (6)
ул. Семашко, д.33/58 (3)
ул. Сергея Акимова, д.34 (6)
ул.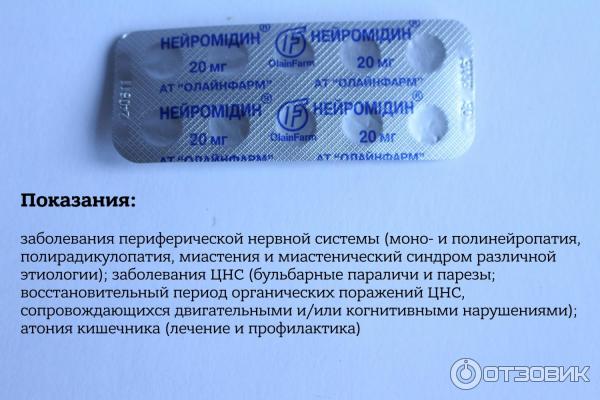 Сергея Есенина, д. 32 (4)
Сергея Есенина, д. 32 (4)
ул. Снежная, д. 25А (4)
ул. Телеграфная, д.3 (6)
ул. Тонкинская, д.7А (5)
ул. Фруктовая, д.5 (4)
ул. Чаадаева, д.28 (3)
Чаадаева, д.28 (3)
ул. Школьная, д.34 (4)
ул. Щербинки I, д.11 (3)
ул. Южное шоссе, д.16 (4)
ул. Южное шоссе, д.44 (4)
ул. Южное шоссе, д.28, к.1 (7)
Южное шоссе, д.28, к.1 (7)
ул. Ярошенко, д.1 (6)
ул.Коминтерна, д. 168 (5)
ш. Казанское, д.5 (4)
ш. Южное, д. 21в (с ул.Старых производственников) (5)
шоссе Казанское, д. 10, корп. 3 (4)
10, корп. 3 (4)
РазвернутьСвернуть
отзывы пациентов о применении, подробная инструкция
Преимущества:На время эффективно избавляет от симптомов болезни, безболезненные уколы
Недостатки:Очень дорогой, помогает не сразу, эффект временный. препарат не лечит, побочные эффекты, трудно достать
Диабетом я страдаю уже 12 лет, два года назад поставили диагноз «диабетическая полинейропатия». Слабость в мышцах была жуткой, ноги ночами сводило судорогой, ощущение жжения сменял холодок и потеря чувствительности. Но с глотанием и речью пока все было нормально, потому врач сказал, что у меня все еще не так плохо.Нейромидин я принимала в виде инъекций — уколы всегда лучше таблеток. Препарат дико дорогой, всего 10 ампул, а стоят 1300 примерно. Мне по 2 укола делали в день, а лечилась я вначале 2 недели. В общем, потратилась сильно. Уколы сами не болезненные, рассасываются хорошо, шишками не мучилась. Кроме боли от проникновения иглы ничего и не чувствовала. Эффект я заметила уже спустя неделю — ночами перестали судороги мучить. Постепенно проходили и ощущение онемения, и чувство холодка, они к концу лечения исчезли. С мышечной слабостью все было не так прекрасно, но тоже неплохо — примерно на 40% ее меньше стало, но обещанного быстрого эффекта по всем фронтам я не получила, потому продлили еще на 2 недели лечение.А вот тогда дело пошло хорошо, к концу 3 недели уже получается сила в мышцах все-таки появилась, а когда лечение было завершено, я, наверное, на помешавшуюся от своей радости походила — чувствовала себя здоровой. Да, если болезнь еще не очень сильная, помогает вот так сравнительно быстро и сильно. Но курсы приема препарата нужно проводить не раз и не два, это как поддерживающая терапия, потому что со временем признаки болезни снова дают о себе знать. Эффект постепенно сходит на нет — шикарно я себя чувствовала только полтора месяца, а потом очень медленно, но все же стало все возвращаться. Потому курсами лечусь — спустя каждые 3,5 месяца. Очень дорого выходит, не каждый может себе позволить, да и побочные все-таки есть — сильно потею, голова очень сильно болит, спустя 2,5-3 недели всегда диарея начинается, да еще аритмия…
Эффект постепенно сходит на нет — шикарно я себя чувствовала только полтора месяца, а потом очень медленно, но все же стало все возвращаться. Потому курсами лечусь — спустя каждые 3,5 месяца. Очень дорого выходит, не каждый может себе позволить, да и побочные все-таки есть — сильно потею, голова очень сильно болит, спустя 2,5-3 недели всегда диарея начинается, да еще аритмия…
показания, состав и форма выпуск, способ применения, противопоказания, условия хранения, срок годности, отзывы
Нейромидин при грыже позвоночника устраняет сильные боли в области шейного или поясничного отдела позвоночника (даже при обострении заболевания), восстанавливает работу мышечных волокон, а также нервных окончаний, локализованных в области пораженного участка.
Нейромидин производят в форме таблеток и в виде раствора как для подкожного, так и для внутримышечного введения.
Показания к применению
Нейромидин за счет широкого спектра действия назначают не только при межпозвоночной грыже, но и при таких заболеваниях, как:
- множественные поражения нервов;
- невралгические синдромы различной этиологии;
- выраженный болевой синдром от сдавливания спинномозговых корешков;
- аутоиммунные нервно-мышечные заболевания;
- мононевропатия;
- синдром Ламберта-Итона;
- потеря тонуса и снижение перистальтики кишечника.
Также препарат выступает вспомогательным медикаментозным средством в рамках комплексной восстановительной терапии при органических поражениях ЦНС, которые сопровождает спектр двигательных и когнитивных нарушений.
Состав и форма выпуска
Активное соединение данного лекарственного средства – гидрохлорид ипидакрина.
Нейромидин производят в форме таблеток и в виде раствора как для подкожного, так и для внутримышечного введения.
Таблетки круглой формы, серо-белого оттенка, имеют фаску. Одна упаковка содержит 10 таблеток, каждая из которых включает 20 мг активного вещества.
Одна упаковка содержит 10 таблеток, каждая из которых включает 20 мг активного вещества.
Стеклянная ампула с раствором объемом 1 мл содержит 5 мг гидрохлорида ипидакрина. Одна упаковка включает 10 ампул.
Способ применения и дозы
При грыже позвоночника невролог назначает пациенту следующую дозировку препарата в таблетках: 0,5 -1 таблетку Нейромидина употребляют с небольшим количеством жидкости 2-3 раза в сутки.
При грыже позвоночника невролог назначает пациенту Нейромидин в таблетках либо в ампулах.
Если врач для лечения межпозвоночной грыжи выписывает данное лекарственное средство в форме раствора, то дозировка препарата в этом случае будет такой: от 5 до 15 мг раствора вводят подкожно или внутримышечно 2 раза в день.
Точную дозировку лекарства определяет врач.
Вещество, всасываясь в кровоток, начинает действовать через 40-60 минут после приема первой дозы препарата.
Побочные действия
К побочным эффектам, возникающим при приеме лекарственного средства, относят:
- слезотечение и чрезмерное потоотделение;
- диарею, тошноту, диспепсию, боли в области желудка;
- учащенное сердцебиение;
- понижение артериального давления;
- головную боль.
К побочным эффектам, возникающим при приеме Нейромидина, относят диарею.
Противопоказания
Запрещено принимать Нейромидин пациентам в следующих случаях:
- непереносимость лактозы;
- боль в грудной клетке груди, спровоцированная недостатком кровоснабжения;
- язвенная болезнь желудка;
- расстройства вестибулярного аппарата;
- эпилептические припадки;
- непроходимость мочеиспускательного канала или кишечника механической природы;
- повышенная чувствительность к одному из составляющих препарата;
- двигательная дисфункция, возникающая из-за повреждения базальных ганглиев;
- бронхиальная астма.

Нельзя управлять автомобилем и сложными механизмами в период лечения Нейромидином, т. к. препарат оказывает негативное влияние на управление транспортным средством и на выполнение задач, требующих предельной внимательности (скорость психомоторных реакций снижается).
Warning: file_get_contents(https://www.googleapis.com/youtube/v3/videos?id=BRlIOUEc8QU&part=id,contentDetails,snippet&key=AIzaSyBneuqXGHEXQiJlWUOv23_FA4CzpsHaS6I): failed to open stream: HTTP request failed! HTTP/1.0 403 Forbidden
in /var/www/u0456645/data/www/gryzha.guru/wp-content/themes/ortopedia03/functions.php on line 1384
Warning: file_get_contents(https://www.googleapis.com/youtube/v3/videos?id=muz8F7yJuQU&part=id,contentDetails,snippet&key=AIzaSyBneuqXGHEXQiJlWUOv23_FA4CzpsHaS6I): failed to open stream: HTTP request failed! HTTP/1.0 403 Forbidden
in /var/www/u0456645/data/www/gryzha.guru/wp-content/themes/ortopedia03/functions.php on line 1384
Warning: file_get_contents(https://www.googleapis.com/youtube/v3/videos?id=XlgW_Eh_h44&part=id,contentDetails,snippet&key=AIzaSyBneuqXGHEXQiJlWUOv23_FA4CzpsHaS6I): failed to open stream: HTTP request failed! HTTP/1.0 403 Forbidden
in /var/www/u0456645/data/www/gryzha.guru/wp-content/themes/ortopedia03/functions.php on line 1384
Беременность и лактация
Медикаментозное средство Нейромидин нельзя принимать в период беременности, т. к. действующее вещество, входящее в его состав, повышает тонус матки, создавая риск выкидыша плода.
Также запрещено употреблять лекарство при грудном вскармливании.
Применение в детском возрасте
Детям, не достигшим 18 лет, прием препарата запрещен из-за отсутствия необходимой информации о воздействии активного вещества, находящегося в составе медикаментозного средства, на организм ребенка.
Медикаментозное средство Нейромидин нельзя принимать в период беременности.
Длительность лечения
Средняя длительность терапии медикаментом (форма препарата не учитывается) при лечении межпозвоночной грыжи составляет 3 недели.
В условиях осложненного течения заболевания курс лечения таблетками врач продлевает до 1,5-2 месяцев.
При необходимости повторный прием медикамента назначают с перерывом в 2 месяца после последнего пройденного курса лечения.
Длительность курса посредством введения раствора равна 14 дням. При необходимости терапию продлевают до 1 месяца по решению лечащего врача.
Взаимодействие с другими препаратами
Нейромидин при совместном приеме с препаратами, угнетающими ЦНС, усиливает выраженность их седативного эффекта.
Если употреблять м-холиномиметические средства в комбинации с данным препаратом, то риск возникновения побочных эффектов от приема Нейромидина увеличивается.
При совместном приеме Нейромидина с бета-адреноблокаторами возникает нарушение сердечного ритма.
Препарат допустимо употреблять совместно с ноотропными средствами.
Совместимость с алкоголем недопустима, т. к. комбинация веществ приводит к многочисленным побочным эффектам.
Передозировка
К симптомам, возникающим при приеме чрезмерных доз лекарственного средства, относят:
- слезотечение;
- непроизвольные колебательные движения глаз высокой частоты;
- слабость, апатичность и сонливость;
- скачки артериального давления;
- непроизвольное мочеиспускание и дефекацию;
- бронхоспазм;
- желтуху.

Условия отпуска из аптек
Препарат продается в аптеках строго по рецепту врача.
Условия хранения
Хранить Нейромидин необходимо при температуре, не превышающей 25°C, в защищенном от света, безопасном для детей и домашних животных месте.
Срок годности
Использовать таблетки Нейромидин допустимо в течение 5 лет со дня их изготовления, а раствор – в течение 3 лет.
Отзывы
Екатерина, 23 года, Подольск: «При невропатии лицевого нерва врач выписал таблетки Нейромидин. Уже через 4 дня начала свободно закрывать и открывать рот. Когда левая рука начала терять чувствительность из-за межпозвоночной грыжи, невролог снова выписал это лекарство, но уже в виде уколов. Инъекции помогли за 2 дня. Эффективное средство».
Иван, 44 года, Москва: «Не знаю, чтобы я делал, если бы не этот препарат. Месяц назад не мог разогнуться из-за обострения грыжи позвоночника. После недельного курса уколов чувствую себя хорошо. Двигательная активность вернулась. Рекомендую делать уколы».
Светлана, 57 лет, Гжель: «Средство эффективное, но имеет ряд противопоказаний. Необходимо обращать внимание на аннотацию к нему, учитывать возраст и наличие хронических заболеваний».
Григорий, 40 лет, Самара: «При приеме Нейромидина появились побочные эффекты в виде бронхоспазма и аритмии. Врач отменил курс лечения. Но жена продолжала пить таблетки и чувствовала себя хорошо. Ей лекарство помогло снять сильные боли при межпозвоночной грыже за 1 неделю».
Константин, 29, Москва: «Хороший препарат, доступный широкому кругу покупателей за счет демократичной цены. Помогли уколы. Лучшие рекомендации».
Аптека 63 Плюс
г. Жигулевск, мкр В-1, д. 20
г. Жигулевск, ул. Мира, д. 6
Мира, д. 6
г. Нефтегорск, ул. Нефтяников, д. 23Г
г. Новокуйбышевск, пр-кт Победы, д. 22
г. Новокуйбышевск, пр-кт Победы, д. 35
г. Новокуйбышевск, пр-кт Победы, д. 9
г. Новокуйбышевск, ул. Белинского, д. 7, кв 1/2
г. Новокуйбышевск, ул. Миронова, д. 8
г. Новокуйбышевск, ул. Пирогова, д. 18
г. Октябрьск, ул. Аносова, д. 51
г. Октябрьск, ул. Ленина, д. 49
г. Октябрьск, ул. Мира, д. 167
Октябрьск, ул. Мира, д. 167
г. Отрадный, ул. Победы, д. 7
г. Отрадный, ул. Сабирзянова, д. 11
г. Похвистнево, ул. Комсомольская, д. 34
г. Самара, пр-кт Кирова, 425
г. Самара, Пугачевский тр-т, д. 66
г. Самара, 24 км. Московского ш., д. 5 (ТК «МЕГА»)
г. Самара, пр-кт Карла Маркса, д. 510В
г. Самара, пр-кт Кирова, д. 104
г. Самара, пр-кт Кирова, д. 170
Самара, пр-кт Кирова, д. 170
г. Самара, пр-кт Кирова, д. 233/148
г. Самара, пр-кт Кирова, д. 304
г. Самара, пр-кт Ленина, д. 14
г. Самара, пр-кт Ленина, д. 6
г. Самара, пр-кт Металлургов, д. 76/60
г. Самара, пр-кт Металлургов, д. 9/42
г. Самара, Пугачевский тракт, д. 74
г. Самара, ул. 22 Партсъезда, д. 38
г. Самара, ул. Аэродромная, д. 113
г. Самара, ул. Аэродромная, д. 12
Самара, ул. Аэродромная, д. 12
г. Самара, ул. Аэродромная, д. 47 (ТЦ «Аврора»)
г. Самара, ул. Аэродромная, д. 72
г. Самара, ул. Белорусская, д. 92
г. Самара, ул. Владимирская, д. 35А
г. Самара, ул. Гагарина, д. 155А
г. Самара, ул. Гагарина, д. 16/30
г. Самара, ул. Гагарина, д. 64
г. Самара, ул. Гагарина, д. 95
г. Самара, ул. Галактионовская, д. 130
г. Самара, ул. Георгия Димитрова, д. 4
Самара, ул. Георгия Димитрова, д. 4
г. Самара, ул. Георгия Димитрова, д. 7
г. Самара, ул. Дыбенко, д. 120А
г. Самара, ул. Дыбенко, д. 30 — ТРК Космопорт
г. Самара, ул. Зои Космодемьянской, д. 12
г. Самара, ул. Ивана Булкина, д. 80
г. Самара, ул. Клиническая, д. 32
г. Самара, ул. Красноармейская, д. 121
г. Самара, ул. Красноармейская, д. 131 (ТЦ «Гудок»)
г. Самара, ул. Куйбышева, д. 71 / пл. Революции-2
г. Самара, ул. Ленинская, д. 301 / Полевая, д. 59
Самара, ул. Ленинская, д. 301 / Полевая, д. 59
г. Самара, ул. Мичурина, д. 137А
г. Самара, ул. Мичурина, д. 48
г. Самара, ул. Ново-Вокзальная, д. 146А
г. Самара, ул. Ново-Садовая / ул. Губанова, д. 232/28
г. Самара, ул. Ново-Садовая, д. 179
г. Самара, ул. Ново-Садовая, д. 181
г. Самара, ул. Ново-Садовая, д. 198
г. Самара, ул. Ново-Садовая, д. 24
г. Самара, ул. Ново-Садовая, д. 349
г. Самара, ул. Ново-Садовая, д. 381
Самара, ул. Ново-Садовая, д. 381
г. Самара, ул. Осетинская, д. 11
г. Самара, ул. Партизанская, д. 174
г. Самара, ул. Пензенская, д. 72А
г. Самара, ул. Победы, д. 112 / пр-кт Кирова, д. 50
г. Самара, ул. Победы, д. 131
г. Самара, ул. Победы, д. 140
г. Самара, ул. Победы, д. 92
г. Самара, ул. Полевая, д. 7/236
г. Самара, ул. Полевая, д. 9
г. Самара, ул. Придорожная, д. 9
Самара, ул. Придорожная, д. 9
г. Самара, ул. Революционная, д. 133
г. Самара, ул. Сергея Лазо, д. 62
г. Самара, ул. Советская, д. 42
г. Самара, ул. Советской Армии, д. 220
г. Самара, ул. Солнечная, д. 24
г. Самара, ул. Солнечная, д. 9А
г. Самара, ул. Ставропольская, д. 86
г. Самара, ул. Стара Загора, д. 139
г. Самара, ул. Стара Загора, д. 167А
г. Самара, ул. Стара Загора, д. 52
Стара Загора, д. 52
г. Самара, ул. Стара Загора, д. 59
г. Самара, ул. Ташкентская, д. 93
г. Самара, ул. Фрунзе, д. 90
г. Самара, ш. Московское / ул. Георгия Димитрова, д. 292
г. Самара, ш. Московское, д. 28
г. Самара, ш. Южное, д. 5 (ТК «АМБАР»)
г. Сызрань, пр-кт 50 лет Октября, д. 2
г. Сызрань, пр-кт 50 лет Октября, д. 24
г. Сызрань, пр-кт 50 лет Октября, д. 42
г. Сызрань, пр-кт 50 лет Октября, д. 54А
Сызрань, пр-кт 50 лет Октября, д. 54А
г. Сызрань, пр-кт 50 лет Октября, д. 59
г. Сызрань, пр-кт Космонавтов, д. 1
г. Сызрань, ул. Интернациональная, д. 151А
г. Сызрань, ул. Красильникова, д. 53
г. Сызрань, ул. Красноуральская, д. 14Б
г. Сызрань, ул. Лазо, д. 13
г. Сызрань, ул. Локомобильная, д. 33
г. Сызрань, ул. Мира, д. 3Б
г. Сызрань, ул. Московская, д. 10
г. Сызрань, ул. Свердлова, д. 3
Сызрань, ул. Свердлова, д. 3
г. Сызрань, ул. Советская, д. 38
г. Сызрань, ул. Советская, д. 6
г. Сызрань, ул. Советская, д. 76
г. Сызрань, Ульяновское шоссе, д. 19
г. Тольятти, б-р 50 лет Октября, д. 59
г. Тольятти, б-р 50 лет Октября, д. 9А
г. Тольятти, Ленинский пр-кт, д. 17
г. Тольятти, Московский пр-кт, д. 39А
г. Тольятти, пр-кт Степана Разина, д. 10
г. Тольятти, пр-кт Степана Разина, д. 59Б
Тольятти, пр-кт Степана Разина, д. 59Б
г. Тольятти, Приморский б-р, д. 22/22
г. Тольятти, ул. 60 лет СССР, д. 15
г. Тольятти, ул. 70 лет Октября, д. 46
г. Тольятти, ул. 70 Лет Октября, д. 51
г. Тольятти, ул. Автостроителей, д. 40А
г. Тольятти, ул. Ворошилова, д. 57
г. Тольятти, ул. Горького, д. 29
г. Тольятти, ул. Дзержинского, д. 5А
г. Тольятти, ул. Жилина, д. 54
г. Тольятти, ул. Л.Чайкиной, д. 69Б
Тольятти, ул. Л.Чайкиной, д. 69Б
г. Тольятти, ул. Ленина, д. 78
г. Тольятти, ул. Ленина, д. 90
г. Тольятти, ул. Ленина, д. 98
г. Тольятти, ул. Льва Яшина, д. 5
г. Тольятти, ул. Маршала Жукова, д. 42А
г. Тольятти, ул. Мира, д. 152
г. Тольятти, ул. Мира, д. 35
г. Тольятти, ул. Победы, д. 74
г. Тольятти, ул. Революционная, д. 11Б
г. Тольятти, ул. Революционная, д. 24
Тольятти, ул. Революционная, д. 24
г. Тольятти, ул. Революционная, д. 52А
г. Тольятти, ул. Революционная, д. 66
г. Тольятти, ул. Свердлова, д. 49
г. Тольятти, ул. Толстого, д. 12
г. Тольятти, ул. Тополиная, д. 16
г. Тольятти, ул. Тополиная, д. 1Б
г. Тольятти, ул. Тополиная, д. 35
г. Тольятти, ул. Фрунзе, д. 6
г. Тольятти, ул. Юбилейная, д. 25Б
г. Тольятти, ул. Юбилейная, д. 2Г
Юбилейная, д. 2Г
г. Тольятти, ш. Южное, д. 79
г. Чапаевск, ул. Калинина, д. 36А
г. Чапаевск, ул. Куйбышева, д. 10
г. Чапаевск, ул. Ленина, д. 98
г. Чапаевск, ул. Орджоникидзе, д. 13
г. Чапаевск, ул. Щорса, д. 100
п. Алексеевка, ул. Невская, д. 31
п. Безенчук, ул. Мамистова, д. 6
п. Безенчук, ул. Мамистова, д. 71А
п. Безенчук, ул. Рабочая, д. 72
п. Береза, кв-л 3-й, д. 4
Береза, кв-л 3-й, д. 4
п. Кинельский, ул. Южная, д. 19
п. Мирный, ул. Комсомольская, д. 3Г
п. Новосемейкино, ул. Мира, д. 7А
п. Петра Дубрава, ул. 60 лет Октября, д. 8
п. Прибрежный, ул. Труда, д. 6/9
п. Стройкерамика, ул. митрополита Иоанна Снычева, д. 2
п. Управленческий, ул. Сергея Лазо, д. 17/3
пос. Красная Глинка, 2 кв-л, д. 21
с. Большая Глушица, ул. Советская, д. 41
Советская, д. 41
с. Большая Раковка, ул. Комсомольская, д. 73
с. Большая Черниговка, ул. Советская, д. 137Б
с. Елховка, ул. Советская, д. 17В
с. Камышла, ул. Победы, д. 41А
с. Кинель-Черкассы, ул. Куйбышевская, д. 47
с. Кинель-Черкассы, ул. Ленинская, д. 34
с. Кошки, ул. 60 лет Октября, д. 33
с. Красноармейское, ул. Ленина, д. 20
с. Красный Яр, ул. Больничная, д. 44В
с. Красный Яр, ул. Комсомольская, д. 105
Красный Яр, ул. Комсомольская, д. 105
с. Красный Яр, ул. Комсомольская, д. 267А
с. Пестравка, ул. Крайнюковская, д. 79
с. Приволжье, ул. 50 лет Октября, д. 4А
с. Хворостянка, пл. Плясункова, д. 12А
с. Челно-Вершины, ул. Центральная, д. 7Г
с. Шентала, ул. Вокзальная, д. 43А
отзыв и инструкция по применению
Сегодня в моем первом, к слову, отзыве после долгой паузы знакомимся с новым аюрведическим героем, который особенно важен для страдающих демодекозом и другими некрасивыми проблемами с кожей. Азадирахта индийская, или ним, или маргоза. Скромное вечнозеленое широколиственное дерево родом из Индии. Встречается и в Индокитае. Так, в сиануквильской деревне Отрес в Камбодже нимовый куст рос аккурат рядом с моим домом. Если бы не мой осведомленный гость из Сием-Рипа – вайшнав-брахмачари родом из Индонезии – никогда бы не опознала драгоценного растения.
Расскажем ниже следующее.
- Полезные свойства нима.

- Инструкция по применению капсул.
- Ним
ЗАПИСАТЬСЯ НА ПОЛНЫЙ КУРС ПО ЛЕЧЕНИЮ ДЕМОДЕКОЗА И РОЗАЦЕА: ПОЛНОСТЬЮ И НАВСЕГДА. БЕЗ АНТИБИОТИКОВ И ЯДОВИТЫХ МАЗЕЙ!
Дерево ним глазами Аюрведы и современной медицины
В народе индийском его именуют природной аптекой. Аюрведические писания прославляют его выдающиеся целебные свойства и называют «благословенным деревом». Это одно из ключевых и широко употребляемых лекарственных растений в Аюрведе.
Для современной западной медицины с ее нерасторопностью neem был открыт сравнительно недавно. Однако ООН скоропостижно наградил его званием «дерево 21-го века». Причина – способность растения излечивать огромный список заболеваний, но при этом не вызывать совершенно никаких негативных побочных эффектов. Много ли обычной химической фармацевтики может похвастать такими рыцарскими качествами!..
Полезные свойства азадирахты:
- Глистогонное
- Помогает избавиться от грибка на всех частях тела.
- Антибактериальное
- Противовирусное
- Антидиабетическое
- Успокоительное
- Препятствует образованию перхоти.
- Кровоочистительное средство
- Помогает избавиться от паразитов
- Чистит организм изнутри, вызволяя шлаки, токсины.
- Ствол, корни и кора обладают вяжущими, общеукрепляющими, противомалярийными свойствами.
- Рекомендуются для профилактики и лечения болезней кожи: нейродермит, псориаз, проказа, экзема, крапивница, фурункулез. Также используется для устранения угревой сыпи, акне.
И самое главное в рамках нашего блога, в котором так много внимания уделяется проблеме демодекоза. В порошке или капсулах маргозы содержится пестицид азадирахтин. Он наповал убивает клеща демодекс, но, в отличие от трихопола и других антибиотиков, совершенно безвреден для нас самих.
Когда я провожу личные консультации по лечению демодекоза, таблетки нима являются неизменно одним из ключевых аюрведических лекарств. Это самое сильное, безвредное и эффективное средство от угревой железницы. Правда, им одним для полного излечения от приставучего демодекоза все-таки отделаться не получится. Нужен комплекс мер, львиная доля которых приведена в статьях на этом сайте под тегом демодекоз.
Это самое сильное, безвредное и эффективное средство от угревой железницы. Правда, им одним для полного излечения от приставучего демодекоза все-таки отделаться не получится. Нужен комплекс мер, львиная доля которых приведена в статьях на этом сайте под тегом демодекоз. - Устраняет стоматологические болезни: пародонтоз, кариес, гингивит.
- Помогает восстановить иммунитет.
- Балансирует работу всех органов и систем в организме.
- Останавливает развитие и доброкачественных, и злокачественных опухолей.
Инструкция по применению Neem Himalaya, в т.ч. при демодекозе
О варианте от популярного индийского производителя Гималаи я упоминаю, т.к. это самый распространенный и доступный на сегодня вариант капсул нима. На самом деле порошок или таблетки от Khadi, Patanjali и др. брендов ничем не уступают по качеству раскрученному Хималаи.
Главное свойство любых растительных добавок – они действуют плавно и мягко. Выраженный эффект гарантирует только систематическое применение азадирахты. Поэтому не торопимся делать выводы спустя неделю от начала приема.
Опытным путем я и вот уже около сотни моих подопечных страждущих демодекозом, розацеа и акне, прошедших через мои руки, блоги и говорливый речевой аппарат, установили следующее. Оптимальная схема лечения демодекоза во время обострения должна быть следующей.
- Лечебная доза – по 2 капсулы 2 раза в день
- За 30 минут до приема пищи. Это важно.
- Длительность приема в интенсивной дозировке – полтора-два месяца.
- Профилактическая доза – 1 шт 2 р в день. Так же, за полчаса до еды.
- Пропивать такие курсы нужно раз в 3 месяца по 30 дней.

Получается, для интенсивного лечения понадобится 3-4 упаковки Neem Himalaya. Для профилактики достаточно одной. Но курсы нужно проводить регулярно и всегда. Всю жизнь. Как мы любим.
Однако аюрведическая схема лечения демодекоза не может быть ограничена только азадирахтой внутрь и снаружи. Потому что необходимо комплексное восстановление: иммунитет, желудочно-кишечный тракт, гормональная и нервная система. В обозримом будущем выложу наконец здесь материал с полным списком аюрведических лекарств первой помощи, которые очень хорошо помогают не просто купировать, но ВЫЛЕЧИТЬ это кожное заболевание.
Все мои материалы о лечении демодекоза смотрите в этой рубрике.
Кстати, порошок я вовсе никому не рекомендую поедать внутрь себя, поскольку слишком он горький. Ощущения примерно как в детстве, когда при отравлении чем-то сожранным с пола мама отпаивала левомицетином. Который с ненавистью ко всему человечеству фармацевты зачем-то производили в форме порошка.
Но порошковый вариант может быть актуален в качестве зеленой косметики.
Где купить все это добро в проверенном качестве и с хорошим сервисом, читайте в последнем разделе сей публикации.
Neem purifying skin, или пара слов о нимовой косметике
Косметические препараты на основе маргозы можно условно поделить на три типа.
- Neem Oil, масло нима.
Очень густое, резковато пахнет. Невероятно горькое, как и сама пудра из листьев. Добывается из семян методом холодного отжима. Где заказать хорошее и качественное, тоже смотрите внизу статьи.
Собственно, мы лечим демодекоз только так: бьем растительным пестицидом по клещу и изнутри, и снаружи. - Порошок.
Я не моргнув глазом предпочту ему более практичное масло. Но если второго нет, а первый – есть, то почему бы не побаловаться лечебными масками антиакне. - Промышленные средства на основе экстракта благородного дерева.
Например, у нас есть отзыв о неплохой пенке для проблемной кожи от той же Himalaya – читайте здесь.
Еще можно делать шампуни с азадирахтой, от которых волосы начинают расти быстрее, усиливаются здоровый блеск и густота.
Также ним любят добавлять в антивозрастные кремы и лосьоны, где он бесподобен как омолаживающий элемент.
И очень индийский вариант – зубные пасты и всевозможные ополаскиватели для рта. Очень полезны для десен и хороши тотальным антибактериальным и противовоспалительным эффектами.
Еще пара слов о масле нима
Нерафинированное масло обладает специфическим запахом и очень горьким вкусом. Существуют рафинированный вариант, но, проходя очистку, он теряет целый ряд своих полезных активных веществ.
Помогает коже справиться с различными видами высыпаний на коже и глубокими загрязнениями в том числе. Оно регулирует работу сальных желез и обладает противовоспалительным эффектом, поэтому поможет подросткам в периоды атаки многочисленных гормональных высыпаний и проблемной жирной кожи.
Основными показаниями для применения станут: крапивница, стригущий лишай, экзема, дерматиты, псориаз, фурункулы, демодекоз, розацеа.
Активные вещества:
- азадирахтин – наш главный пестицидный секрет;
- олеиновая кислота;
- пальмитиновая кислота;
- арахидоновая кислота;
- витамины Е, А, С;
- медь;
- серосодержащие компоненты;
- изовалериановая кислота.
Противопоказания:
- Маслу ним присуще очень мощное противозачаточное действие, поэтому оно противопоказано к применению беременным женщинам и парам, планирующим зачать ребенка.
- Специалисты также не рекомендуют наносить масло ним на кожу в чистом виде, так как не исключено проявление аллергической реакции, вызванной индивидуальной непереносимостью.
Где купить Neem в капсулах, порошке и Oil
Приведу два хорошо известных мне источника.
- Интернет-магазин Аюрведы Market.MartaThai.ru
Несложно догадаться, что это наш семейный проект: аюрведические лекарства, косметика и другие товары из Индии по низким ценам с доставкой по всему миру.Капсулы Neem PatanjaliКапсулы Neem Himalaya - IHerb.com
Не нуждается в представлении. Американский огромный магазин, где все подороже и доставка порой кусается в цене. Но качество всего и вся там всегда на высоте.
Подходит жителям всего мира. Здесь скорее пишу о нем, чтобы читатели не из СНГ не расстраивались, ибо туда демократичный в ценах Gandhari не отправляет.
Любимые продукты оттуда смотрите также ниже.
Ссылки на проверенные мною товары из этих магазинов:
Капсулы нима на IHerb, 100 шт – 7 $
Масло нима на IHerb, 30 мл – 6,5 $
Мой промокод на АйХерб – YEV7034. Если заказываете впервые, вводите его и получите скидку в 5 % от заказа.
С пожеланиями гладкой кожи, чистоты тела и помыслов, искренне ваша, красотка Marta.
Камбоджа, Сиануквиль, апрель 2019 г.
Поделиться ссылкой:
Понравилось это:
Нравится Загрузка…
Таблеточный раствор Нейромидина — инструкция по применению, отзывы
Нейромидин — синтетический препарат, применяемый при лечении заболеваний центральной и периферической нервной системы.
Фармакологическое действие
Нейромедин как антихолинэстеразное средство стимулирует нервно-мышечную передачу и способствует нормализации проведения нервных импульсов в нервной системе, пораженных любой патологией.
Кроме того, препарат увеличивает секрецию слюнных желез и тонус гладкой мускулатуры, улучшает память, обладает слабо выраженным седативным действием.
Форма выпуска
Нейромидин выпускается в двух лекарственных формах:
- Таблетки белого цвета в патрубке круглой формы с фаской по 10 штук в контуре упаковки.
 Каждая таблетка содержит 20 мг активного вещества Нейромидина — ипидакрина гидрохлорид. Вспомогательные вещества — картофельный крахмал, моногидрат лактозы и стеарат кальция;
Каждая таблетка содержит 20 мг активного вещества Нейромидина — ипидакрина гидрохлорид. Вспомогательные вещества — картофельный крахмал, моногидрат лактозы и стеарат кальция; - В виде прозрачного раствора для подкожных или внутримышечных инъекций в ампулах по 1 мл, по 5 и 10 ампул в упаковке.Каждый флакон содержит 5 или 15 мг ипидакрина гидрохлорида.
Доступны также аналоги нейромидина. К ним относятся препарат Аксамон в виде таблеток и Амиридин в виде таблеток и раствора для инъекций. При необходимости применения аналога нейромидина проконсультируйтесь с врачом.
Показания к применению нейромидина
Нейромедин инструкция по применению для лечения заболеваний центральной и периферической нервной системы:
- Моно- и полинейропатии;
- Бульбарный паралич и парез;
- Myasthenia gravis;
- Poliradikulopatii;
- Миастенический синдром различной этиологии.
Нейромидин также применяется для лечения и профилактики атонии кишечника и периода восстановления органических поражений центральной нервной системы, сопровождающихся двигательными или когнитивными нарушениями.
Противопоказания
Нейромидин противопоказано применять при следующих заболеваниях:
- Экстрапирамидные расстройства с гиперкинезами;
- Эпилепсия;
- Вестибулярные расстройства;
- Механическая непроходимость кишечника или мочевыводящих путей;
- Бронхиальная астма;
- Язвенная болезнь желудка или двенадцатиперстной кишки в фазе обострения;
- брадикардия;
- Ангина.
При беременности повышенная чувствительность к препарату в возрасте до 18 лет, и в период кормления грудью противопоказано применять Нейромидин.
Соблюдайте осторожность, когда Нейромидин:
- Тиреотоксикоз;
- Острые респираторные заболевания;
- Язвенная болезнь желудка и двенадцатиперстной кишки;
- Заболевания сердечно-сосудистой системы.

Инструкция по применению нейромидина
Продолжительность лечения и дозы Нейромидина по инструкции зависят от степени тяжести заболевания:
- При тяжелых нарушениях нервно-мышечной проводимости (миастенический криз) в начале лечения применяют по 15-30 мг для инъекций, затем можно принимать внутрь по 1-2 таблетки нейромидина до пяти раз в сутки;
- При заболеваниях периферической нервной системы, в том числе полирадикулопатии, моно- и полинейропатии, миастеническом синдроме и миастении различной этиологии, Нейромидин перед приемом одной таблетки обычно назначают от одного до трех раз в сутки или по 5-15 мг внутримышечно или подкожно до двух раз в сутки.Как правило, лечение длительное, не менее одного месяца. При необходимости можно повторить несколько раз, после перерыва 1-2 месяца;
- При заболеваниях центральной нервной системы, в том числе бульбарных параличах и парезах, а также в период выздоровления при органических поражениях центральной нервной системы сосудистого, травматического и другого происхождения назначают в течение 2-6 месяцев по 0,5-1 нейромидину. таблетка до трех раз в день;
- Для лечения и профилактики атонии кишечника в течение 1-2 недель назначают по 1 таблетке Нейромидина несколько раз в сутки.
Максимальная суточная доза нейромидина по инструкции — 200 мг.
побочных эффекта
По отзывам Нейромидин может вызывать:
- Брадикардия;
- Желтуха;
- потливость;
- Слюнотечение;
- Повышенная секреция бронхов;
- Диарея;
- Сердцебиение;
- Судороги;
- тошнота;
- Боль в эпигастрии.
Чаще всего при применении в высоких дозах Нейромидин вызывает: общую слабость, головокружение, рвоту, головную боль, кожные аллергические реакции, сонливость. В этих случаях желательно уменьшить дозу или на несколько дней прекратить прием препарата.
Во время лечения имейте в виду, что алкоголь может усиливать побочные эффекты от приема нейромидина.
условий хранения
Нейромидин все лекарственные формы, отпускаемые по рецепту. Срок годности раствора для внутривенного введения — 2 года, таблеток Нейромидина — 3 года.
Как пользоваться ручкой Victoza?
Ключевые моменты
- Ручка Victoza (лираглутид) — это инъекционное лекарство, используемое в дополнение к диете и упражнениям для лечения диабета 2 типа. Он вводится в виде подкожной (подкожной) инъекции один раз в день, в любое время дня, с едой или без нее. Посмотреть развернутые направления можно здесь.
- Ручка Victoza предварительно заполнена лекарством. Вы набираете на ручке дозу, которую прописывает врач, прежде чем вводить ее.Вы каждый раз сами вставляете новую иглу.
- Общее количество доз в вашей ручке Victoza будет зависеть от вашей дозы. Ручка Victoza содержит в общей сложности 18 мг Victoza и обеспечивает дозировку 0,6 мг, 1,2 мг или 1,8 мг на инъекцию. Ваш врач назначит вам необходимую дозу.
- Перед первым использованием убедитесь, что ваш врач, медсестра или фармацевт покажут вам, как правильно пользоваться ручкой. Прочтите инструкции, прилагаемые к ручке, каждый раз, когда вы получаете новую дозу в случае каких-либо изменений.
Как мне вводить Виктозу?
Ниже приводится сокращенное краткое руководство по использованию пера. Вам следует читать полную инструкцию производителя по использованию каждый раз, когда вы получаете ручку. Если у вас есть дополнительные вопросы, обратитесь к врачу, медсестре или фармацевту.
- Попросите вашего лечащего врача показать вам, как пользоваться ручкой в первый раз или до тех пор, пока вы не почувствуете себя комфортно с ней. Просматривайте полные инструкции каждый раз в случае каких-либо изменений.
- Перед каждым использованием мойте руки водой с мылом.
- Подготовьте ручку (см.
 Дальнейшие инструкции). Проверьте ручку, чтобы убедиться, что жидкое лекарство прозрачное, бесцветное и не содержит частиц. Если нет, не используйте его.
Дальнейшие инструкции). Проверьте ручку, чтобы убедиться, что жидкое лекарство прозрачное, бесцветное и не содержит частиц. Если нет, не используйте его. - Протрите резиновую пробку спиртовым тампоном.
- Присоедините иглу. Ручку Victoza следует использовать с одноразовыми иглами Novo Nordisk. Всегда используйте новую иглу для каждой инъекции и меняйте места инъекции.
- Наберите ручкой дозу, которую вам прописал врач.
- Введите иглу в кожу в области живота (живота), бедра или плеча. Не вводите Victoza в мышцу (внутримышечно) или в вену (внутривенно).
- Нажмите на центр кнопки дозирования, чтобы ввести дозу, пока «0 мг» не совпадет с указателем. Удерживая кнопку дозирования нажатой, убедитесь, что вы держите иглу под кожей в течение 6 секунд, чтобы убедиться, что введена полная доза. Удерживайте большой палец на кнопке инъекции, пока не удалите иглу с кожи.
- Извлечение иглы из места инъекции. Если кровь появилась после того, как вы вытащили иглу из кожи, слегка надавите, но не трите пораженный участок.
- Выньте иглу из пера и выбросьте ее в контейнер для острых предметов, одобренный FDA. Не выбрасывайте незакрепленные иглы и ручки в бытовой мусор.
- Храните ручку без иглы .
Для подготовки ручки
каждый раз, когда вы получаете новую ручку
- Символы проверки потока: при первом использовании каждой новой ручки обязательно набирайте символ проверки потока, который выглядит как две черточки.Вам нужно делать это только один раз с каждой новой ручкой. Поворачивайте переключатель дозы до тех пор, пока символ контроля потока (-) не совместится с указателем.
- Возьмите ручку иглой вверх. Осторожно постучите по картриджу пальцем несколько раз, чтобы пузырьки воздуха поднялись вверх. Удерживая стрелку вверх, нажимайте кнопку дозирования до тех пор, пока «0 мг» не совпадет с указателем.
- Повторите шаги 1 и 2 (до 6 раз, если необходимо), пока на кончике иглы не появится капля Victoza.
- Если вы все еще не видите капли Victoza, используйте новую ручку и свяжитесь с Novo Nordisk по телефону 1-877-484-2869.
Могу ли я использовать Виктозу с инсулином?
Да, по назначению врача вы можете делать инъекции Виктозы и инсулина в одну и ту же область тела (например, в область живота), но не в непосредственной близости друг от друга. Однако НЕ смешивайте инсулин и виктозу в одной инъекции.
Что мне делать, если я пропустил инъекцию Виктозы?
Если вы пропустите дозу Victoza, примите пропущенную дозу в следующей запланированной дозе.Не принимайте 2 дозы Виктозы одновременно.
Другая информация
Не используйте ручку или иглы вместе с другими людьми из-за риска заражения.
Храните ручку в холодильнике при температуре от 36ºF до 46ºF (от 2ºC до 8ºC) до первого использования , затем вы можете хранить ее в холодильнике или при комнатной температуре от 59 до 86 ° F (15 От ° C до 30 ° C) на срок до 30 дней. Вы можете использовать ручку Victoza в течение 30 дней после использования.
Если у вас есть дополнительные вопросы о ручке Victoza, позвоните своему врачу, медсестре или фармацевту.Вы также можете связаться с Novo Nordisk, если у вас возникнут дополнительные вопросы о ручке Victoza. Вы можете позвонить сертифицированному инструктору по диабету по телефону 1-877-905-1126 с понедельника по пятницу с 8:30 до 18:00 по восточному времени.
Эти инструкции не заменяют разговоры с вашим лечащим врачом о вашем состоянии здоровья или вашем лечении.
Итог
- Victoza — это предварительно заполненные шприцы для инъекций, которые используются в дополнение к диете и упражнениям для лечения диабета 2 типа у пациентов в возрасте 10 лет и старше.Он также одобрен для снижения риска серьезных сердечно-сосудистых событий (таких как сердечный приступ, инсульт или смерть) у взрослых с диабетом 2 типа и сердечными заболеваниями.
- Чтобы сделать инъекцию Victoza, необходимо выполнить несколько шагов. Убедитесь, что ваш врач, медсестра или фармацевт покажут вам, как пользоваться ручкой Victoza перед первой инъекцией.
- Иллюстрированные инструкции производителя находятся в каждой упаковке Victoza. Вы можете следовать этим иллюстрированным инструкциям, чтобы просмотреть шаги, необходимые для введения Victoza.Если у вас все еще есть вопросы, позвоните своему врачу.
Это еще не вся информация о Victoza, которую необходимо знать для безопасного и эффективного использования. Ознакомьтесь с полной информацией о Victoza здесь и обсудите эту информацию со своим врачом или другим поставщиком медицинских услуг.
Триамцинолон гексацетонид для инъекций: использование, побочные эффекты, взаимодействия, изображения, предупреждения и дозировка
Могут возникнуть покраснение или боль в месте инъекции, расстройство желудка, головная боль, головокружение, проблемы со сном или увеличение веса.Если какой-либо из этих эффектов сохраняется или ухудшается, немедленно сообщите об этом своему врачу или фармацевту.
Помните, что ваш врач прописал это лекарство, потому что он или она посчитали, что польза для вас больше, чем риск побочных эффектов. Многие люди, принимающие это лекарство, не имеют серьезных побочных эффектов.
Это лекарство может повысить ваше кровяное давление. Регулярно проверяйте свое кровяное давление и сообщайте врачу, если результаты будут высокими.
Это лекарство может повысить уровень сахара в крови, что может вызвать или усугубить диабет.Немедленно сообщите своему врачу, если у вас есть симптомы высокого уровня сахара в крови, такие как повышенная жажда / мочеиспускание. Если у вас уже есть диабет, регулярно проверяйте уровень сахара в крови в соответствии с указаниями и сообщайте о результатах своему врачу. Вашему врачу может потребоваться скорректировать лекарства от диабета, программу упражнений или диету.
Это лекарство может снизить вашу способность бороться с инфекциями. Это может повысить вероятность серьезной (редко смертельной) инфекции или усугубить любую инфекцию. Немедленно сообщите своему врачу, если у вас есть какие-либо признаки инфекции (например, не проходящая боль в горле, лихорадка, озноб, кашель).
Немедленно сообщите своему врачу, если у вас есть какие-либо серьезные побочные эффекты, в том числе: слабость, отечность лица, необычное увеличение веса, истончение кожи, боль в костях, изменения менструального цикла, психические изменения / изменения настроения (например, депрессия, перепады настроения, возбуждение). , легкие синяки / кровотечения, проблемы со зрением, отек лодыжек / ступней / рук, быстрое / медленное / нерегулярное сердцебиение.
Если вы получили инъекцию этого лекарства в сустав, может возникнуть временный дискомфорт в суставе. Немедленно сообщите своему врачу, если у вас жар, усиление / сильная боль с отеком сустава, слабость в суставе или уменьшение диапазона движений в суставе.
Немедленно обратитесь за медицинской помощью, если у вас есть какие-либо очень серьезные побочные эффекты, в том числе: симптомы желудочного / кишечного кровотечения (например, боль в животе / животе, черный / дегтеобразный стул, рвота, похожая на кофейную гущу).
Очень серьезные аллергические реакции на этот препарат возникают редко. Однако немедленно обратитесь за медицинской помощью, если вы заметили какие-либо симптомы серьезной аллергической реакции, в том числе: сыпь, зуд / отек (особенно лица / языка / горла), сильное головокружение, затрудненное дыхание.
Это не полный список возможных побочных эффектов. Если вы заметили другие эффекты, не указанные выше, обратитесь к врачу или фармацевту.
В США —
Обратитесь к врачу за медицинской консультацией по поводу побочных эффектов. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088 или на сайте www.fda.gov/medwatch.
В Канаде — Обратитесь к врачу за медицинской консультацией по поводу побочных эффектов. Вы можете сообщить о побочных эффектах в Министерство здравоохранения Канады по телефону 1-866-234-2345.
Анорексигенный пептид нейромедин U (NMU) ослабляет индуцированную амфетамином двигательную стимуляцию, высвобождение дофамина в акумбальной области и проявление обусловленного предпочтения места у мышей
Abstract
Амфетаминовая зависимость, помимо значительных экономических последствий, является серьезной причиной смертности и заболеваемости.Путем исследований нейрохимических коррелятов, с помощью которых наркотики, вызывающие привыкание, такие как амфетамин, активируют мезоаккумбальную дофаминовую систему, можно определить уникальные мишени для лечения наркозависимости. Эта связь с вознаграждением состоит из проекции дофамина из вентральной тегментальной области на прилежащее ядро (NAc), предполагая, что эти области мозга важны для вознаграждения. Физиологическая функция пептидов кишечника и головного мозга вышла за рамки модуляции приема пищи и включает регулирование усиления лекарственного средства.Новым кандидатом на регулирование вознаграждения является анорексигенный пептид нейромедин U (NMU). Поэтому мы исследовали влияние интрацеребровентрикулярного (icv) введения NMU на хорошо документированные эффекты амфетамина на мезоаккумбальную дофаминовую систему, –. и . двигательная стимуляция и высвобождение дофамина в прилежащей области у мышей. Кроме того, исследовали влияние введения NMU в прилежащую область на двигательную активность. Было выяснено влияние NMU, icv или intra-NAc на выражение условного предпочтения места (CPP).Во-первых, мы показали, что внутривенное введение NMU ослабляет индуцированную амфетамином локомоторную стимуляцию, высвобождение дофамина в прилежащей области и экспрессию CPP у мышей. Во-вторых, мы обнаружили, что более низкая доза NMU (icv) снижает индуцированную амфетамином двигательную стимуляцию у мышей. В-третьих, мы продемонстрировали, что введение NMU в NAc блокирует способность амфетамина вызывать двигательную стимуляцию у мышей. Однако прилежащее введение NMU не ослабляло индуцированную амфетамином экспрессию СРР у мышей.Наши новые данные предполагают, что центральная передача сигналов NMU участвует в развитии амфетаминовой зависимости.
Образец цитирования: Валлёф Д., Вестлунд Дж., Энгель Дж. А., Джерлхаг Э. (2016) Анорексигенный пептид нейромедин U (NMU) ослабляет индуцированную амфетамином двигательную стимуляцию, высвобождение акумбального дофамина и выражение условного предпочтения места у мышей. PLoS ONE 11 (5):
e0154477.
https://doi.org/10.1371/journal.pone.0154477
Редактор: Джеймс Эдгар Маккатчеон, Университет Лестера, ВЕЛИКОБРИТАНИЯ
Поступила: 27 ноября 2015 г .; Одобрена: 14 апреля 2016 г .; Опубликовано: 3 мая 2016 г.
Авторские права: © 2016 Vallöf et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе.
Финансирование: Исследование поддержано грантами Шведского исследовательского совета (2009-2782 и 2011-4646 и 2015-03219), Шведского общества медицинских исследований, Шведского фонда мозга, LUA / ALF (грант No.148251) из университетской больницы Сальгренска, Торстен Содерберг, Совет по исследованию алкоголя шведской монополии на розничную продажу алкоголя и фонды Адлербертска, Фредрик и Ингрид Тюринг, Торе Нильссон, Ленгманска, Вильгельм и Мартина Лундгрен, Кнут и Алиса Валленберг, Аннус Бергрс , Jeansons, Оке Виберг, NovoNordisk, Гетеборгский фонд психиатрических исследований, Шведское медицинское общество. Источники финансирования не играли никакой роли в сборе, анализе и интерпретации данных, в написании отчета или в принятии решения о представлении статьи для публикации.
Конкурирующие интересы: EJ получила финансовую поддержку от NovoNordisk Foundation. Однако это не меняет приверженности авторов какой-либо политике журналов по обмену данными и материалами. Остальные авторы заявляют об отсутствии конфликта интересов.
Введение
Зависимость от амфетамина, частая причина смертности и заболеваемости, является серьезной платой как для общества, так и для человека [1, 2]. Однако эффективные фармакологические вмешательства для лечения амфетаминовой зависимости в настоящее время ограничены.Развитие лекарственной зависимости, в том числе амфетамина, объясняется способностью вызывающих привыкание наркотиков влиять на мезоаккумбальную дофаминовую систему, состоящую из дофаминергических нейронов вентральной тегментальной области (VTA) среднего мозга, выступающих в прилежащее ядро (NAc) (см. Обзор [3]). , 4]). Благодаря исследованиям нейрохимических механизмов, участвующих в этой активации, можно разработать оригинальные варианты лечения лекарственной зависимости. В последние годы была выявлена ключевая роль регуляторных пептидов аппетита, таких как грелин и глюкагоноподобный пептид 1 (GLP-1), в развитии лекарственного усиления (для обзора [5]).Учитывая, что регуляция аппетита сложна и включает в себя множество пептидов, следует учитывать возможность того, что другие пептиды кишечника и мозга, такие как нейромедин U (NMU), могут модулировать вознаграждение.
Высококонсервативный нейропептид NMU обнаруживается в желудочно-кишечном тракте, а также в головном мозге. В кишечнике крыс иммунореактивность, подобная NMU, была продемонстрирована в телах нервных клеток, а также в волокнах подслизистых и миэнтерических сплетений, в отличие от эндокринных клеток (см. Обзор [6]).NMU действует через два разных рецептора, а именно NMUR1 и NMUR2 [7]. NMUR1 экспрессируется в большом количестве периферических тканей, включая легкие и кишечник (см. Обзор [6]), а также в миндалевидном теле [8]. NMUR2 преимущественно экспрессируются в областях мозга [8], хотя была идентифицирована экспрессия в периферических тканях, таких как легкие и яичники [9]. Разнообразная физиологическая роль периферических NMU посредством активации преимущественно NMUR1 включает ноцицепцию, стимуляцию гладких мышц, стрессовые реакции и регуляцию температуры тела (для обзора [10]).Однако, в соответствии с высокой экспрессией NMUR2 вдоль оси кишечник-мозг, исследования показали, что NMU служит катаболическим сигналом через центральный механизм. Действительно, центральное введение NMU снижается, тогда как антисмысловое введение NMU увеличивает потребление пищи крысами [11-15]. Анорексигенные свойства NMU дополнительно усиливаются открытием, что мыши с избыточной экспрессией NMU являются гипофагическими [16], тогда как мыши с нокаутом NMUR2 демонстрируют повышенное потребление диеты с высоким содержанием жиров по сравнению с мышами дикого типа [17]. Анорексигенные свойства NMU опосредуются через NMUR2, расположенный в ключевых областях, регулирующих энергетический баланс, таких как дугообразное ядро и паравентрикулярное ядро [13, 14, 18].Данные, показывающие, что мыши с нокаутом NMU демонстрируют повышенную массу тела, а также ожирение [19] и что мыши с избыточной экспрессией NMU худые [16], подтверждают роль NMU в регуляции массы тела. Кроме того, субхроническое центральное введение NMU снижает массу тела и общее потребление энергии у мышей с ожирением, вызванным диетой [11, 12]. Несмотря на то, что NMUR2 выражается в областях, связанных с вознаграждением, таких как NAc [8], волокна иммунореактивности NMU обнаруживаются в NAc и VTA [20, 21] и что крысы с нокдауном NMUR2 демонстрируют потребление пищи типа переедания, а также повышенное предпочтение более жирной пище [17], роль NMU в стимулировании приема лекарств не оценивалась.Поэтому мы исследуем возможность того, что NMU (icv) может служить регулятором вызванной амфетамином активации мезоаккумбальной дофаминовой системы, что измеряется по двигательной стимуляции и высвобождению дофамина в прилежащей области. Принимая во внимание тот факт, что амфетамин, по крайней мере частично, индуцирует вознаграждение путем изменения обратного захвата дофамина в NAc, дополнительный предмет для настоящего исследования было изучение влияния интра-NAC инфузии НММ на способность амфетамина, чтобы вызвать локомоторно стимуляция. Кроме того, мы дополнительно исследовали влияние NMU, icv или intra-NAc на выражение условного предпочтения места (CPP), меры контекстных сигналов, связанных с вознаграждением, связанных с опытом приема наркотиков и, следовательно, важны для приобретения, а также для поддержания поведение, связанное с употреблением наркотиков.
Материалы и методы
Животные
Использовали взрослых постпубертатных мышей-самцов NMRI (возраст 8-12 недель, масса тела 25-40 г; Charles River, Susfeldt, Германия). Мышам давали возможность акклиматизироваться по крайней мере за одну неделю до начала эксперимента, их помещали в группы и поддерживали при 12/12 часовом цикле свет / темнота, температуре 20 ° C и влажности 50%. Водопроводная вода и еда (обычная еда; Харлан Теклад, Норфолк, Англия) поставлялись ad libitum .Шведский этический комитет по исследованиям на животных в Гетеборге одобрил эксперименты, и были предприняты все усилия, чтобы минимизировать страдания животных, а также сократить количество используемых животных. В каждом эксперименте использовалась независимая группа мышей
.
Наркотики
Для исследований, изучающих активацию мезоаккумбальной дофаминовой системы, вызванную амфетамином, у мышей, сульфат дек-амфетамина (RBI, Натик, США) растворяли в носителе (0,9% раствор хлорида натрия) и вводили внутрибрюшинно (ip) в дозе 2 мг / кг за 10 минут до начала экспериментов.NMU (Bionuclear, Bromma, Швеция) разводили в растворе Рингера (NaCl 140 мМ, Ca Cl 2 1,2 мМ, KCl 3,0 мМ и MgCl 2 1,0 мМ; Merck KGaA, Дармштадт, Германия). Была выбрана доза 1 мкг на 1 мкл для интрацеребровентрикулярного (icv) введения, поскольку ранее было обнаружено, что эта доза снижает потребление пищи мышами [12–14], а недавно было показано, что она ослабляет опосредованное алкоголем поведение у грызунов [22]. Наши недавние данные показали, что центральное введение выбранной дозы NMU (1 мкг, icv) не имело эффекта per se на двигательную активность, высвобождение дофамина в прилежащей области и экспрессию CPP у мышей [22].Кроме того, мы использовали более низкую дозу NMU (0,3 мкг в 1 мкл, icv), которая, как было показано, снижает потребление алкоголя крысами [22]. Для местного и двустороннего введения в NAc было проведено исследование восстановления дозы. Была выбрана доза 62,5 нг в 0,5 мкл (на сторону), поскольку эта доза не оказывала эффекта per se на двигательную активность или экспрессию CPP у мышей.
Имплантация направляющей канюли
Для введения НМУ или направляющих канюль раствора транспортного средства (нержавеющая сталь, длина 10 мм, с o.сделал. 0,6 / 0,45 мм) имплантировали за четыре дня до экспериментов. Операция была проведена следующим образом: грызуна анестезировали изофлураном (Isofluran Baxter; Univentor 400 Anesthesia Unit, Univentor Ldt., Zejtun, Мальта), помещали в стереотаксический аппарат (David Kopf Instruments; Tujunga, CA, USA) и держали. грелка для предотвращения переохлаждения. Для местной анестезии использовали две капли ксилокаина адреналина (5 мкг / мл; Pfizer Inic; Нью-Йорк, США). Кость черепа была обнажена после разреза, и были просверлены три отверстия: два для направляющей канюли и одно для фиксирующего винта.Координаты третьего желудочка (для внутривенного введения) относительно брегмы составляли AP -0,9 мм и ML ± 0,0. Координаты для NAc: AP +1,4 мм и ML ± 0,6. Направляющие канюли были помещены на 1 мм ниже поверхности мозга, а затем они были закреплены на винте и кости черепа с помощью стоматологического цемента (DENTALON ® plus; Agntho’s AB, Lidingö, Швеция). После операции мышам вводили карпрофен (Rimadyl ® ) (Astra Zeneca; Гетеборг, Швеция) в дозе 5 мг / кг подкожно (п / к) для облегчения боли и содержали в индивидуальных клетках (Macrolon III).Во время эксперимента канюля была выдвинута еще на 1,1 мм или 3,6 мм вентрально за конец направляющей канюли для введения лекарственного средства в третий желудочек и NAc соответственно. За час до начала эксперимента фиктивную канюлю осторожно вставляли и возвращали в направляющую канюлю для удаления свернувшейся крови и предотвращения распространения депрессии. Препарат вводили более одной минуты; канюлю оставляли на месте еще на минуту, а затем ее втягивали (5 мкл Kloehn, микрошприц; Skandinaviska Genetec AB, V.Фрелунда, Швеция). После этого места инъекций были проверены, и в статистический анализ были включены только мыши с правильным размещением.
Эксперименты по двигательной активности
Двигательную активность выполняли, как описано ранее [23]. Двигательную активность регистрировали в восьми звукопоглощающих, вентилируемых и тускло освещенных локомоторных боксах (420 x 420 x 200 мм). В трех тестах пять на пять рядов лучей фотоэлементов (Kungsbacka mät-och reglerteknik AB, Fjärås, Швеция) позволили компьютерной системе регистрировать активность мышей с помощью детектирования фотоэлементов.В этих экспериментах двигательная активность определялась как накопленное количество новых лучей фотоэлементов, прерванных за 5 минут. Вторую систему двигательной активности (Open Field Activity System; Med Associates Inc, Gerogia, Vermont, USA) использовали при исследовании влияния центрального (icv) введения низкой дозы (0,3 мкг) NMU на индуцированную амфетамином двигательную стимуляцию. В этой системе 15 x 15 инфракрасных лучей позволяли компьютерной системе регистрировать пройденное расстояние (см за 5 минут) каждой мышью.В каждом эксперименте мышам позволяли привыкнуть к блоку двигательной активности за час до введения лекарственного средства. NMU всегда вводили за 20 минут до амфетамина, а регистрация активности начиналась через десять минут после последней инъекции. Двигательная активность регистрировалась еще 60 минут.
В первом эксперименте исследовали влияние NMU (1 мкг, icv) на индуцированную амфетамином (2 мг / кг, ip) локомоторную стимуляцию. Каждая мышь получала одну комбинацию лечения (носитель-носитель, носитель-амфетамин, NMU-носитель или NMU-амфетамин) и подвергалась только одному экспериментальному испытанию.
Во втором эксперименте изучали влияние NMU (0,3 мкг, icv) на индуцированную амфетамином (2 мг / кг, ip) локомоторную стимуляцию. Каждая мышь получала одну комбинацию лечения (носитель-носитель, носитель-амфетамин, NMU-носитель или NMU-амфетамин) и подвергалась только одному экспериментальному испытанию.
Третий эксперимент был проведен для определения дозы для внутримышечного введения NAc без какого-либо влияния на двигательную активность per se. Эффекты местного введения носителя или NMU (250, 125 или 62.5 нг в 0,5 мкл с каждой стороны) билатерально в NAc изучали на мышах.
В четвертом эксперименте на отдельных мышах была исследована роль прилежащего участка NMUR2 в стимулированном амфетамином вознаграждении. Таким образом, оценивали эффекты введения внутри NAc NMU (62,5 нг в 0,5 мкл) на локомоторную стимуляцию, индуцированную амфетамином (2 мг / кг, внутрибрюшинно). Каждая мышь получала одну комбинацию лечения (носитель-носитель, носитель-амфетамин, NMU-носитель или NMU-амфетамин) и подвергалась только одному экспериментальному испытанию.
Микродиализ in vivo и измерения высвобождения дофамина
В настоящем эксперименте исследуется роль центрального NMU в индуцированной амфетамином активации мезоаккумбальной дофаминовой системы. Для измерения внеклеточного уровня дофамина мышам имплантировали зонд для микродиализа, расположенный в оболочке NAc. Операции выполнялись, как описано ранее [23] и выше (имплантация направляющей канюли). У этих мышей были просверлены три отверстия: одно для зонда, одно для направляющей канюли и одно для крепежного винта.Зонды были изготовлены на заказ, как описано ранее [24], и случайным образом чередовались либо с левой, либо с правой стороны мозга. Координаты зондов: 1,4 мм AP, ± 0,6 ML и 4,7 DV мм [25].
Эффект центрального введения NMU (1 мкг, icv) на индуцированное амфетамином (2 мг / кг, внутрибрюшинно) высвобождение дофамина в прилежащей области исследовали с помощью микродиализа на свободно движущихся мышах. В день эксперимента зонд был подключен к микроперфузионному насосу (U-864 Syringe Pump; AgnThós AB) и перфузирован раствором Рингера со скоростью 1.5 мкл / мин. После одного часа привыкания к установке для микродиализа образцы перфузии собирали каждые 20 минут. Базовый уровень дофамина был определен как среднее значение первых трех последовательных проб (от -40 мин до 0 мин). После исходных образцов вводили NMU или носитель (0 минут). Амфетамин вводили через 20 минут (20 минут), создавая следующие группы лечения: носитель-амфетамин и NMU-амфетамин. После этого были собраны восемь последовательных 20-минутных проб.Вызванное контрольной пробой повышение уровня дофамина в прилежащей области рассчитывали как процент увеличения по сравнению с исходными образцами.
Дофамин был отделен и количественно определен с использованием двух различных аппаратов для высокоэффективной жидкостной хроматографии с электрохимическим детектированием, как описано ранее [26]. Вкратце, насос (UltiMate 3000 Pump; Thermo Scientific, Дармштадт, Германия), ионообменная колонка (Nucleosil SA, 2,0 x 150 мм, диаметр 5 мкм, размер пор 100 Å; Phenomenex Scandinavia, Västra Frölunda, Швеция) и Детектор (Decade, Kovalent AB, Швеция) работал при 400 мВ по сравнению с ячейкой.Подвижная фаза подавалась со скоростью 0,3 мл / мин и состоит из 58 мМ лимонной кислоты, 135 мМ NaOH, 0,107 мМ Na2-EDTA и 20% метанола. Вторая система состояла из насоса (UltiMate 3000 Pump; Thermo Scientific, Дармштадт, Германия), обращенно-фазовой колонки (2,0 x 50 мм, диаметр 3 мкм; размер пор 100 Å; Phenomenex Scandinavia, Västra Frölunda, Швеция) и детектора. (Dionex, Västra Frölunda, Швеция) работала при 220 мВ по сравнению с ячейкой. Подвижная фаза подавалась со скоростью 0,3 мл / мин и состоит из 150 мМ Nah3PO4,4.76 мМ лимонной кислоты, 3 мМ додецилсульфата натрия, 50 мкМ ЭДТА, а также 10% МеОН и 15% ацетонитрила.
Условное предпочтение места
Эксперименты CPP были разработаны для оценки эффектов NMU, icv или accumbal на экспрессию индуцированного амфетамином CPP. Тест CPP проводился на мышах, как описано ранее [23]. Вкратце, использовался двухкамерный аппарат для определения предпочтения места (45 люкс) и различные визуальные и тактильные сигналы. Процедура состояла из предварительного кондиционирования (день 1), кондиционирования (дни 2–5) и посткондиционирования (день 6).При предварительном кондиционировании мышей помещали в камеру со свободным доступом к обоим отсекам в течение 20 минут для определения исходного предпочтения места. Кондиционирование (20 минут на сеанс) выполняли с использованием предвзятой процедуры, в которой амфетамин (2 мг / кг, внутрибрюшинно) сочетался с наименее предпочтительным компартментом и носителем с предпочтительным компартментом. Все мыши получали одну инъекцию амфетамина и одну инъекцию носителя каждый день, и инъекции меняли между утром и днем в сбалансированной схеме.В первом эксперименте мышам вводили NMU (1 мкг, icv) или равный объем раствора носителя (Ringer) в день посткондиционирования. Через 20 минут мышей помещали на среднюю линию между двумя отсеками со свободным доступом к обоим отсекам на 20 минут (создавая следующие группы обработки: амфетамин-носитель и амфетамин-NMU). Во втором эксперименте мышам вводили NMU (62,5 нг) или равный объем раствора носителя (Ringer) с двух сторон в NAc в день посткондиционирования.Через 20 минут мышей помещали на среднюю линию между двумя отсеками со свободным доступом к обоим отсекам на 20 минут (создавая следующие группы обработки: амфетамин-носитель и амфетамин-NMU). CPP рассчитывали как разницу в процентах (%) от общего времени, проведенного в компартменте с лекарственным средством (т.е. менее предпочтительном) во время сеанса посткондиционирования и сеанса предварительного кондиционирования. Также был проведен контрольный эксперимент по введению NMU в оболочку NAc (62,5 нг в 0,5 мкл на сторону).Отдельную группу мышей подвергали той же процедуре, но получали инъекции носителя вместо амфетамина на протяжении всего периода кондиционирования (контрольная группа без кондиционирования амфетамином; создание следующих групп обработки; носитель-носитель и NMU-носитель).
Проверка установки зонда и направляющей канюли
После каждого эксперимента проверялось расположение зонда (расположенного в оболочке NAc) и / или направляющих канюль (расположенных в третьем желудочке (icv, рис. 1A) или в оболочке NAc (рис. 1B)).Грызунов обезглавливали, и мозг помещали на устройство для виброрезки (752 M Vibroslice; Campden Instruments Ltd., Лафборо, Великобритания). Мозг был разрезан на срезы размером 50 мкм, и их местоположение было определено [25] путем наблюдения с использованием световой микроскопии. В статистический анализ были включены только грызуны с правильным размещением зонда и / или направляющей канюли. Ни одно животное не было исключено из-за тяжелого заболевания. Единственный критерий исключения — неправильно установленные зонды / направляющие канюли.
Рис 1.Схематические изображения размещений.
(A) Венечный срез мозга мыши, показывающий пять репрезентативных размещений направляющих канюль (показано вертикальными линиями), направленных на третий желудочек (icv) [25]. Кроме того, на срезе мозга мыши показано одно репрезентативное размещение направляющей канюли в третьем желудочке (B). Венечный срез мозга мыши показывает шесть репрезентативных мест размещения зонда или направляющей канюли (показано вертикальными линиями) в прилежащем ядре (NAc) оболочки. [25]. Более того, срез мозга мыши показывает одно репрезентативное размещение в оболочке NAc.Для каждого среза мозга проиллюстрировано только несколько репрезентативных размещений, но все остальные размещения были нацелены на третий желудочек или находились в оболочке NAc. Размещение за пределами этих областей не было включено в статистический анализ. Число, указанное в разделе мозга, указывает миллиметры кпереди (+) или кзади (-) от брегмы.
https://doi.org/10.1371/journal.pone.0154477.g001
Статистический анализ
Эксперименты по двигательной активности, а также эксперименты с микродиализом оценивали с помощью двустороннего дисперсионного анализа с последующим апостериорным тестом Бонферрони для сравнения между различными видами лечения и, в частности, в заданные моменты времени.Данные CPP оценивали с помощью непарного t-критерия. Кроме того, влияние лечения на время, проведенное в компартменте с парными лекарствами, анализировали с помощью однофакторного дисперсионного анализа с последующим апостериорным тестом Бонферрони для сравнения между разными видами лечения. Данные представлены как среднее ± стандартная ошибка среднего. Значение вероятности P <0,05 считалось статистически значимым.
Результаты
Влияние внутривенного введения NMU на индуцированную амфетамином двигательную стимуляцию, высвобождение дофамина в прилежащей области и экспрессию CPP у мышей
Анализ исходной двигательной активности не показал общего основного эффекта от лечения (F ( 3,41 ) = 1.18, P = 0,3306), время (F ( 1,14 ) = 0,68, P = 0,4236) или лечение x время взаимодействия (F ( 3,42 ) = 0,13, P = 0,9427), что указывает на отсутствие различий в исходной активности для будущих групп лечения (носитель-наполнитель 508 ± 42; наполнитель-амфетамин 619 ± 70; NMU-наполнитель 563 ± 52; NMU-амфетамин 691 ± 40 импульсов на 60 минут).
Общий основной эффект лечения (F ( 3,252 ) = 64,97, P <0.0001), а также времени (F ( 11,84 ) = 2,02, P = 0,0358), но не лечения x взаимодействия времени (F ( 3,252 ) = 0,97, P = 0,5209). обнаружено на двигательную активность мышей после системного введения амфетамина (2 мг / кг) и центральной инъекции NMU (1 мкг, icv) (n = 8 для носителя-носителя, n = 8 для носителя-амфетамина, n = 8 для NMU -автомобиль, а также НМУ-амфетамин). Как показано на рис. 2A, ретроспективный анализ показал, что амфетамин значительно увеличивал двигательную активность по сравнению с носителем при 10–15 ( P <0.01), 20–30 ( P <0,001), а также 35 ( P <0,01) минутных временных точек. Эта индуцированная амфетамином локомоторная стимуляция была значительно блокирована предварительной обработкой с помощью icv инъекции NMU в 15 ( P <0,05), 20 ( P <0,01), 25 ( P <0,001), а также 30– 35 ( P <0,01) минутных временных точек. Не было различий в ответе двигательной активности у мышей, получавших носитель, и мышей, получавших NMU-амфетамин, в любой момент времени ( P > 0.05). Выбранная доза NMU не оказывала эффекта per se на двигательную активность по сравнению с лечением носителем в любой момент времени ( P > 0,05).
Рис. 2. Центральное (1 мкг, icv) введение NMU ослабляет вызванную амфетамином локомоторную стимуляцию, высвобождение дофамина в прилежащей области и выражение условного предпочтения места у мышей.
(A) Локомоторная стимуляция, вызванная амфетамином (2 мг / кг, внутрибрюшинно), блокировалась центральной инъекцией NMU (1 мкг, icv) в момент времени 15–35 минут.Центральное введение NMU не оказало влияния на локомоторную активность per se per se. (B) НМУ (1 мкг, icv) аттенуированный амфетамин (2 мг / кг, внутрибрюшинно) индуцировал увеличение высвобождения дофамина в прилежащей области в момент времени 40–80 минут. (C) Центральное введение NMU (1 мкг, icv, Amph-NMU) предотвращало индуцированное амфетамином (2 мг / кг, Amph-Veh) выражение условного предпочтения места (CPP). Данные представлены как среднее значение ± SEM (* P <0,05, ** P <0,01, *** P <0,001 для Veh-Veh по сравнению с Veh-Amph и # P <0,05, ## P <0.01, ### P <0,001 для Veh-Amph по сравнению с NMU-Amph).
https://doi.org/10.1371/journal.pone.0154477.g002
Измерения дофамина с помощью накопительного микродиализа у мышей выявили общий основной эффект лечения (F ( 1,117 ) = 23,47, P <0,0001), время ( F ( 12,117 ) = 5,415, P <0,0001) и лечение x время взаимодействия (F ( 12,117 ) = 2,209, P <0,0154) (рис. 2B). Апостериорный анализ показал, что введение icv NMU (NMU-амфетамин, n = 10) значительно ослабляет способность амфетамина (носитель-амфетамин, n = 10) увеличивать накопленный дофамин в момент времени 40 (P <0.05), 60 (P <0,001) и 80 минут (P <0,01).
Амфетамин-индуцированный (2 мг / кг) (амфетамин-носитель, n = 8) CPP был значительно ослаблен острым внутривенным введением NMU (1 мкг, icv) (амфетамин-NMU, n = 7) после день кондиционирования ( P = 0,0361) (рис. 2C). Однофакторный анализ ANOVA показал, что имелся общий эффект лечения на время (в секундах), проведенное в камере с парными лекарственными средствами во время до и после кондиционирования (F ( 3,26 ) = 4,096, P = 0,0166). Апостериорный тест Бонферрони показал, что не было никакой разницы во времени, проведенном в наименее предпочтительном отсеке при предварительном кондиционировании (носитель 503 ± 28 с, NMU 523 ± 28 с, P> 0.05). Время, проведенное в компартменте с лекарственным средством, было выше у мышей, обработанных носителем (680 ± 60 с), по сравнению с мышами, обработанными NMU (343 ± 122 с), во время посткондиционирования (P <0,05).
Анализ исходной двигательной активности не показал общего основного эффекта лечения (F ( 3,42 ) = 1,51, P = 0,2250), времени (F ( 1,14 ) = 2,52, P = 0,1347) или лечение x время взаимодействия (F ( 3,42 ) = 0,3985, P = 0,7548), что указывает на отсутствие различий в исходной активности для будущих групп лечения (носитель-носитель 469 ± 122 ; наполнитель-амфетамин 590 ± 141; NMU-наполнитель 490 ± 123; NMU-амфетамин 735 ± 110 см за 60 минут).
Общий основной эффект лечения (F ( 3,252 ) = 201,3, P <0,0001), но не времени (F ( 11,84 ) = 0,72, P = 0,7187) или лечения x Взаимодействие по времени (F ( 33,252 ) = 0,53, P = 0,9856) было обнаружено на двигательную активность мышей после системного введения амфетамина (2 мг / кг) и внутривенной инъекции низкой дозы NMU (0,3 мкг) ( n = 8 для носителя-носителя, n = 8 для носителя-амфетамина, n = 8 для NMU-носителя и n = 8 для NMU-амфетамина).Как показано на рис. 3, ретроспективный анализ показал, что амфетамин значительно увеличивал двигательную активность по сравнению с носителем в возрасте 5–50 ( P <0,0001), 55 ( P <0,001), а также 60 ( P <0,01). ) минутные моменты времени. Кроме того, мыши, получавшие NMU-амфетамин, показали увеличение двигательной активности по сравнению с мышами, получавшими носитель, у 10 ( P <0,05), 15-25 ( P <0,01), 30 ( P <0,0001), 35 –40 ( P <0,001), 45 ( P <0.01), а также 50 ( P <0,05) минутных временных точек. Однако мыши, получавшие NMU-амфетамин, не показали значимого ответа ( P > 0,05) на амфетамин в 5, а также в 50-60-минутные моменты времени. Действительно, реакция на амфетамин ниже у мышей, получавших NMU-амфетамин, по сравнению с мышами, получавшими амфетамин-носитель. NMU (0,3 мкг, icv) не влиял per se на двигательную активность ( P > 0,05) по сравнению с лечением носителем в любой момент времени. В совокупности эти данные показывают, что низкая доза NMU снижает локомоторную стимуляцию, вызванную амфетамином, но не блокирует эффект.
Рис. 3. Центральное (0,3 мкг, icv) введение NMU снижает индуцированную амфетамином двигательную стимуляцию у мышей.
Индуцированная амфетамином (2 мг / кг, в / б) локомоторная стимуляция была уменьшена, но не заблокирована центральной инъекцией более низких доз NMU (0,3 мкг, icv). Центральное введение этой более низкой дозы NMU не имело эффекта per se на двигательную активность. Данные представлены как среднее значение ± стандартная ошибка среднего (n.s. P> 0,05, * P <0,05, ** P <0,01, *** P <0,001, **** P <0,0001 по сравнению с обработкой носитель-носитель).
https://doi.org/10.1371/journal.pone.0154477.g003
Данные о двигательной активности на рис. 2А показаны в счетах за 5 минут. Эксперимент с активностью, показанный на рис. 3, был проанализирован с помощью новой системы, и поэтому данные представлены в виде количества путешественников за 5 минут. Хотя и были использованы две различные системы, надежный амфетамина индуцированных стимуляции опорно-двигательного аппарата был получен в обоих экспериментах.
Эффектов accumbal введения НМА на амфетамин-индуцированный локомоторные стимуляции и на экспрессии амфетамина-индуцированной СРР у мышей
Анализ исходной двигательной активности не показал общего основного эффекта от лечения (F ( 3,42 ) = 1.63, P = 0,1966), время (F ( 1,14 ) = 1,26, P = 0,2807) или лечение x время взаимодействия (F ( 3,42 ) = 0,11, P = 0,9913), что показывает отсутствие различий в исходной активности у мышей, позже получавших различные дозы NMU или носителя локально в NAc (носитель-носитель 142 ± 42; наполнитель-амфетамин 130 ± 33; NMU-носитель 90 ± 36; NMU-амфетамин 163 ± 30 отсчетов за 60 минут).
Был достигнут общий эффект от лечения (F ( 3,252 ) = 15.18, P <0,0001), времени (F ( 11,84 ) = 5,55, P <0,0001) и лечения x время взаимодействия (F ( 3,252 ) = 2,45, P <0,0001 ) после двустороннего введения NMU (250, 125 или 62,5 нг в 0,5 мкл на сторону) или носителя в оболочку NAc. Апостериорный тест показал, что 250 нг NMU на каждую сторону снижает двигательную активность в 5 ( P <0,001), 10 и 20 ( P <0,05) минут по сравнению с носителем. Кроме того, 125 (P <0.01) нг NMU снижали двигательную активность по сравнению с обработкой носителем в 5-минутный момент времени ( P <0,001). NMU в дозе 62,5 нг на сторону не оказал эффекта per se на двигательную активность мышей по сравнению с лечением носителем в любой момент времени ( P > 0,05) (носитель 191 ± 46 n = 8; NMU250 43 ± 20 n = 8; NMU125 23 ± 17 n = 8; NMU62.5 137 ± 23 n = 8 отсчетов за 60 минут).
Анализ исходной двигательной активности не показал общего основного эффекта от лечения (F ( 3,66 ) = 0.55, P = 0,6521), время (F ( 1,22 ) = 1,77, P = 0,1976) или лечение x время взаимодействия (F ( 3,66 ) = 0,08, P = 0,9714), что указывает на отсутствие различий в исходной активности для будущих групп лечения (наполнитель-наполнитель 180 ± 22; наполнитель-амфетамин 130 ± 20; NMU-наполнитель 147 ± 25; NMU-амфетамин 151 ± 23 импульса на 60 единиц. минут).
Общий основной эффект лечения (F ( 3,396 ) = 36,70, P <0.0001), но не время (Р ( 11132 ) = 1,14, Р = 0,3387), или лечения времени х взаимодействий (Р ( 33396 ) = 0,28, Р = 0,9999) был найден на опорно-двигательном аппарате активность у мышей после системного введения амфетамина (2 мг / кг) и внутри-NAc инъекции NMU (62,5 нг / сторону) (n = 12 для носителя-носителя, n = 12 для носителя-амфетамина, n = 12 для NMU- носитель и n = 12 для NMU-амфетамина). Как показано на фиг.4А, апостериорный анализ показал, что амфетамин значительно увеличивал двигательную активность по сравнению с носителем при 25 ( P <0.01) минутный момент времени. Не было разницы в ответе двигательной активности у мышей, получавших носитель, и мышей, получавших NMU-амфетамин, в любой момент времени ( P > 0,05). NMU в NAc не влиял per se на двигательную активность ( P > 0,05) по сравнению с лечением носителем в любой момент времени.
Рис. 4. Аккумбальное введение NMU ослабляет вызванную амфетамином локомоторную стимуляцию, но не влияет на выражение условного предпочтения места у мышей.
(A) Индуцированная амфетамином (2 мг / кг, внутрибрюшинная) стимуляция локомоторной стимуляции ослаблялась инъекцией NMU (62,5 нг с каждой стороны) в прилежащую область. Введение Accumbal NMU не оказало эффекта per se на двигательную активность. (B) Введение Accumbal NMU (62,5 нг на сторону, Amph-NMU) не ослабляло индуцированную амфетамином (2 мг / кг, внутрибрюшинно, Amph-Veh) экспрессию CPP у мышей. Данные представлены как среднее значение ± стандартная ошибка среднего (n.s. P> 0,05, * P <0,05).
https://doi.org/10.1371/journal.pone.0154477.g004
Мыши, получавшие двустороннее введение носителя в NAc (фиг. 4A), по сравнению с третьим желудочком (фиг. 2A и 3), показали более низкую двигательную активность, а также реакцию на амфетамин. Это можно объяснить тем, что двустороннее введение влияет на поведение больше, чем в / в инъекции. Однако это не мешает интерпретации данных, так как контрольные носители обрабатываются аналогично мышам с лекарственными препаратами. Исследование реакции на дозу NMU было проведено на мышах, получавших icv, но не внутри NAc.Это объясняется тем, что реакция амфетамина ниже у мышей, получавших интра-NAc носитель, и поэтому было бы труднее дифференцировать ответ амфетамина, полученный NMU, по еще более низкой дозе NMU, расположенной между носителем-амфетамином и носителем-носителем. обработанных мышей (фиг. 4A).
На индуцированную амфетамином (2 мг / кг) (амфетамин-носитель, n = 11) экспрессию CPP не влияло внутри-NAc введение NMU (62,5 нг / сторону) (амфетамин-NMU, n = 14) на день после кондиционирования ( P = 0.5989) (рис. 4В). Отдельный эксперимент показал, что двустороннее введение NMU в оболочку NAc не индуцировало CPP на se (носитель-NMU, 14 ± 15%; носитель-носитель, 5 ± 13%; P = 0,6639, n = 7 в каждом группа).
Обсуждение
Настоящее исследование выявило три основных набора результатов. Во-первых, мы впервые показываем, что активация центральной сигнальной системы рецептора NMU ингибировала хорошо задокументированные эффекты амфетамина на мезоаккумбальную дофаминовую систему [27], а именно двигательную стимуляцию и высвобождение дофамина в прилежащей области.В поддержку модулирующей роли NMU в процессах поощрения являются предыдущие данные, демонстрирующие, что внутривенное введение NMU ослабляет индуцированную алкоголем локомоторную стимуляцию, высвобождение CPP и дофамина, а также снижает потребление алкоголя у грызунов [22]. Кроме того, NMU централизованно снизил потребление вкусной пищи и увеличил потребление стандартной еды [12], а паравентрикулярный нокдаун NMUR2 усилил переедание, а также предпочтение вкусной диеты с высоким содержанием жиров [17]. Результаты исследования ассоциации аллелей в масштабе всего генома показали, что полиморфизмы в гене NMUR2 связаны с расстройствами, связанными с употреблением алкоголя [28], что позволяет предположить, что представленные данные могут быть достоверными с точки зрения трансляции.Кроме того, мы обнаружили, что введение более низкой дозы NMU в третий желудочек уменьшало, но не блокировало индуцированную амфетамином двигательную стимуляцию у мышей. В поддержку дозозависимого эффекта NMU на регулирование вознаграждения являются результаты, показывающие, что центральная инъекция этой низкой дозы NMU снижает потребление алкоголя у грызунов [22]. При введении фармакологического средства в третий желудочек следует учитывать возможность того, что эффекты вызваны внутрипаренхиматозными механизмами.Таким образом, ограничение настоящего исследования состоит в том, что сайт-специфические эффекты icv-NMU не могут быть определены. Недавно мы показали, что выбранная доза NMU не оказывала эффекта per se на двигательную активность (60 минут после инъекции), высвобождение дофамина в прилежащей области (100 минут после инъекции) и экспрессию CPP у мышей [22], предполагая, что способность Блокировка амфетаминового вознаграждения является избирательной по отношению к активации NMUR, а не другим мешающим системам. В соответствии с этим подтверждающие данные показывают, что центральное введение NMU не влияет на уровни дофамина в областях мозга, включая NAc, и не влияет на движение вперед (т.е. общее время прохождения) у крыс [8]. Однако следует отметить, что более высокие дозы NMU увеличивают двигательную активность у мышей [29]. Следует также учитывать возможность того, что NMU может усиливать стереотипное поведение, вызванное амфетамином, и тем самым уменьшать общую локомоцию. Тем не менее, это кажется менее вероятным, поскольку наши наблюдательные исследования показывают, что NMU не влияет на общее поведение мышей.
Во-вторых, мы продемонстрировали, что введение NMU в NAc блокирует способность амфетамина вызывать двигательную стимуляцию, предполагая, что Accumbal NMUR2 модулирует вызванную амфетамином активацию мезолимбической дофаминовой системы.Подтверждающие доклинические данные показывают: i) индуцированная амфетамином локомоторная стимуляция опосредуется, по крайней мере, частично, через его способность увеличивать выброс дофамина в прилежащей области [30], ii) поведенческие эффекты амфетамина тесно связаны по времени с высвобождением дофамина в прилежащей области [31]. ], iii) механизм действия амфетамина включает обращение насоса обратного захвата дофамина. С этой концепцией согласуются данные, показывающие, что самые высокие уровни иммунореактивности NMU обнаруживаются в NAc [20].Более того, обнаруженное распределение иммунореактивных прилежащих волокон NMU [32] и экспрессия NMUR2 были идентифицированы в NAc как у крыс, так и у людей [8, 21]. Кроме того, центральное введение NMU активирует экспрессию c-fos в NAc [8]. Открытие того факта, что NMU внутри NAc не ослабляет индуцированного амфетамином СРР, повышает вероятность того, что на полученные результаты могут влиять повреждения тканей, вызванные местным введением. Однако это кажется менее вероятным, поскольку мы видим, что более высокие дозы NMU прилежащего отдела позвоночника снижали двигательную активность по сравнению с лечением носителем, а также что NMU внутри NAc значительно ослабляли локомоторную стимуляцию, индуцированную амфетамином.Кроме того, наблюдения за тканью мозга не показывают очевидных признаков повреждения ткани. В поддержку местного эффекта NMU в NAc являются предыдущие данные, показывающие, что введение грелина в NAc увеличивает потребление вкусной пищи, но не регулирует сексуальное поведение [33].
В-третьих, мы показали на мышах, что внутривенное введение NMU, но не непосредственно в NAc, ослабляет экспрессию CPP, что может отражать меру связанных с вознаграждением контекстных сигналов, связанных с опытом приема наркотиков [34].В подтверждение этому недавние данные, показывающие, что введение icv NMU ослабляет индуцированную алкоголем экспрессию CPP у мышей [22]. В совокупности настоящие данные предполагают, что NMU посредством центрального неизвестного механизма может изменять приобретение, а также поддержание поведения мышей в отношении приема наркотиков. Экспрессия CPP, индуцированная амфетамином, зависит от функционирующей мезокортиколимбической дофаминовой системы, в частности от высвобождения дофамина в NAc, а также в префронтальной коре (см. Обзор [35]). Кроме того, индуцированный амфетамином CPP включает передачу сигналов серотонина, в частности серотониновые рецепторы 2A / 2B / 2C, а также насос обратного захвата серотонина (см. Обзор [35]).Здесь мы сообщаем, что введение NMU внутри NAc не блокирует экспрессию CPP. Одним из предварительных объяснений может быть то, что NMUR2 в префронтальной коре или изменение серотонинергической передачи сигналов могут быть вовлечены в способность амфетамина вызывать экспрессию CPP. Последовательно введение icv NMU увеличивает уровень серотонина в таких областях мозга, как лобная кора [8]. Следует также учитывать, что NMUR2 в других областях мозга, таких как дугообразное ядро и паравентрикулярное ядро, важны для индуцированной амфетамином активации мезоаккумбальной дофаминовой системы, поскольку как фармакологические, так и генетические исследования вместе показывают, что анорексигенные свойства NMU включают NMUR2 в дугообразное ядро и паравентрикулярное ядро [13, 14, 18].Более того, анти-NMU IgG снижает вызванную NMU повышенную экспрессию c-fos в паравентрикулярном ядре [36], что позволяет предположить, что NMU нацелен непосредственно на паравентрикулярное ядро. В то же время дугообразное ядро и паравентрикулярное ядро, которые оба содержат высокую плотность NMUR2, сильно взаимосвязаны [37] и регулируют активность мезолимбических структур посредством эндорфинергических выступов [38].
Последующие механизмы, посредством которых центральная передача сигналов NMU снижает вознаграждение, индуцированное амфетамином, остаются неизвестными и нуждаются в дальнейшем изучении.Следует рассмотреть возможность того, что NMU ослабляет вознаграждение, вызванное амфетамином, вторично по отношению к его влиянию на ось стресса гипоталамус-гипофиз-надпочечники (HPA). Действительно, центральное введение NMU в более высоких дозах, чем используется в настоящее время, усиливает поведение, подобное стрессу, такое как мытье лица, расчесывание и уход за шерстью [8], а также повышает уровень в плазме гормонов стресса АКТГ и кортикостерона [36]. Более того, стрессовая реакция, индуцированная NMU, опосредуется кортикотропин-рилизинг-гормоном [29].Мыши с нокаутом кортикотропин-рилизинг-гормона не реагируют на анорексигенные эффекты NMU [39], а кортикотропин-рилизинг-гормон играет ключевую роль в этиологии, а также в поддержании наркозависимости [40]. Однако мы предполагаем, что вознаграждение, опосредованное NMU, не связано с отдыхом от стресса, поскольку было показано, что выбранная доза icv NMU, в отличие от более высоких доз, не влияет на уровень кортикостерона у грызунов [8, 22, 36]. Выводы о том, что местное введение NMU в паравентрикулярное ядро вызывает высвобождение кортикостерона, а также способствует уходу за телом, могут указывать на то, что введение выбранной дозы NMU в / в не достигает более глубоких областей мозга, таких как паравентрикулярное ядро, и поэтому не активирует Ось HPA.Кроме того, следует учитывать возможность того, что выбранная доза NMU вызывает неизмеряемую реакцию на стресс. Результаты показывают, что центральное введение NMU в зависимости от дозы увеличивает уровни окситоцина в плазме [36], а также c-Fos в окситоцин-иммунореактивных нейронах паравентрикулярной оболочки [41] и что экзогенное введение окситоцина ослабляет усиление лекарственного препарата (для обзора см. [42]). Эти данные указывают на окситоцин в качестве ориентировочной мишени для регулируемой NMU активации мезолимбической дофаминовой системы.
В последние годы традиционная роль пептидов кишечника и мозга как модуляторов энергетического гомеостаза была расширена, и было показано, что некоторые из этих пептидов регулируют вознаграждение (см. Обзор [5]). Фармакологическое или генетическое подавление рецептора орексигенного пептида грелина ослабляет способность некоторых вызывающих привыкание препаратов активировать мезоаккумбальную дофаминовую систему (см. Обзор [5]). Это утверждение подтверждается тем, что периферическое введение агониста рецептора глюкагоноподобного пептида-1, гормона сытости, блокирует подкрепление у грызунов [43–47].Более того, пептиды кишечника и мозга, такие как орексин, галанин, холецистокинин и лептин, регулируют усиление приема лекарств у грызунов [48–51].
В совокупности настоящая серия экспериментов показывает, что центральная передача сигналов NMU регулирует вызванное амфетамином вознаграждение, а также связанные с вознаграждением контекстные сигналы, связанные с опытом приема наркотиков у мышей. Более того, Accumbal NMUR2 регулирует локомоторную стимуляцию, индуцированную амфетамином, но не экспрессию CPP у мышей. Поэтому мы утверждаем, что роль центрального NMUR2 в лекарственной зависимости требует дальнейшего изучения.Тем не менее, при рассмотрении нацеливания передачи сигналов NMU для лечения наркозависимости следует принимать во внимание множественные функции NMU.
Благодарности
Бритт-Мари Ларссон и Кенн Йоханнесен выражают благодарность за квалифицированную и ценную техническую помощь. Исследование поддержано грантами Шведского исследовательского совета (2009–2782, 2011–4646 и 2015–03219), Шведского общества медицинских исследований, Шведского фонда мозга, LUA / ALF (грант №148251) из университетской больницы Сальгренска, Торстен Содерберг, Совет по исследованию алкоголя шведской монополии на розничную продажу алкоголя и фонды Адлербертска, Фредрик и Ингрид Тюринг, Торе Нильссон, Ленгманска, Вильгельм и Мартина Лундгрен, Кнут и Алиса Валленберг, Аннус Бергрс , Jeansons, Оке Виберг, NovoNordisk, Гетеборгский фонд психиатрических исследований, Шведское медицинское общество. Источники финансирования не играли никакой роли в сборе, анализе и интерпретации данных, в написании отчета или в принятии решения о представлении статьи для публикации.
Вклад авторов
Задумал и спроектировал эксперименты: EJ. Проведены эксперименты: СП ДВ. Проанализированы данные: DV EJ. Предоставленные реагенты / материалы / инструменты анализа: EJ JAE. Написал статью: EJ DV JAE JV.
Ссылки
- 1.
Роусон Р.А., Кондон Т.П. Зачем нам нужна добавка от наркозависимости, основанная на метамфетамине? Зависимость. 2007; 102 Приложение 1: 1–4. pmid: 17493048 - 2.
Srisurapanont M, Jarusuraisin N, Kittirattanapaiboon P.Лечение амфетаминовой зависимости и злоупотребления. Кокрановская база данных Syst Rev.2001; (4): CD003022. pmid: 11687171 - 3.
Ван Г.Дж., Волков Н.Д., Танос П.К., Фаулер Дж. С.. Сходство между ожирением и наркозависимостью по оценке нейрофункциональной визуализации: обзор концепции. J Addict Dis. 2004. 23 (3): 39–53. pmid: 15256343 - 4.
Тупала Э., Тиихонен Дж. Допамин и алкоголизм: нейробиологические основы злоупотребления этанолом. Прогресс нейропсихофармакологии и биологической психиатрии.2004. 28 (8): 1221–47. - 5.
Энгель Дж. А., Джерлхаг Э. Роль гормонов кишечника и головного мозга в патофизиологии алкоголизма: значение для фармакотерапии. Препараты ЦНС. 2014. 28 (10): 875–86. pmid: 24958205 - 6.
Брайтон П.Дж., Секерес П.Г., Вилларс ГБ. Нейромедин U и его рецепторы: структура, функции и физиологические роли. Фармакологические обзоры. 2004. 56 (2): 231–48. pmid: 15169928 - 7.
Митчелл Дж. Д., Магуайр Дж. Дж., Давенпорт А. П.. Новая фармакология и физиология нейромедина U и структурно родственного пептида нейромедина S.Британский журнал фармакологии. 2009. 158 (1): 87–103. pmid: 19519756 - 8.
Гартлон Дж., Секерес П., Пуллен М., Сарау Х.М., Айяр Н., Шабон У. и др. Локализация NMU1R и NMU2R в центральной нервной системе человека и крысы и эффекты нейромедина-U после центрального введения крысам. Психофармакология. 2004. 177 (1–2): 1–14. pmid: 15205870 - 9.
Хосоя М., Мория Т., Кавамата Ю., Окубо С., Фуджи Р., Мацуи Х и др. Идентификация и функциональная характеристика нового подтипа рецептора нейромедина U.J Biol Chem. 2000. 275 (38): 29528–32. pmid: 10887190 - 10.
Мартинес В.Г., О’Дрисколл Л. Нейромедин U: Многофункциональный нейропептид с плейотропными ролями. Клиническая химия. 2015; 61 (3): 471–82. pmid: 25605682 - 11.
Джетва П.Х., Смолл С.Дж., Смит К.Л., Сет А., Дарч С.Дж., Эбботт С.Р. и др. Нейромедин U играет физиологическую роль в регуляции приема пищи и частично опосредует эффекты лептина. Американский журнал физиологии эндокринологии и метаболизма.2005; 289 (2): E301–5. pmid: 16014357 - 12.
Egecioglu E, Ploj K, Xu X, Bjursell M, Salome N, Andersson N, et al. Центральная передача сигналов NMU в регуляции массы тела и энергетического баланса: данные делеции NMUR2 и хронического лечения центральной NMU у мышей. Американский журнал физиологии эндокринологии и метаболизма. 2009. 297 (3): E708–16. pmid: 19584200 - 13.
Ховард А.Д., Ван Р., Понг С.С., Меллин Т.Н., Страк А., Гуан ХМ и др. Идентификация рецепторов нейромедина U и его роль в питании.Природа. 2000. 406 (6791): 70–4. pmid: 10894543 - 14.
Ида Т., Мори К., Миядзато М., Эги Й., Абэ С., Накахара К. и др. Нейромедин — новый анорексигенный гормон. Эндокринология. 2005. 146 (10): 4217–23. pmid: 15976061 - 15.
Кодзима М., Харуно Р., Наказато М., Дате Y, Мураками Н., Ханада Р. и др. Очистка и идентификация нейромедина U в качестве эндогенного лиганда орфанного рецептора GPR66 (FM3). Сообщения о биохимических и биофизических исследованиях. 2000. 276 (2): 435–8.pmid: 11027493 - 16.
Ковальски Т.Дж., Спар Б.Д., Марковиц Л., Магуайр М., Головко А., Янг С. и др. Трансгенная сверхэкспрессия нейромедина U способствует похуданию и гипофагии у мышей. Журнал эндокринологии. 2005. 185 (1): 151–64. pmid: 15817836 - 17.
Benzon CR, Johnson SB, McCue DL, Li D, Green TA, Hommel JD. Нокдаун рецептора 2 нейромедина U в паравентрикулярном ядре изменяет поведенческие реакции на пищу с высоким содержанием жиров, вызывающую ожирение, и приводит к увеличению массы тела.Неврология. 2014; 258: 270–9. pmid: 24269937 - 18.
Накахара К., Ханада Р., Мураками Н., Тераниши Х., Огусу Х., Фукусима Н. и др. Пептид кишечник-мозг нейромедин U участвует в системе циркадных осцилляторов млекопитающих. Сообщения о биохимических и биофизических исследованиях. 2004. 318 (1): 156–61. pmid: 15110767 - 19.
Ханада Р., Тераниши Х., Пирсон Дж. Т., Курокава М., Хосода Х., Фукусима Н. и др. Нейромедин U обладает новым анорексигенным эффектом, независимым от сигнального пути лептина.Nat Med. 2004. 10 (10): 1067–73. pmid: 15448684 - 20.
Домин Дж., Гатеи М.А., Чохан П., Блум С.Р. Нейромедин U — исследование его распределения у крыс. Пептиды. 1987. 8 (5): 779–84. pmid: 3432125 - 21.
Мадердрут Дж. Л., Лазар Г., Козич Т., Мерченталер И. Распределение U-подобной иммунореактивности нейромедина в центральной нервной системе Rana esculenta. Журнал сравнительной неврологии. 1996. 369 (3): 438–50. pmid: 8743423 - 22.
Валлоф Д., Улениус Л., Эгечиоглу Э., Энгель Дж. А., Джерлхаг Э.Центральное введение анорексигенного пептида нейромедина U снижает потребление алкоголя и ослабляет вызванное алкоголем вознаграждение у грызунов. Биология зависимости. 2016 г .; электронный паб в преддверии печати, - 23.
Джерлхаг Э., Эгечиоглу Э., Ландгрен С., Саломея Н., Хейлиг М., Моечарс Д. и др. Требование центральной сигнализации грелина для алкогольной награды. Труды Национальной академии наук Соединенных Штатов Америки. 2009. 106 (27): 11318–23. pmid: 19564604 - 24.
Бломквист О., Энгель Дж. А., Ниссбрандт Х., Содерпалм Б.Мезолимбические свойства этанола по активации дофамина антагонизируются мекамиламином. Европейский журнал фармакологии. 1993. 249 (2): 207–13. pmid: 8287902 - 25.
Франклин КБДж, Паксинос Г. Мозг мыши в стереотаксических координатах. Сан-Диего: Academic Press; 1997. - 26.
Кларк Р. Б., Адермарк Л., Чау П., Содерпалм Б., Эриксон М. Повышение уровней дофамина прилежащего ядра после местного введения этанола не опосредуется ацетальдегидом. Алкоголь и алкоголизм.2014. 49 (5): 498–504. pmid: 25063803 - 27.
Санчис-Сегура С., Спанагель Р. Поведенческая оценка лекарственного подкрепления и особенностей привыкания у грызунов: обзор. Биология зависимости. 2006. 11 (1): 2–38. pmid: 16759333 - 28.
Lydall GJ, Bass NJ, McQuillin A, Lawrence J, Anjorin A, Kandaswamy R, et al. Подтверждение предшествующих доказательств генетической предрасположенности к алкоголизму в полногеномном исследовании ассоциации коморбидного алкоголизма и биполярного расстройства. Психиатрическая генетика.2011. 21 (6): 294–306. pmid: 21876473 - 29.
Ханада Р., Наказато М., Мураками Н., Сакихара С., Йошимацу Х., Тошинай К. и др. Роль нейромедина U в стрессовой реакции. Сообщения о биохимических и биофизических исследованиях. 2001. 289 (1): 225–8. pmid: 11708803 - 30.
Мудрый Р.А., Бозарт М.А. Теория зависимости от психомоторных стимуляторов. Psychol Rev.1987; 94 (4): 469–92. pmid: 3317472 - 31.
Ди Кьяра Дж., Императо А. Предпочтительная стимуляция высвобождения дофамина в прилежащем ядре опиатами, алкоголем и барбитуратами: исследования с трансцеребральным диализом на свободно движущихся крысах.Ann N Y Acad Sci. 1986; 473: 367–81. pmid: 3467628 - 32.
Баллеста Дж., Карлей Ф., Бишоп А.Е., Стил Дж. Х., Гибсон С.Дж., Фэи М. и др. Возникновение и паттерн развития U-иммунореактивных нервов нейромедина в желудочно-кишечном тракте и головном мозге крысы. Неврология. 1988. 25 (3): 797–816. pmid: 3405430 - 33.
Prieto-Garcia L, Egecioglu E, Studer E, Westberg L, Jerlhag E. Передача сигналов Ghrelin и GHS-R1A в вентральной и латеродорсальной области тегментальной области регулирует половое поведение у сексуально наивных самцов мышей.Психонейроэндокринология. 2015; 62: 392–402. pmid: 26398679 - 34.
Бардо М.Т., Бевинс Р.А. Условное предпочтение места: что это добавляет к нашему доклиническому пониманию награды за лекарство? Психофармакология. 2000. 153 (1): 31–43. pmid: 11255927 - 35.
Прус AJ, Джеймс JR, Rosecrans JA. Условное предпочтение места. В: Buccafusco JJ, редактор. Методы анализа поведения в неврологии. Границы неврологии. 2-е изд. Бока-Ратон (Флорида) 2009. - 36.
Одзаки Ю., Онака Т., Наказато М., Сайто Дж., Канемото К., Мацумото Т. и др.Центрально вводимый нейромедин U активирует нейросекрецию и индукцию рибонуклеиновой кислоты-мессенджера c-fos в паравентрикулярном и супраоптическом ядрах крыс. Эндокринология. 2002. 143 (11): 4320–9. pmid: 12399428 - 37.
Шварц М.В., Вудс СК, Порте Д. мл., Сили Р.Дж., Баскин Д.Г. Контроль центральной нервной системы за приемом пищи. Природа. 2000. 404 (6778): 661–71. pmid: 10766253 - 38.
Блум ИП. Эндорфины: растущее семейство фармакологически подходящих пептидов.Ежегодный обзор фармакологии и токсикологии. 1983; 23: 151–70. pmid: 6307119 - 39.
Ханада Т., Дате Й, Симбара Т., Сакихара С., Мураками Н., Хаяси Ю. и др. Центральное действие нейромедина U через кортикотропин-рилизинг-гормон. Сообщения о биохимических и биофизических исследованиях. 2003. 311 (4): 954–8. pmid: 14623274 - 40.
Zorrilla EP, Logrip ML, Koob GF. Релизинг-фактор кортикотропина: ключевая роль в нейробиологии зависимости. Границы нейроэндокринологии.2014; 35 (2): 234–44. pmid: 24456850 - 41.
Niimi M, Murao K, Taminato T. Центральное введение нейромедина U активирует нейроны в вентробазальном гипоталамусе и стволе мозга. Эндокринная. 2001. 16 (3): 201–6. pmid: 11954664 - 42.
Burkett JP, молодой LJ. Поведенческие, анатомические и фармакологические параллели между социальной привязанностью, любовью и зависимостью. Психофармакология. 2012. 224 (1): 1–26. pmid: 22885871 - 43.
Egecioglu E, Steensland P, Fredriksson I, Feltmann K, Engel JA, Jerlhag E.Аналог глюкагоноподобного пептида 1 эксендин-4 ослабляет опосредованное алкоголем поведение у грызунов. Психонейроэндокринология. 2013. 38 (8): 1259–70. pmid: 23219472 - 44.
Erreger K, Davis AR, Poe AM, Greig NH, Stanwood GD, Galli A. Эксендин-4 снижает двигательную активность, вызванную амфетамином. Физиология и поведение. 2012; 106 (4): 574–8. - 45.
Грэм Д.Л., Эррегер К., Галли А., Стэнвуд Г.Д. Аналог GLP-1 ослабляет кокаиновую награду. Мол Психиатрия. 2013. 18 (9): 961–2.pmid: 23089631 - 46.
Egecioglu E, Engel JA, Jerlhag E. Глюкагоноподобный аналог пептида 1, эксендин-4, ослабляет полезные свойства психостимулирующих препаратов у мышей. PloS один. 2013; 8 (7): e69010. pmid: 23874851 - 47.
Эгесиоглу Э., Энгель Дж. А., Джерлхаг Э. Глюкагоноподобный аналог пептида 1 Эксендин-4 ослабляет вызванную никотином двигательную стимуляцию, высвобождение дофамина в прямой кишке, обусловленное предпочтение места, а также проявление локомоторной сенсибилизации у мышей.PloS один. 2013; 8 (10): e77284. pmid: 24204788 - 48.
Боргланд С.Л., Таха С.А., Сарти Ф., Филдс Х.Л., Бончи А. Орексин А в ВТА имеет решающее значение для индукции синаптической пластичности и поведенческой сенсибилизации к кокаину. Нейрон. 2006. 49 (4): 589–601. pmid: 16476667 - 49.
Льюис М.Дж., Джонсон Д.Ф., Вальдман Д., Лейбовиц С.Ф., Хобель Б.Г. Микроинъекция галанина в третий желудочек увеличивает произвольное потребление этанола. Алкоголизм, клинические и экспериментальные исследования. 2004. 28 (12): 1822–8.pmid: 15608598 - 50.
Kulkosky PJ. Влияние октапептида холецистокинина на потребление этанола крысами. Алкоголь. 1984. 1 (2): 125–8. pmid: 6100356 - 51.
Бледнов Ю.А., Уокер Д., Харрис Р.А.. Блокада рецептора, чувствительного к лептину, значительно снижает потребление алкоголя у мышей. Алкоголизм, клинические и экспериментальные исследования. 2004. 28 (11): 1683–92. pmid: 15547455
Таблетки Нейромедин
Главная »Медикаменты
· Прочитать нужно: 3 мин.
Из названия таблеток Нейромедин нетрудно понять, что они предназначены для нервной системы.С их помощью лечат заболевания как периферической, так и центральной нервной системы. В медицинских учреждениях назначают этот препарат в таблетках или ампулах для инъекций и при нарушениях памяти или задержке умственного развития. При обычном неврите их следует принимать по одной таблетке трижды в день. Курс такого лечения должен составлять от 10 до 30 дней.
Состав нейромидина
Показания к применению препарата нейромидин связаны с заболеваниями нервной системы и памяти, а также атонией кишечника.Основным действующим веществом остается ипидакарин. Если в таблетки добавляют лактозу, крахмал, стеарат кальция, в ампулы для инъекций вводят хлоргидратную кислоту и воду для инъекций.
Показания к применению нейромидина
Информация о показаниях указана в инструкции по применению:
- атония кишечника;
- полирадикулопатия, поли- и мононевропатия, миастения гравис;
- парез, восстановление после поражения ЦНС с нарушением движений больных, бульбарный паралич;
- Болезнь Альцгеймера, рассеянный склероз, другие расстройства памяти и нервной системы.
Противопоказания
В инструкции по применению указаны такие противопоказания к таблеткам и инъекциям в ампулах этого типа: чувствительность к ипидакрину, эпилепсия, стенокардия, брадикардия, нарушения с вестибулярным аппаратом, язва, беременность, период лактации, кишечная непроходимость, непроходимость мочевыводящих путей.
Нейромидин инструкция по применению в инъекциях
Препарат в ампулах для инъекций следует вводить подкожно или внутримышечно.Точную дозу лекарства для пациентов определяют врачи в зависимости от степени тяжести заболевания. Например, при миастении, парезе или бульбарном параличе раствор вводят путем инъекции 1,10 г / 1 мл один или два раза в день. Согласно инструкции по применению, курс — один — два месяца.
Таблетки Нейромедин Инструкция по применению
В инструкции по применению указана такая дозировка информации в соответствии с заболеванием:
Читайте также: Температурная хоха для ребенка или взрослого — пропорции препаратов в инъекциях или таблетках
- невропатия — 10- 20 мг 1-3 раза в сутки; миастения гравис — таблетки назначают после ампул, после — по 20-40 мг 5 раз в сутки;
- при заболеваниях ЦНС — по 10-20 мг 2-3 раза в сутки;
- атония — 20 мг 2-3 раза в сутки.
Курс, в зависимости от системы лечения, может длиться от двух недель до шести месяцев.
Нейромидин в ампулах как принимать
Инструкция и рецепт позволяют вводить действующее вещество несколькими способами. Это может как внутривенный вариант, так и подкожный. Второй вариант чаще встречается при тяжелых нарушениях нервной системы. Разовая доза препарата находится в пределах от 5 до 30 мг.
При беременности применять
В инструкции по применению беременность указана как противопоказание.Дело в том, что тонус матки повышается, а это соответственно — к прерыванию беременности и выкидышу.
Аналоги нейромидина дешевле
В списке аналогов должны быть указаны действующее вещество и показания. Среди наиболее доступных аналогов:
- и ипигрис,
- аксамон,
- амиридин,
- медиатор.
Аксамон или нейромидин, что лучше
Первое, что бросается в глаза при сравнении — нейродимин дороже своих аналогов.Однако Аксамон не прошел столько исследований, сколько его более дорогой коллега, и поэтому можно быть более уверенным в первом лекарстве. Да и еще больше положительных отзывов от Нейродимин.
Противопоказания к применению
Показания в случае, если эти таблетки или ампулы нельзя принимать: эпилепсия, судороги вследствие нейроинфекций, опухоли, нарушения координации движений, непроходимость мочевыводящих путей, беременность, ишемическая болезнь сердца, бронхиальная астма, язвенная болезнь.Принимать ребенка его тоже не рекомендуют.
Отзывы врачей о препарате нейромидин
По мнению специалистов, препарат эффективен. Один из примеров, который имел место в практике актерского специалиста, такой: у пациента, у которого начали отказывать мышцы рук, развернулись. Курс лечения был двухмесячным и сложным, но я уверен, что именно этот препарат показал себя с лучшей стороны.
Читайте также: Алкозельцер — механизм действия и противопоказания, как принимать таблетки и отзывы
Сколько стоит
? По мнению врачей и пациентов, лекарство довольно дорогое.При форме выпуска в таблетках (50 шт., 20 мг) цена установлена на уровне 1100 — 1200 руб. В ампулах для раствора 15 мг / мл по 10 единиц он стоит 1600-1900 руб.
Источник
централизованно вводимый нейромедин U активирует нейросекрецию и индукцию рибонуклеиновой кислоты c-fos в паравентрикулярном и супраоптическом ядрах крыс | Эндокринология
Аннотация
Мы исследовали влияние интрацеребровентрикулярного (icv) введения нейромедина U (NMU) на аргинин вазопрессин (AVP), окситоцин (OXT) и АКТГ в плазме у крыс с помощью RIA.Индукция белка c- fos (Fos) была исследована иммуногистохимическим исследованием, а гистохимия гибридизации in situ была использована для обнаружения экспрессии гена c- fos в паравентрикулярной (PVN) и супраоптической областях. ядра (SON). Плазменные AVP, OXT и ACTH увеличивались в зависимости от дозы через 15 минут после внутривенного введения NMU. ICV-введение NMU вызывало заметную индукцию Fos-подобной иммунореактивности (LI) в SON, а также в магноцеллюлярном и парвоцеллюлярном делениях PVN.В SON и крупноклеточных делениях PVN клетки OXT-LI преимущественно проявляли ядерный Fos-LI по сравнению с клетками AVP-LI. Заметная индукция экспрессии гена c- fos в PVN и SON наблюдалась через 15, 30 и 60 минут после icv введения NMU. Нейросекреция и индукция экспрессии гена c- fos после централизованного введения NMU были значительно снижены предварительной обработкой анти-NMU IgG. Эти результаты предполагают, что центральное введение NMU активирует преимущественно OXTergic клетки в PVN и SON, а также в гипоталамо-гипофизарной надпочечниковой системе.
НЕЙРОМЕДИН U (NMU), нейропептид из 23 аминокислот, был сначала выделен из спинного мозга свиньи (1), а затем и из других видов (2, 3). NMU относится к группе пептидов, сокращающих гладкие мышцы (1), и было показано, что они широко распространены в периферических органах и центральной нервной системе (ЦНС) (4, 5). Периферическое введение NMU вызывает стимуляцию гладкой мускулатуры, повышение артериального давления (1), изменение транспорта ионов (6) и регуляцию функции надпочечников (7).Центральное введение NMU подавляет прием пищи и вызывает повышение общей двигательной активности, температуры тела и выработки тепла (8, 9).
Недавние исследования показали, что NMU является эндогенным лигандом орфанных рецепторов, связанных с G-белком, NMU1R и NMU2R (ранее называвшихся FM-3 и FM-4 соответственно) (8, 10–12). NMU1R обильно экспрессируется в тонком кишечнике и мало экспрессируется в головном мозге крыс (8, 10–12). Экспрессия NMU2R в основном ограничена определенными областями мозга крысы, в частности, паравентрикулярным ядром гипоталамуса (PVN), стенкой третьего желудочка в гипоталамусе и областью CA1 гиппокампа (8).
PVN, а также супраоптическое ядро (SON), как известно, синтезируют аргинин вазопрессин (AVP) и окситоцин (OXT), которые попадают в общую циркуляцию через терминальные аксоны, расположенные в задней доле гипофиза. Парвоцеллюлярное деление PVN синтезирует CRH, который стимулирует секрецию АКТГ в передней доле гипофиза.
Обильная экспрессия гена NMU2R в PVN крысы повышает вероятность того, что центральный NMU может участвовать в регуляции секреции AVP, OXT и индуцированной CRH секреции ACTH.Однако нет никаких доказательств того, что центральная NMU может модулировать высвобождение AVP, OXT и секрецию АКТГ, индуцированную CRH. Таким образом, в настоящем исследовании мы изучили влияние интрацеребровентрикулярного (icv) введения NMU на плазменные концентрации AVP, OXT и ACTH у крыс с помощью RIA. Мы также исследовали влияние icv-введения NMU на индукцию белка c- fos (Fos) и экспрессию гена c- fos в PVN и SON с использованием иммуногистохимии для Fos и in situ . гистохимия гибридизации для мРНК c- fos .Специфичность эффектов icv-введения NMU на нейросекрецию и экспрессию гена c-fos в PVN и SON была подтверждена предварительной обработкой анти-NMU IgG. Кроме того, проводили двойное иммуноокрашивание на Fos / AVP и Fos / OXT, чтобы определить, активирует ли icv-введение NMU избирательно эти клетки. Экспрессия гена c- fos широко используется для обнаружения нейрональной активности в ЦНС (13).
Материалы и методы
Животные
Взрослые крысы-самцы линии Вистар массой 194 ± 2.8 г (среднее ± среднеквадратичное, n = 158), были помещены индивидуально в пластиковые клетки в комнате с кондиционированием воздуха (24 ± 1 ° C) при 12-часовом освещении (0700–1900) / 12-часовом темноте (1900–0700). ) цикл.
Хирургические процедуры
Для внутривенного введения NMU или физиологического раствора животных анестезировали (пентобарбитал натрия, 50 мг / кг массы тела, внутрибрюшинная инъекция), а затем помещали в стереотаксическую рамку. Направляющая канюля из нержавеющей стали (внешний диаметр 550 мкм, длина 10,5 мм) была имплантирована стереотаксически в соответствии с координатами, данными Paxinos и Watson (14).Эти координаты находились на 0,8 мм кзади от брегмы, на 1,4 мм сбоку от средней линии и на 2,0 мм ниже поверхности левой коры, так что кончик канюли находился на 1,5 мм выше левого желудочка мозга. Два анкерных винта из нержавеющей стали были прикреплены к черепу, а канюля зафиксирована на месте акриловым стоматологическим цементом. Затем животных возвращали в клетки и давали им возможность восстановиться не менее 7 дней. Затем животных ежедневно обрабатывали и помещали в клетки до начала экспериментов.
Центральное введение NMU, анти-NMU IgG и физиологического раствора
Для внутривенного введения NMU, анти-NMU IgG и физиологического раствора через канюлю на глубину 1,5 мм за концом направляющей вводили инжектор из нержавеющей стали (300 мкм, внешний диаметр). Общий объем введенного раствора NMU и физиологического раствора в боковой желудочек составлял 7,9 мкл, который затем растворяли в стерильном 0,9% физиологическом растворе. НМУ крысы был приобретен в Институте пептидов (Минох, Япония).Контрольный сывороточный IgG (1 мкг / 5 мкл) или IgG против NMU (1 мкг / 5 мкл) вводили внутривенно непосредственно перед внутривенно введением NMU (1 нмоль, 2,64 мкл). Специфичность IgG к NMU была описана ранее (12).
Методики экспериментов
В первом эксперименте НМУ (3 нмоль / крыса) или физиологический раствор вводили внутривенно (n = 5–12 в каждой группе). Животных декапитировали через 5, 15, 30, 60 или 180 минут после введения icv. Головной мозг удаляли и помещали на порошкообразный сухой лед для гистохимии гибридизации in situ для гена c- fos .Кровь туловища собирали для измерения концентраций AVP, OXT, ACTH и кортикостерона в плазме с помощью RIA.
Во втором эксперименте также проводилось внутривенное введение NMU (0,1, 1 и 3 нмоль / крыса) или физиологического раствора (n = 6–8 в каждой группе). Через 15 мин после введения раствора животных декапитировали. Кровь туловища собирали для измерения AVP, OXT и ACTH в плазме с помощью RIA.
В третьем эксперименте NMU (1 нмоль / крыса), контрольный сывороточный IgG (1 мкг / крыса) + NMU (1 нмоль / крыса) и анти-NMU IgG (1 мкг / крыса) + NMU (1 нмоль / крыса). крысы) или физиологический раствор вводили централизованно (n = 6–8 в каждой группе).Через 30 мин после в / в введения животных декапитировали. Головной мозг удаляли и помещали на порошкообразный сухой лед для гистохимии гибридизации in situ для гена c- fos . Кровь туловища собирали для измерения концентраций OXT, ACTH и кортикостерона в плазме с помощью RIA.
В последнем эксперименте, NMU (3 нмоль / крыса) или физиологический раствор вводили icv (n = 3 в каждой группе). Через 90 минут после внутривенного введения раствора животных глубоко анестезировали внутрибрюшинной инъекцией пентобарбитала натрия (75 мг / кг веса тела) после перфузии, а затем фиксированный мозг использовали для иммуногистохимии на Fos, AVP и OXT.
Все экспериментальные процедуры в этом исследовании были выполнены в соответствии с руководящими принципами, установленными физиологическим обществом Японии для использования и ухода за лабораторными животными и одобренными комитетом по уходу за животными в этом учреждении.
RIA для AVP, OXT, ACTH и кортикостерона
Концентрации AVP и OXT в плазме определяли с помощью RIA со специфическими анти-AVP (15) и анти-OXT (16) антисыворотками, как описано ранее (17). Коэффициенты вариации между анализами и внутри анализов составили 14% и 6% для AVP и 10% и 4% для OXT, соответственно.Минимальный предел обнаружения составил 0,5 пг / мл для AVP и 2 пг / мл для OXT.
Концентрации АКТГ и кортикостерона в плазме определяли методом РИА с использованием индикатора [ 125 I] АКТГ и -кортикостерона. Коэффициенты вариаций между и внутри анализов составляли 3% и 3% для АКТГ и 8% и 9% для кортикостерона, соответственно. Минимальный предел обнаружения составлял 2 пг / мл для АКТГ и 2 пг / мл для кортикостерона.
Гистохимия гибридизации in situ для мРНК c-fos
Гистохимию гибридизации in situ проводили на замороженных корональных срезах мозга толщиной 12 мкм, вырезанных криостатом при -20 ° C, размороженных и помещенных на предметные стекла, покрытые желатином / хромовыми квасцами.Перед разрезанием ткань мозга хранили при -80 ° C. Расположение PVN и SON определялось в соответствии с координатами, указанными в атласе Паксиноса и Ватсона (14). Разделы, включая PVN, были выбраны из таблицы 25 атласа. Разделы, включая СОН, были выбраны из таблицы 23 атласа. Восемь наборов из четырех срезов, содержащих PVN и SON, были использованы от каждой крысы для измерения плотности авторадиографии. Слайды нагревали до комнатной температуры и давали высохнуть в течение 10 минут, а затем фиксировали в 4% формальдегиде в PBS в течение 5 минут.Затем их дважды промывали PBS и инкубировали в 0,9% NaCl, содержащем 0,25% уксусного ангидрида (об. / Об.) И 0,1 м триэтаноламина, при комнатной температуре в течение 10 мин. Затем срезы были обезвожены с использованием серий 70% (1 мин), 80% (1 мин), 95% (2 мин) и 100% (1 мин) растворов этанола последовательно и делипидированы в 100% хлороформе в течение 5 мин. Затем предметные стекла частично регидратировали сначала в 100% (1 мин), а затем в 95% (1 мин) этаноле и позволяли ему ненадолго высохнуть на воздухе.
Гибридизацию проводили при 37 ° C в течение ночи в 45-мкл буферном растворе, состоящем из 50% формамида и 4 × физиологического раствора цитрата натрия (SSC) (1 × SSC = 150 мМ NaCl, 15 мМ цитрата натрия), который содержал 500 мкг / мл ДНК спермы стриженого лосося (Sigma, St.Louis, MO), 250 мкг / мл общей РНК пекарских дрожжей (Roche Molecular Biochemicals GmbH, Мангейм, Германия), 1 × раствор Денхардта и 10% сульфат декстрана (молекулярная масса 500000, Sigma). Гибридизацию проводили под покровным стеклом Nescofilm (Bando Chemical IMD, Ltd., Осака, Япония). Использовали дезоксиолигонуклеотид с S-3′-концом 35 , комплементарный транскриптам, кодирующим c- fos (основания 138–185 нуклеотидов c- fos крысы). Специфичность зондов описана ранее (18, 19).Всего было использовано 1 × 10 6 копий в минуту / слайд для транскриптов c- fos . После гибридизации срезы промывали в течение 1 ч в четырех отдельных полосканиях 1 × SSC при 55 ° C и еще в течение часа в двух сменах 1 × SSC при комнатной температуре. Все независимые экспериментальные секции обрабатывали одновременно, чтобы свести к минимуму различные эффекты гибридизации и строгости отмывки. Гибридизированные срезы, содержащие PVN и SON, накладывали на авторадиографическую пленку (Hyperfilm, Amersham, Buckinghamshire, UK) на 14 дней для транскриптов c- fos .Авторадиографические изображения были количественно определены с использованием анализатора изображений MCID (Imaging Research, Inc., Сент-Катеринс, Онтарио, Канада). Изображения были получены камерой устройства с зарядовой связью (DAGE-MTI, Inc., Michigan City, IN) с увеличением × 40.
Расположение межклеточных и парноклеточных отделов PVN и SON было выбрано атласом. Области PVN и SON были заключены с использованием захваченных изображений. Края PVN и SON определялись с использованием пластин 25 и 23 атласа соответственно.Области PVN содержали как крупноклеточные, так и парвоцеллюлярные отделы. В настоящем исследовании мы не отличали парвоцеллюлярное деление от магноклеточного деления в PVN. Среднее значение OD авторадиограмм измеряли путем сравнения с одновременно экспонированными [ 14 C] микромасштабными образцами (Amersham). Поскольку период полураспада [ 14 ° C] чрезвычайно велик, [ 14 ° C] часто используется в качестве стандарта для количественной оценки OD авторадиографов для гистохимии гибридизации in situ и .Стандартная кривая была аппроксимирована OD микромасштаба [ 14 C] в той же пленке. Слайды, гибридизированные с зондом c- fos , погружали в ядерную эмульсию (К-5, Илфорд, Чешир, Великобритания) и экспонировали еще 28 дней.
Двойное определение Fos и иммунореактивности, подобной AVP / OXT
Глубоко анестезированным животным проводили транскардиальную перфузию 0,1 м фосфатным буфером (PB) (pH 7,4), содержащим гепарин (1000 Ед / литр), затем 4% параформальдегид и 0.2% пикриновая кислота в 0,1 м ПБ. Затем мозг был удален и разделен на три блока, включая гипоталамус. Блоки постфиксировали 4% параформальдегидом и 0,2% пикриновой кислотой в 0,1 мкл PB в течение 48 часов при 4 ° C. Затем ткани подвергали криопротекции в 20% сахарозе в 0,1 мкМ PB в течение 48 часов при 4 ° C. двойное окрашивание на Fos и OXT / AVP вырезали с помощью микротома. Срезы дважды промывали 0,1 М PBS, содержащим 0,3% Triton X-100, и инкубировали в 0,1 м PBS, содержащем 0.3% Triton X-100 с 1% пероксидазы водорода в течение 60 мин. Затем их дважды промывали 0,1 м PBS, содержащим 0,3% Triton X-100. Плавающие срезы инкубировали с первичным антителом Fos (sc-52, Santa Cruz Biotechnology, Inc., Санта-Крус, Калифорния) с последующим разбавлением в соотношении 1: 100 в 0,1 м PBS, содержащем 0,3% Triton X-100 при 4 C на 6 дн. После отмывки в течение 20 минут в 0,1 м растворе PBS, содержащем 0,3% Triton X-100, срезы дополнительно инкубировали в течение 120 минут с раствором биотинилированных вторичных антител (1: 250) и, наконец, с комплексом авидин-биотинпероксидаза (Vectastain ABC комплект, Vector Laboratories, Inc., Бурлингейм, Калифорния) на 120 мин. Пероксидазу в срезах визуализировали с помощью 0,02% диаминобензидина в трис-буфере, содержащем 0,05% пероксидазы водорода, в течение 1,5 мин. Во время двойного окрашивания на AVP OXT их последовательно инкубировали с антителом AVP (INCSTAR Corp., Stillwater, MN; разведенное 1: 6000) или антителом OXT (INCSTAR Corp .; разбавленным 1: 2000) в течение 3 дней при 4 ° C. Комплекс авидин-биотинпероксидаза стал видимым с помощью сульфата никеля.
Срезы помещали на покрытые желатином предметные стекла, сушили на воздухе, обезвоживали в 100% этаноле, очищали ксилолом и, наконец, закрывали покровным стеклом.Присутствие темно-коричневой метки, появившейся в круглых структурах, было расценено как указание на Fos-подобную иммунореактивность (LI) -позитивных ядер, а наличие фиолетовой метки, появившейся в веретенообразных структурах, было оценено как указание на AVP- или OXT-LI. Подробности иммуногистохимии опубликованы в других источниках (20, 21). Для подсчета клеток с двойной меткой были выбраны три серийных среза, включая PVN и SON, на каждое животное и подсчитанные под световым микроскопом двумя независимыми исследователями.
Статистический анализ
Среднее отклонение от контроля (процент) ± сем. Рассчитывали по результатам гистохимии гибридизации in situ . Каждую группу в рамках эксперимента сравнивали с контрольной группой. Данные были проанализированы с использованием однофакторного фракционного дисперсионного анализа с последующей корректировкой типа Бонферрони для множественного сравнения. Статистическая значимость была установлена на уровне , P менее 0,05.
Результаты
Влияние внутривенного введения NMU на плазменные концентрации AVP и OXT
Концентрации AVP и OXT в плазме измеряли после в / в введения NMU (3 нмоль / крыса) или физиологического раствора.Концентрации AVP в плазме были значительно увеличены через 15 и 30 минут после внутривенного введения NMU (3 нмоль / крыса) по сравнению с физиологическим раствором (фиг. 1A). Концентрации OXT в плазме были значительно увеличены через 15-60 минут после внутривенного введения NMU (3 нмоль / крыса) по сравнению с физиологическим раствором (рис. 1B). Концентрации AVP и OXT в плазме измеряли через 15 мин после внутривенного введения NMU (0,1, 1 и 3 нмоль) или физиологического раствора. Концентрации AVP и OXT в плазме увеличивались в зависимости от дозы через 15 мин после введения icv (рис.2, А и Б).
Рисунок 1.
Влияние icv введения NMU (3 нмоль / крыса) или носителя (физиологический раствор) на плазменные концентрации AVP (A) и OXT (B) у находящихся в сознании крыс. Данные для плазменных концентраций AVP и OXT выражены как среднее ± sem (n = 6–12). *, P <0,05; **, P <0,01 по сравнению с крысами, которым вводили физиологический раствор. Цифры в столбцах указывают количество крыс в группе.
Рисунок 1.
Влияние icv введения NMU (3 нмоль / крыса) или носителя (физиологический раствор) на плазменные концентрации AVP (A) и OXT (B) у крыс, находящихся в сознании. Данные для плазменных концентраций AVP и OXT выражены как среднее ± sem (n = 6–12). *, P <0,05; **, P <0,01 по сравнению с крысами, которым вводили физиологический раствор. Цифры в столбцах указывают количество крыс в группе.
Рисунок 2.
Эффекты icv-введения NMU (0.1, 1 и 3 нмоль / крыса) или носитель (физиологический раствор) на плазменные концентрации AVP (A), OXT (B) и ACTH (C) у находящихся в сознании крыс. Всех крыс декапитировали через 15 мин после внутривенного введения раствора. Данные для плазменных концентраций AVP, OXT и ACTH выражены в виде среднего значения ± sem (n = 6–8). *, P <0,05; **, P <0,01 по сравнению с крысами, которым вводили физиологический раствор. Цифры в столбцах указывают количество крыс в группе.
Рисунок 2.
Эффекты icv-введения NMU (0.1, 1 и 3 нмоль / крыса) или носитель (физиологический раствор) на плазменные концентрации AVP (A), OXT (B) и ACTH (C) у находящихся в сознании крыс. Всех крыс декапитировали через 15 мин после внутривенного введения раствора. Данные для плазменных концентраций AVP, OXT и ACTH выражены в виде среднего значения ± sem (n = 6–8). *, P <0,05; **, P <0,01 по сравнению с крысами, которым вводили физиологический раствор. Цифры в столбцах указывают количество крыс в группе.
Влияние внутривенного введения NMU на концентрацию АКТГ и кортикостерона в плазме
Концентрации АКТГ и кортикостерона в плазме измеряли после внутривенного введения NMU (3 нмоль / крыса) или физиологического раствора.Концентрации АКТГ в плазме были значительно увеличены через 15 и 30 минут после внутривенного введения NMU (3 нмоль / крыса) по сравнению с физиологическим раствором (фиг. 3A). Концентрация кортикостерона в плазме была значительно увеличена через 30 мин после внутривенного введения NMU (3 нмоль / крыса) по сравнению с физиологическим раствором (фиг. 3B). Концентрацию АКТГ в плазме измеряли через 15 минут после внутривенного введения NMU (0,1, 1 и 3 нмоль / крыса) или физиологического раствора. Концентрация АКТГ в плазме увеличивалась дозозависимым образом через 15 мин после внутривенного введения NMU (рис.2С).
Рисунок 3.
Влияние icv введения NMU (3 нмоль / крыса) или носителя (физиологический раствор) на плазменные концентрации АКТГ (A) и кортикостерона (B) у находящихся в сознании крыс. Данные о плазменных концентрациях АКТГ и кортикостерона выражены в виде среднего значения ± sem (n = 5–9). *, P <0,05; **, P <0,01 по сравнению с крысами, которым вводили физиологический раствор. Цифры в столбцах указывают количество крыс в группе.
Рисунок 3.
Влияние icv введения NMU (3 нмоль / крыса) или носителя (физиологический раствор) на плазменные концентрации АКТГ (A) и кортикостерона (B) у крыс, находящихся в сознании. Данные о плазменных концентрациях АКТГ и кортикостерона выражены в виде среднего значения ± sem (n = 5–9). *, P <0,05; **, P <0,01 по сравнению с крысами, которым вводили физиологический раствор. Цифры в столбцах указывают количество крыс в группе.
Влияние icv введения NMU на индукцию гена c-fos в PVN и SON
Гистохимия гибридизации in situ показала, что icv-введение NMU (3 нмоль / крыса) вызывало значительное увеличение экспрессии гена c- fos с 5 до 60 минут в парвоцеллюлярном и крупноклеточном отделах PVN и от От 5 до 180 мин на всем СОН (рис.4, А и Б). ICV-введение NMU индуцировало экспрессию гена c- fos в наибольшей степени через 60 мин в PVN и SON (рис. 4, A и B). Экспрессия гена c- fos в PVN и SON после внутривенного введения физиологического раствора существенно не изменилась. Микроскопическое наблюдение показало, что клетки, экспрессирующие ген c- fos , были распределены в парвоцеллюлярном и магноцеллюлярном отделах PVN по всем эпендимным клеткам третьего желудочка (рис.5, A и B), причем сильные сигналы наблюдаются преимущественно в дорсальных частях SON (рис. 5, C и D).
Рисунок 4.
Влияние icv введения NMU (3 нмоль / крыса) или носителя (физиологический раствор) на преобладание транскрипта c- fos в PVN (A) и SON (B). Значения представляют собой среднее ± sem (n = 5–12). *, P <0,05; *, P <0,01 по сравнению с крысами, которым вводили физиологический раствор.
Рисунок 4.
Влияние icv введения NMU (3 нмоль / крыса) или носителя (физиологический раствор) на преобладание транскрипта c- fos в PVN (A) и SON (B).Значения представляют собой среднее ± sem (n = 5–12). *, P <0,05; *, P <0,01 по сравнению с крысами, которым вводили физиологический раствор.
Рисунок 5.
Репрезентативные авторадиограммы срезов, гибридизированных с 35 S-меченным олигодезоксинуклеотидным зондом для мРНК c -fos в PVN (A и B) и SON (C и D) после icv введения NMU (3 нмоль / крыса) (B и D) или носитель (физиологический раствор) (A и C). A и B представляют собой срезы ткани, взятые через 30 минут после внутривенного введения физиологического раствора или NMU, с C и D, собранные через 60 минут после icv введения физиологического раствора или NMU. Полосы указывают 50 мкм. 3V, третий желудочек; pm — задний межклеточный ПВН; mp v , вентральная медиальная парвоцеллюлярная PVN; mpd, дорсолатеральный медиальный парвоцеллюлярный PVN; dp, дорсальный парвоцеллюлярный PVN; OX, перекрест зрительного нерва.
Рисунок 5.
Репрезентативные авторадиограммы срезов, гибридизированных с 35 S-меченным олигодезоксинуклеотидным зондом для мРНК c -fos в PVN (A и B) и SON (C и D) после icv введения NMU ( 3 нмоль / крыса) (B и D) или носитель (физиологический раствор) (A и C).A и B представляют собой срезы ткани, взятые через 30 минут после внутривенного введения физиологического раствора или NMU, с C и D, собранные через 60 минут после icv введения физиологического раствора или NMU. Полосы указывают 50 мкм. 3V, третий желудочек; pm — задний межклеточный ПВН; mp v , вентральная медиальная парвоцеллюлярная PVN; mpd, дорсолатеральный медиальный парвоцеллюлярный PVN; dp, дорсальный парвоцеллюлярный PVN; OX, перекрест зрительного нерва.
Влияние предварительной обработки icv анти-NMU на NMU-индуцированную нейросекрецию и экспрессию гена c-fos
Через 30 минут после внутривенного введения NMU (1 нмоль / крыса) концентрации OXT и ACTH в плазме были значительно увеличены, а экспрессия гена c- fos значительно увеличилась в PVN и SON (рис.6). Через 30 минут после внутривенного введения анти-NMU IgG (1 мкг / крыса) + NMU (1 нмоль / крыса) концентрации OXT и ACTH в плазме были увеличены, а экспрессия гена c- fos увеличилась в PVN. и СЫН. Однако эффекты icv-введения NMU на секрецию OXT и ACTH были значительно снижены при предварительной обработке анти-NMU IgG (фиг. 6, A и B). Изменения экспрессии гена c- fos в PVN и SON после icv введения NMU были значительно ослаблены предварительной обработкой анти-NMU IgG (рис.6, В и Г). Предварительная обработка контрольного сывороточного IgG не ослабляла изменений, вызванных NMU (фиг. 6).
Рисунок 6.
Влияние предварительной обработки анти-NMU IgG на NMU-индуцированную нейросекрецию плазмы OXT (A) и ACTH (B) и экспрессию гена c- fos в PVN (C) и SON (D) . Нейросекреция OXT и ACTH в плазме и индукция значений пропускания c- fos в PVN и SON после введения NMU (1 нмоль / крыса) частично блокировались предварительной обработкой IgG против NMU (1 мкг / крыса).Значения представляют собой среднее ± sem (n = 6–8). *, P <0,05; **, P <0,01, по сравнению с крысами, которым вводили анти-NMU IgG + NMU.
Рисунок 6.
Влияние предварительной обработки анти-NMU IgG на NMU-индуцированную нейросекрецию плазмы OXT (A) и ACTH (B) и экспрессию гена c- fos в PVN (C) и SON (D ). Нейросекреция OXT и ACTH в плазме и индукция значений пропускания c- fos в PVN и SON после введения NMU (1 нмоль / крыса) частично блокировались предварительной обработкой IgG против NMU (1 мкг / крыса).Значения представляют собой среднее ± sem (n = 6–8). *, P <0,05; **, P <0,01, по сравнению с крысами, которым вводили анти-NMU IgG + NMU.
Двойное обнаружение Fos-LI и OXT- / AVP-LI в PVN и SON
Клетки Fos-LI в PVN после icv введения NMU (3 нмоль / крыса) были обнаружены OXT-LI, а не клетками AVP-LI (фиг. 7). Многочисленные клетки Fos-LI в парвоцеллюлярных частях PVN не показали ни клеток OXT-LI, ни AVP-LI (рис.7). В SON клетки OXT-LI преобладали в ядерной области Fos-LI по сравнению с клетками AVP-LI (рис. 8). Количество Fos-LI-положительных клеток среди OXT-LI-положительных клеток составляло 591 ± 235 клеток (81%) в PVN и 529 ± 69 клеток (71%) в SON после icv введения NMU (3 нмоль / крыса ). После icv введения физиологического раствора количество Fos-LI-положительных клеток из OXT-LI-положительных клеток составляло 9 ± 5 клеток (1%) в PVN и 20 ± 9 клеток (4%) в SON. Аналогичным образом, количество Fos-LI-положительных клеток из AVP-LI-положительных клеток составляло 16 ± 3 клеток (3%) в PVN и 49 ± 19 клеток (8%) в SON после icv введения NMU (3 нмоль /крыса).После icv введения физиологического раствора количество Fos-LI-положительных клеток из AVP-LI-положительных клеток составляло 0 клеток (0%) в PVN и 15 ± 13 клеток (2%) в SON. Распределение двойно окрашенных клеток показано на фиг. 9 и 10. Fos-LI-позитивные клетки OXT-LI-позитивных клеток были обнаружены в переднем магноцеллюлярном и вентральном медиальном парвоцеллюлярном отделах PVN и по всему SON.
Рисунок 7.
Сосуществование Fos-LI и AVP- / OXT-LI в PVN через 90 минут после внутривенного введения NMU (3 нмоль / крыса).A, сосуществование Fos-LI (коричневый) и AVP-LI (фиолетовый) . B, Расширения областей в рамке на панели A. C, Сосуществование Fos-LI (коричневый) и OXT-LI (фиолетовый) . D, увеличенные области заштрихованных областей на панели C. Черные стрелки указывают на сосуществование ядерных Fos-LI и AVP- или OXT-LI. Белые стрелки указывают на AVP- или OXT-LI без Fos-LI. Штанга обозначает 50 мкм. 3V, Третий желудочек.
Рисунок 7.
Сосуществование Fos-LI и AVP- / OXT-LI в PVN через 90 мин после внутривенного введения NMU (3 нмоль / крыса). A, сосуществование Fos-LI (коричневый) и AVP-LI (фиолетовый) . B, Расширения областей в рамке на панели A. C, Сосуществование Fos-LI (коричневый) и OXT-LI (фиолетовый) . D, увеличенные области заштрихованных областей на панели C. Черные стрелки указывают на сосуществование ядерных Fos-LI и AVP- или OXT-LI. Белые стрелки указывают на AVP- или OXT-LI без Fos-LI. Штанга обозначает 50 мкм. 3V, Третий желудочек.
Рисунок 8.
Сосуществование Fos-LI и AVP- / OXT-LI в SON через 90 мин после внутривенного введения NMU (3 нмоль / крыса). A, сосуществование Fos-LI (коричневый) и AVP-LI (фиолетовый) . B, Расширения областей в рамке в A. C, Сосуществование Fos-LI (коричневый) и OXT-LI (фиолетовый) .D, увеличенные области заштрихованных областей на панели C. Черные стрелки указывают на сосуществование ядерных Fos-LI и AVP- или OXT-LI. Белые стрелки указывают на AVP- или OXT-LI без Fos-LI. Штанга обозначает 50 мкм. OX, Хиазма зрительного нерва.
Рисунок 8.
Сосуществование Fos-LI и AVP- / OXT-LI в SON через 90 мин после внутривенного введения NMU (3 нмоль / крыса). A, сосуществование Fos-LI (коричневый) и AVP-LI (фиолетовый) . B, Расширения из областей в рамке в A.C, сосуществование Fos-LI (коричневый) и OXT-LI (фиолетовый) . D, увеличенные области заштрихованных областей на панели C. Черные стрелки указывают на сосуществование ядерных Fos-LI и AVP- или OXT-LI. Белые стрелки указывают на AVP- или OXT-LI без Fos-LI. Штанга обозначает 50 мкм. OX, Хиазма зрительного нерва.
Рисунок 9.
Топографическое картирование FosLI и AVP- / OXT-LI в PVN через 90 минут после внутривенного введения носителя (физиологический раствор) (A – D) или NMU (3 нмоль / крыса) (E – H).A, B, E и F, сосуществование Fos-LI и AVP-LI (закрашенный квадрат) . C, D, G, H, сосуществование Fos-LI и OXT-LI (замкнутый треугольник) . Открытый кружок указывает на Fos-LI-положительную клетку, открытый треугольник указывает на OXT-LI-положительную клетку, а закрытый треугольник указывает на клетку, иммунореактивную как для Fos, так и для OXT. Открытый квадрат указывает на AVP-LI-положительную клетку, а закрытый квадрат указывает на клетку, иммунореактивную как в отношении Fos, так и в отношении AVP. Штанга обозначает 50 мкм. 3V, третий желудочек; ап — передний межклеточный ПВН; pm — задний межклеточный ПВН; mp v , вентральная медиальная парвоцеллюлярная PVN; mp d , дорсолатеральный медиальный парвоцеллюлярный PVN; dp, дорсальный парвоцеллюлярный PVN; pv, перивентрикулярное ядро. Коронковые срезы были вырезаны на 30 мкм.
Рисунок 9.
Топографическое картирование FosLI и AVP- / OXT-LI в PVN через 90 мин после внутривенного введения носителя (физиологический раствор) (A – D) или NMU (3 нмоль / крыса) (E – H).A, B, E и F, сосуществование Fos-LI и AVP-LI (закрашенный квадрат) . C, D, G, H, сосуществование Fos-LI и OXT-LI (замкнутый треугольник) . Открытый кружок указывает на Fos-LI-положительную клетку, открытый треугольник указывает на OXT-LI-положительную клетку, а закрытый треугольник указывает на клетку, иммунореактивную как для Fos, так и для OXT. Открытый квадрат указывает на AVP-LI-положительную клетку, а закрытый квадрат указывает на клетку, иммунореактивную как в отношении Fos, так и в отношении AVP. Штанга обозначает 50 мкм. 3V, третий желудочек; ап — передний межклеточный ПВН; pm — задний межклеточный ПВН; mp v , вентральная медиальная парвоцеллюлярная PVN; mp d , дорсолатеральный медиальный парвоцеллюлярный PVN; dp, дорсальный парвоцеллюлярный PVN; pv, перивентрикулярное ядро. Коронковые срезы были вырезаны на 30 мкм.
Рисунок 10.
Топографическое картирование Fos-LI и AVP- / OXT-LI в SON через 90 минут после внутривенного введения носителя (физиологический раствор) (A и B) или NMU (3 нмоль / крыса) (C и D) .A. Сосуществование Fos-LI и AVP-LI (закрашенный квадрат) . B и D, сосуществование Fos-LI и OXT-LI (замкнутый треугольник) . На каждой панели были выбраны три толстых корональных среза толщиной 30 мкм от переднего к заднему SON. Открытый кружок указывает на Fos-LI-положительную ячейку, открытый треугольник указывает на OXT-LI-положительную ячейку, а закрытый треугольник указывает на ячейку, дважды помеченную как для Fos, так и для OXT. AVP-LI-положительные клетки обозначены открытыми квадратами , а клетки, иммунореактивные как в отношении Fos, так и в отношении AVP, показаны как закрытых квадрата . Штанга обозначает 50 мкм. OX, Хиазма зрительного нерва.
Рис. 10.
Топографическое картирование Fos-LI и AVP- / OXT-LI в SON через 90 мин после внутривенного введения носителя (физиологический раствор) (A и B) или NMU (3 нмоль / крыса) (C и D ). A. Сосуществование Fos-LI и AVP-LI (закрашенный квадрат) . B и D, сосуществование Fos-LI и OXT-LI (замкнутый треугольник) . На каждой панели были выбраны три толстых корональных среза толщиной 30 мкм от переднего к заднему SON. Открытый кружок указывает на Fos-LI-положительную ячейку, открытый треугольник указывает на OXT-LI-положительную ячейку, а закрытый треугольник указывает на ячейку, дважды помеченную как для Fos, так и для OXT.AVP-LI-положительные клетки обозначены открытыми квадратами , а клетки, иммунореактивные как в отношении Fos, так и в отношении AVP, показаны как закрытых квадрата . Штанга обозначает 50 мкм. OX, Хиазма зрительного нерва.
Обсуждение
Настоящее исследование продемонстрировало, что центральное введение NMU активирует преимущественно OXTergic клетки в PVN и SON, а также в оси гипоталамо-гипофиз-надпочечники (HPA) у крыс, находящихся в сознании.
Концентрации OXT в плазме были значительно увеличены через 15, 30 и 60 минут после внутривенного введения NMU (3 нмоль / крыса).Концентрации OXT в плазме явно увеличивались после внутривенного введения NMU дозозависимым образом (рис. 2B). Серино и др. . (22) продемонстрировали, что центральное введение адреномедуллина (AM), мощного гипотензивного пептида, вызывало значительное повышение концентрации OXT в плазме у крыс, находящихся в сознании. Повышение плазменных концентраций OXT достигло пика через 10 мин после внутривенного введения AM. Эффекты icv-введения NMU на повышение плазменной концентрации OXT были более продолжительными, чем эффекты icv-введения AM.Раннее повышение концентрации OXT в плазме может быть опосредовано центрально, но неясно, опосредованы ли последующие эффекты центральными эффектами NMU или вторичными эффектами, такими как изменения в поведении (8, 9), гипертермия, вызванная NMU (8, 9) и повышение артериального давления (1).
Концентрации AVP в плазме были значительно увеличены через 15 и 30 минут после внутривенного введения NMU. Величина увеличения AVP была небольшой и непродолжительной после внутривенного введения NMU.Поскольку центрально вводимая доза NMU, по-видимому, не оказывает сильного воздействия на секрецию AVP, трудно оценить, участвует ли центральная NMU в регуляции секреции AVP физиологически. Кроме того, высокая доза центрально вводимого NMU (3 нмоль / крыса) вызвала значительное увеличение только концентрации AVP в плазме.
Исследование с двойным иммуноокрашиванием показало, что Fos-LI находился преимущественно в клетках OXT-LI в переднем магноцеллюлярном и вентральном медиальном парвоцеллюлярном делении PVN и по всему SON, хотя несколько клеток AVP-LI находились в магноклеточных отделах PVN и SON продемонстрировал ядерный Fos-LI после внутривенного введения NMU.Наши результаты согласуются с недавним исследованием, которое показало, что было большое количество клеток Fos / OXT в PVN и SON после icv введения NMU и небольшая доля клеток Fos / AVP (23). Эти результаты согласуются с результатом, согласно которому концентрация в плазме OXT была преимущественно увеличена, а не AVP после внутривенного введения NMU.
Концентрации АКТГ в плазме значительно увеличились через 30 мин после внутривенного введения NMU (3 нмоль / крыса). Концентрации АКТГ в плазме увеличивались после внутривенного введения NMU дозозависимым образом (рис.2С). Увеличение концентрации АКТГ в плазме после внутривенного введения NMU может быть результатом активации CRH-содержащих нейронов в PVN. В настоящем исследовании экспрессия гена c- fos и индукция Fos-LI после icv введения NMU наблюдалась в парвоцеллюлярном делении PVN, который, как известно, содержит клетки, продуцирующие CRH. Было продемонстрировано, что периферическое введение NMU8 (фрагмент NMU) вызывает временное повышение плазменных концентраций АКТГ и устойчивое повышение плазменных концентраций кортикостерона (24).Неясно, проходит ли периферическое введение NMU через гематоэнцефалический барьер. Однако центральное введение NMU может активировать ось HPA, поскольку через 30 минут после внутривенного введения NMU наблюдалось повышение уровня АКТГ и кортикостерона в плазме. Ханада и др. . (25) сообщили, что вызванные NMU стрессовые реакции (общая двигательная активность, поведение при мытье лица и уход) были значительно устранены предварительной обработкой антагонистом CRH, α-спиральной CRH или анти-CRH IgG, и что NMU не индуцировал двигательная активность у мышей с нокаутом CRH.Таким образом, центральная NMU может играть важную роль в регуляции оси HPA. Хотя нейроны, продуцирующие NMU, были ограничены рострокаудальной частью дугообразного ядра, волокна NMU-LI были широко распространены по всей ЦНС (5). Центральный NMU может выполнять несколько физиологических функций в ЦНС.
Настоящее исследование также показывает, что экспрессия гена c- fos и индукция Fos-LI в PVN и SON были увеличены после icv введения NMU. Заметное увеличение гена c- fos в PVN и SON наблюдалось через 60 мин после icv введения NMU.Экспрессия гена c- fos в PVN и SON должна отражать активацию нейронов прямо или косвенно после icv введения NMU. Поскольку экспрессия NMU2R в PVN является обильной (8), центрально вводимые NMU могут активировать нейроны PVN непосредственно через NMU2R. Стоит отметить, что ген c- fos экспрессировался во всех эпендимных клетках третьего желудочка после внутривенного введения NMU. Поскольку экспрессия NMU2R в клетках обильная (8), одна из возможностей косвенного пути, посредством которого NMU может активировать нейроны PVN, связана с неизвестным фактором, происходящим из эпендимных клеток.
Предварительная обработка анти-NMU IgG значительно ослабляла вызванную NMU нейросекрецию и индукцию экспрессии гена c- fos в PVN и SON. Таким образом, мы подтвердили, что наши наблюдения после внутривенного введения NMU могут иметь специфические эффекты через NMU. Однако физиологическая роль эндогенных NMU должна быть оценена путем дальнейших исследований с использованием анти-NMU IgG.
Централизованное введение NMU подавляло аппетит у крыс (8, 9). Недостаток пищи вызывал снижение экспрессии гена NMU в гипоталамусе (8).Анорексические пептиды, такие как холецистокинин и AM, активируют центральный путь OXTergic у крыс (26, 27). Настоящее исследование показывает, что центральный NMU может активировать OXT-продуцирующие клетки в PVN и SON у крыс. Активация центрального пути OXTergic может быть вовлечена в подавление кормления после центрального введения NMU.
Центральное введение NMU вызывало вазопрессорные и симпатические реакции у анестезированных (1) и находящихся в сознании крыс (8, 9). Поскольку известно, что PVN является интегративным участком для координации нейроэндокринных и вегетативных функций (28, 29), центральное введение NMU может активировать нейроны PVN, которые проецируются в области ствола головного мозга и спинной мозг, связанные с симпатическим оттоком. .В настоящем исследовании мы продемонстрировали, что введенные icv NMU индуцировали экспрессию гена c- fos и индукцию Fos в подразделении PVN, который может проецироваться на ствол головного мозга и спинной мозг (рис. 9).
В заключение, центрально вводимые NMU могут активировать нейрональную активность в PVN и SON. В частности, производящие OXT магноклеточные нейросекреторные клетки в PVN и SON предпочтительно активируются центральным введением NMU.
Благодарности
Мы благодарим Dr.Майка Людвига (Медицинская школа Эдинбургского университета) за критическое прочтение рукописи. Мы также благодарим г-жу Азуми Омори и г-жу Хироко Китамура за их техническую помощь.
Эта работа была частично поддержана грантами на научные исследования (B) 10218210 (YU) от Министерства образования, науки, спорта и культуры Японии, исследовательским грантом Министерства здравоохранения и социального обеспечения. и от Ajinomoto Co. Ltd. (Япония).
Сокращения
AM
AVP
CNS
Fos
HPA
гипоталамо-гипофизарно-надпочечниковый
icv
icv
NMU
OXT
PB
PVN
SON
SSC
1
Minamino
N
K
K H
1985
Нейромедин U-8 и U-25: новые пептиды, стимулирующие матку, и гипертензивные пептиды, идентифицированные в спинном мозге свиней
.
Biochem Biophys Res Commun
130
:
1078
—
1085
2
Domin
J
,
Ghatei
MA
,
Chohan
P
000 9000 9000
000 SR
9000 9000
000
Характеристика нейромедина U-подобной иммунореактивности в экстрактах тканей крыс, свиней, морских свинок и человека с использованием специфического радиоиммуноанализа
.
Biochem Biophys Res Commun
140
:
1127
—
1134
3
O’Harte
F
,
Bockman
CS
,
Zeng
W
W
W
W
W
W
W
Harvey
S
,
Conlon
JM
1991
Первичная структура и фармакологическая активность нонапептида, родственного нейромедину U, выделенному из кишечника цыпленка
.
Пептиды
12
:
809
—
812
4
Honzawa
M
,
Sudoh
T
,
Minamino
N
,
Tohyama
1987
Топографическая локализация U-подобных структур нейромедина в головном мозге крысы: иммуногистохимическое исследование
.
Neuroscience
23
:
1103
—
1122
5
Ballesta
J
,
Carlei
F
,
Bishop
AE
000
Gibson
,
Fahey
M
,
Hennessey
R
,
Domin
J
,
Bloom
SR
,
Polak
JM
1988
нейроактивных нервов в желудочно-кишечном тракте и мозге крысы
.
Neuroscience
25
:
797
—
816
6
Коричневый
DR
,
Кито
FL
1988
Нейромедин U октапептид 3 изменяет транспорт ионов в порохе
Eur J Pharmacol
155
:
159
—
162
7
Malendowicz
LK
,
Nussdorfer
GG
,
Markowska
000
000
A2000 сейчас M
,
Warchol
JB
1994
Влияние нейромедина U (NMU) -8 на гипоталамо-гипофизарно-надпочечниковую ось крыс.Доказательства прямого действия NMU-8 на надпочечники
.
Нейропептиды
26
:
47
—
53
8
Ховард
AD
,
Ван
R
,
Понг
SS
,
000 Strack3
000 TN
,
Guan
XM
,
Zeng
Z
,
Williams Jr
DL
,
Feighnr
SD
,
Nunes
CN
,
Murphy
,
Yu
H
,
Jiang
Q
,
Clements
MK
,
Tan
CP
,
McKee
KK
,
Hreniuk
DL
DL
Lynch
KR
,
Evans
JF
,
Austin
CP
,
Caskey
CT
,
Фургон der Ploeg
LH
,
Liu
Q
2000
Идентификация рецепторов нейромедина U и его роль в питании
.
Nature
406
:
70
—
74
9
Nakazato
M
,
Hanada
R
,
Murakami
N
,
Mondal
,
Кодзима
M
,
Йошимацу
H
,
Кангава
K
,
Мацукура
S
2000
Центральные эффекты нейромедина 3 U в регуляции энергетического гомеостаза 9000.
Biochem Biophys Res Commun
277
:
191
—
194
10
Fujii
R
,
Hosoya
M
,
Fukusumi
000
000 S
000 S
Y
,
Hinuma
S
,
Onda
H
,
Nishimura
O
,
Fujino
M
2000
Идентификация белка нейротемедана лиганда G как родственного нейротемедина лиганда U сопряженный рецептор FM-3
.
J Biol Chem
275
:
21068
—
21074
11
Szekeres
PG
,
Muir
AI
,
Spinage
LD
9000 9000
Butler SI
,
Smith
A
,
Rennie
GI
,
Murdock
PR
,
Fitzgerald
LR
,
Wu
HI
,
McMer000
,
Vawter
L
,
Elshourbagy
NA
,
Mooney
JL
,
Bergsma
DJ
,
Wilson
S
9000
0002 Nembers является сильным агонистом рецептора FM3
, сопряженного с белком G-сиротом.
J Biol Chem
275
:
20247
—
20250
12
Кодзима
M
,
Haruno
R
,
Nakazato
000 M
000
000
000
000
M
N
,
Hanada
R
,
Matsuo
H
,
Kangawa
K
2000
Очистка и идентификация нейромедина U как эндогенного лиганда для орфанного рецептора 3) GPR66 (FM0003.
Biochem Biophys Res Commun
276
:
435
—
438
13
Sagar
SM
,
Sharp
FR
,
Curran
T
Express
из
из
Белок в головном мозге: метаболическое картирование на клеточном уровне
.
Наука
240
:
1328
—
1331
14
Paxinos
G
,
Watson
C
1982
Мозг крысы в стереотаксических координатах
.
Сидней
:
Academic Press
15
Sakurai
H
,
Kurimoto
F
,
Ohono
H
,
Kanai
A
,
000
000
000
000
,
Shizume
K
1985
Простой и высокочувствительный радиоиммуноанализ на 8-аргинин вазопрессин в плазме крови человека с использованием обращенно-фазовой колонки с диоксидом кремния C18
.
Nippon Naibunpi Gakkai Zasshi
61
:
724
—
736
16
Higuchi
T
,
Honda
K
,
Fukuoka
K
1985
Выделение окситоцина у крыс во время кормления грудью и во время родов
.
J Эндокринол
105
:
339
—
346
17
Онака
T
,
Yagi
K
1990
Дифференциальные эффекты эмоционального страха, связанные с 3-эндокринным стрессом, на нейроэмоциональный стресс 9000.
Exp Brain Res
81
:
53
—
58
18
Kawata
M
,
McCabe
JT
,
Pfaff
DW
53
Гибридный синтетический олигонуклеотид окситоцина: стратегия создания зонда и его применение
.
Brain Res Bull
20
:
693
—
697
19
Stricker
EM
,
Verbalis
JG
1986
Взаимодействие в регуляции осмотической секреции и объема нейрогитами 3 .
Am J Physiol
250
:
R267
—
R275
20
Ison
A
,
Юрий
K
,
Ueta
Y
0002
G900 9000 Ko0003 K
,
Yamashita
H
,
Kawata
M
1993
Вазопрессин- и окситоцин-иммунореактивные нейроны гипоталамуса инбредных полидипсических мышей
.
Brain Res Bull
31
:
405
—
414
21
Онака
T
,
Luckman
SM
,
Guevara-Guzman
Kend3
eta,
R
eta,
R
eta
K
,
Ленг
G
1995 Пресинаптические действия морфина: блокада индуцированного холецистокинином высвобождения норадреналина в супраоптическом ядре крысы.
J Physiol
482
:
69
—
79
22
Serino
R
,
Ueta
Y
,
Hara
Y
,
am
000 Nomura Y
,
Shibuya
I
,
Hattori
Y
,
Kitamura
K
,
Kangawa
K
,
Russell
JA
YA
YA
Централ введенный адреномедуллин увеличивает уровень окситоцина в плазме с индукцией рибонуклеиновой кислоты с- fos в паравентрикулярном и супраоптическом ядрах крысы
.
Эндокринология
140
:
2334
—
2342
23
Niimi
M
,
Murao
K
,
Taminato
T
Uentral гипоталамус и ствол мозга
.
Эндокрин
16
:
201
—
206
24
Малендович
LK
,
Нуссдорфер
GG
,
Новак
000
000
000 GG
000
000
000
000 нейромедин U-8 на оси гипофиз-надпочечник крысы
.
In Vivo
7
:
419
—
422
25
Hanada
R
,
Nakazato
M
,
Murakami
N
000
000 Ysuha
,
osh2000
000 Hsuhara
,
Toshinai
K
,
Hanada
T
,
Suda
T
,
Kangawa
K
,
Matsukura
S
000 9000 9000 9000
Sakata
для нейромедина U в стрессовой реакции
.
Biochem Biophys Res Commun
289
:
225
—
228
26
Verbalis
JG
,
McCann
MJ
,
EMM
CM
CM
Секреция окситоцина в ответ на холецистокинин и пищу: дифференциация тошноты от чувства насыщения
.
Наука
232
:
1417
—
1419
27
Ueta
Y
,
Serino
R
,
Shibuya
I
,
000 KITAMURA
Kitamura
,
Yamashita
H
2000
Физиологическая роль адреномедуллина у крыс: мощный гипотензивный пептид в гипоталамо-нейрогипофизарной системе
.
Exp Physiol
85
:
1635
—
1695
28
Swanson
LW
,
Sawchenko
PE
1983
Гипоталамическая
-паражелудочковая интеграция.
Annu Rev Neurosci
6
:
269
—
324
29
Yamashita
H
,
Kannan
H
,
Inveta
Y
вентолатеральных передача висцерорецептивной информации паравентрикулярному ядру гипоталамуса
.
Prog Brain Res
81
:
293
—
302
Авторские права © 2002, Общество эндокринологов
Аналог «Прозерина» по действию. Сравнение аналогов и отзывы о них
«Прозерин» широко применяется в медицинской практике при терапии различных патологических состояний, характеризующихся снижением тонуса гладкой мускулатуры. Препарат очень эффективен. Однако в некоторых случаях желательно использовать именно аналоги, а не оригинальные средства.Выбор синонимов действующего вещества ограничен. Но можно найти аналог «Прозерина» по фармакологической группе.
Описание препарата «Прозерин»
Препарат выпускается в форме таблеток или раствора для инъекций. В одной таблетке содержится 15 мг действующего вещества — неостигмина метилсульфата. Капсулы расфасованы в стикеры по десять штук, в картонной пачке две контурные ячейковые упаковки, то есть всего 20 таблеток «Прозерина».В одном мл раствора для инъекций содержится 0,5 мг действующего вещества. В продаже можно найти флаконы объемом 150 мл. Для детей препарат выпускается в виде гранул для приготовления суспензии.
Производитель препарата в России — «Дальхимфарм» (правопреемник Хабаровского химкомбината). Украинский аналог «Прозерина» (название препарата «Прозерин Дарница») выпускает фармацевтическая компания «Дарница» — крупнейший поставщик лекарственных средств в стране.Препарат доступен по доступным ценам. В аптеках Москвы можно купить одну упаковку за 70-80 руб. Украинский аналог «Прозерина» стоит столько же — в среднем 20 грн.
Показания к применению
Препарат применяется для лечения и профилактики патологий нервной системы, которые сопровождаются нарушением передачи импульсов и снижением мышечного тонуса. Препарат показан при:
- Патологической усталости и хронической мышечной слабости (миастения).
- Паралич различного происхождения.
- Полное или частичное разрушение волокон зрительного нерва (атрофия).
- Воспаление периферических нервов.
- Снижение тонуса мочевого пузыря, желудка или кишечника (как в профилактических, так и в лечебных целях).
- Воспаление головного или спинного мозга.
- Слабая родовая деятельность (редко).
Кроме того, в некоторых случаях «Прозерин» назначают как противоядие от средств, вызывающих расслабление мышц.Важно помнить, что бессистемное применение препаратов, особенно со сложным механизмом действия, наличием серьезных противопоказаний и возможных побочных эффектов, недопустимо. Не занимайтесь самолечением! В дальнейшем это может усложнить традиционную диагностику и схему лечения, а также привести к серьезным осложнениям.
Противопоказания и побочные эффекты
Основные противопоказания к применению «Прозерина» — острые инфекционно-воспалительные процессы, различные патологии нормальной работы сердечно-сосудистой системы, механическая непроходимость мочевыводящих путей или желудочно-кишечного тракта, эпилепсия.Под строгим врачебным контролем лекарство принимают при беременности и в период лактации.
Применение «Прозерина» может сопровождаться несколькими неприятными побочными эффектами со стороны пищеварительной, сердечно-сосудистой, дыхательной или нервной систем. Иногда возникают аллергические реакции. У больного могут наблюдаться расстройства пищеварения, нарушения сердечного ритма, появление одышки, головной боли и общей слабости.
Таблетки или раствор для инъекций?
Выбор формы препарата зависит от состояния пациента.Раствор для инъекций применяют в первую очередь в тех случаях, когда необходимо, чтобы препарат быстро подействовал. Сторонники инъекционного метода введения лекарства утверждают, что инъекции, в отличие от таблеток, не наносят вреда пищеварительному тракту, печени и почкам.
На самом деле принципиальная разница в уровне Нет эффективности между таблетками и уколами. И нагрузка на печень и почки создается в любом случае (при выведении из организма препарата под названием «Прозерин»). Аналоги в таблетках и оригинальный препарат, как правило, используются несколько чаще, чем растворы.
Аналоги «Прозерина»
Абсолютно синонимичные препараты по основному действующему веществу не имеют лекарственного средства. Можно ли выбирать между следующими лекарствами: «Прозерин Дарница» и российское лекарство «Прозерин». Аналогами по действию являются препараты Армин, Убретид, Амиридин, Оксазил, Нейромидин и некоторые другие лекарственные средства.
Синонимичные препараты доступны в различных формах. Таким образом, аналогами «Прозерина» в ампулах для инъекций являются «Убретид», «Амиридин» и «Нейромидин».Эти же лекарства, как и «Оксазил», выпускаются в форме таблеток. «Армин» — это глазные капли. Любой аналог «Прозерина» (уколы, таблетки или глазные капли), как и оригинальный препарат, необходимо применять с разумной осторожностью и под контролем лечащего врача.
Оксазил
«Оксазил» фактически является синонимом «Просерин». У аналогов есть положительные отзывы. И это лекарство не исключение. Выпускается исключительно в форме таблеток для приема внутрь.Основными показаниями к применению «Оксазила», помимо хронической мышечной слабости и повышенной утомляемости, являются:
- Период выздоровления после полиомиелита, травм головного и спинного мозга, менингита и энцефалита.
- Периферическое поражение (паралич) лицевого нерва.
- Прогрессирующий синдром бокового амиотрофического склероза.
Противопоказания практически не отличаются от указанных в инструкции «Прозерина». Среди них, в первую очередь, эпилепсия, повышенная чувствительность к отдельным компонентам препарата, сахарный диабет (применять с осторожностью), предшествующий прием некоторых лекарственных препаратов (миорелаксантов деполяризующего действия), спазм органов пищеварения, бронхиальная астма и стенокардия.
Принципиальное отличие в том, что аналог Прозерина положительно действует на нервную систему более длительное время — от пяти до десяти часов. Действие начинается через 30-60 минут после приема таблетки. Это делает препарат простым в применении и эффективным при лечении расстройств нервной системы.
Помните, что замену любых препаратов, назначенных лечащим врачом, следует производить только после консультации со специалистом. В некоторых случаях отсутствие одобрения врача относительно целесообразности использования определенных лекарств грозит серьезным ухудшением его здоровья.
«Армин»
Глазные капли «Армин» выпускаются во флаконах по 10 мл. В инструкции указано, что препарат является противоглаукомным средством, обладающим миотическим действием (т.е.сужающим зрачок). Это указывает на то, что Армин успешно применялся при глаукоме, атрофии зрительного нерва и повышенном внутриглазном давлении. Также препарат используется при диагностических и лечебных процедурах в офтальмологии.
Побочные действия возможны при передозировке или индивидуальной чувствительности к компонентам препарата.При использовании капель в соответствии с инструкцией и рекомендациями лечащего врача неприятные последствия возникают довольно редко. Однако может наблюдаться кратковременное раздражение слизистых оболочек глаз. Противопоказаниями к применению капель являются: гиперчувствительность, бронхиальная астма, склонность к возникновению судорожных припадков (эпилепсия), стенокардия, прогрессирующий атеросклероз.
 Дошло до того, что не могла нормально вставать с постели, с трудом передвигалась. Врачи посоветовали препарат Нейромидин. Цена, конечно большая, но препарат очень помог. Кололи внутримышечно. Что хочется выделить-так это быстродействие препарата и безболезненный укол.. Быстро ставит на ноги. Так же заметила улучшение памяти.
Дошло до того, что не могла нормально вставать с постели, с трудом передвигалась. Врачи посоветовали препарат Нейромидин. Цена, конечно большая, но препарат очень помог. Кололи внутримышечно. Что хочется выделить-так это быстродействие препарата и безболезненный укол.. Быстро ставит на ноги. Так же заметила улучшение памяти.
 Это самое сильное, безвредное и эффективное средство от угревой железницы. Правда, им одним для полного излечения от приставучего демодекоза все-таки отделаться не получится. Нужен комплекс мер, львиная доля которых приведена в статьях на этом сайте под тегом демодекоз.
Это самое сильное, безвредное и эффективное средство от угревой железницы. Правда, им одним для полного излечения от приставучего демодекоза все-таки отделаться не получится. Нужен комплекс мер, львиная доля которых приведена в статьях на этом сайте под тегом демодекоз. 

 Каждая таблетка содержит 20 мг активного вещества Нейромидина — ипидакрина гидрохлорид. Вспомогательные вещества — картофельный крахмал, моногидрат лактозы и стеарат кальция;
Каждая таблетка содержит 20 мг активного вещества Нейромидина — ипидакрина гидрохлорид. Вспомогательные вещества — картофельный крахмал, моногидрат лактозы и стеарат кальция;
 Дальнейшие инструкции). Проверьте ручку, чтобы убедиться, что жидкое лекарство прозрачное, бесцветное и не содержит частиц. Если нет, не используйте его.
Дальнейшие инструкции). Проверьте ручку, чтобы убедиться, что жидкое лекарство прозрачное, бесцветное и не содержит частиц. Если нет, не используйте его.