Клопидогрел в современной кардиологической практике – насущные проблемы и возможные решения | Добровольский А.В.
Введение
В последнее десятилетие клопидогрел стал одним из наиболее часто используемых врачами–кардиологами Западной Европы и Америки антитромботических препаратов. В целом ряде исследований была доказана высокая эффективность клопидогрела при нестабильной стенокардии и инфаркте миокарда (ИМ). Кроме того, клопидогрел существенно улучшил отдаленные результаты чрескожной коронарной ангиопластики и стентирования венечных сосудов. Наконец, накоплен положительный опыт применения этого препарата при заболеваниях, обусловленных атеросклерозом других локализаций (в частности, у пациентов с острой или хронической ишемией головного мозга, перемежающей хромотой и т.д.). В то же время можно с сожалением констатировать, что в нашей стране клопидогрел используется недостаточно широко, результаты его применения зачастую далеки от оптимальных, а для многих российских пациентов этот препарат в силу различных причин оказывается недоступным. Сложившаяся ситуация обусловлена не только наличием нерешенных концептуальных вопросов (к числу которых относится прежде всего отсутствие единого мнения о наиболее эффективных дозировках клопидогрела и оптимальной продолжительности его назначения), проблемой резистентности к антитромботической терапии и экономическими факторами, но также во многом связана с недостаточной осведомленностью практикующих врачей о результатах использования этого препарата при различных заболеваниях сердечно–сосудистой системы.
Сложившаяся ситуация обусловлена не только наличием нерешенных концептуальных вопросов (к числу которых относится прежде всего отсутствие единого мнения о наиболее эффективных дозировках клопидогрела и оптимальной продолжительности его назначения), проблемой резистентности к антитромботической терапии и экономическими факторами, но также во многом связана с недостаточной осведомленностью практикующих врачей о результатах использования этого препарата при различных заболеваниях сердечно–сосудистой системы.
В последнее десятилетие клопидогрел стал одним из наиболее часто используемых врачами–кардиологами Западной Европы и Америки антитромботических препаратов. В целом ряде исследований была доказана высокая эффективность клопидогрела при нестабильной стенокардии и инфаркте миокарда (ИМ). Кроме того, клопидогрел существенно улучшил отдаленные результаты чрескожной коронарной ангиопластики и стентирования венечных сосудов. Наконец, накоплен положительный опыт применения этого препарата при заболеваниях, обусловленных атеросклерозом других локализаций (в частности, у пациентов с острой или хронической ишемией головного мозга, перемежающей хромотой и т. д.). В то же время можно с сожалением констатировать, что в нашей стране клопидогрел используется недостаточно широко, результаты его применения зачастую далеки от оптимальных, а для многих российских пациентов этот препарат в силу различных причин оказывается недоступным. Сложившаяся ситуация обусловлена не только наличием нерешенных концептуальных вопросов (к числу которых относится прежде всего отсутствие единого мнения о наиболее эффективных дозировках клопидогрела и оптимальной продолжительности его назначения), проблемой резистентности к антитромботической терапии и экономическими факторами, но также во многом связана с недостаточной осведомленностью практикующих врачей о результатах использования этого препарата при различных заболеваниях сердечно–сосудистой системы.
д.). В то же время можно с сожалением констатировать, что в нашей стране клопидогрел используется недостаточно широко, результаты его применения зачастую далеки от оптимальных, а для многих российских пациентов этот препарат в силу различных причин оказывается недоступным. Сложившаяся ситуация обусловлена не только наличием нерешенных концептуальных вопросов (к числу которых относится прежде всего отсутствие единого мнения о наиболее эффективных дозировках клопидогрела и оптимальной продолжительности его назначения), проблемой резистентности к антитромботической терапии и экономическими факторами, но также во многом связана с недостаточной осведомленностью практикующих врачей о результатах использования этого препарата при различных заболеваниях сердечно–сосудистой системы.
Прежде чем приступить к рассмотрению проблем, возникающих при практическом применении клопидогрела, следует дать краткую характеристику этому препарату. Клопидогрел является производным тиенопиридина. Он селективно ингибирует связывание аденозиндифосфата (АДФ) с P2Y12 рецепторами на тромбоците, препятствует активации гликопротеинового рецепторного комплекса IIb/IIIa под действием АДФ и других агентов и таким образом снижает агрегационную способность тромбоцитов. Клопидогрел необратимо связывается с тромбоцитарными рецепторами к АДФ [1]. Соответственно, тромбоциты, подвергшиеся воздействию клопидогрела, остаются невосприимчивыми к стимуляции АДФ в течение всего срока их жизни (7–10 дней).
Клопидогрел необратимо связывается с тромбоцитарными рецепторами к АДФ [1]. Соответственно, тромбоциты, подвергшиеся воздействию клопидогрела, остаются невосприимчивыми к стимуляции АДФ в течение всего срока их жизни (7–10 дней).
Клопидогрел фармакологически неактивен. Его активный метаболит представляет собой тиольное производное, которое образуется путем двухэтапного окисления клопидогрела в гепатоцитах [2] и затем быстро связывается с тромбоцитарными P2Y12 аденозиновыми рецепторами. В превращении клопидогрела в активный метаболит участвуют различные печеночные изоферменты микросомального окисления (главным образом – цитохром CYP2C19). Как показали недавно проведенные исследования, генетический полиморфизм изофермента CYP2C19 может в определенной степени влиять на эффективность клопидогрела, однако выраженность такого влияния и его клиническое значение требуют дальнейшего изучения [3].
Значительное торможение тромбоцитарной агрегации наступает через 2 часа после приема препарата. Ингибирующий эффект в отношении тромбоцитов постепено усиливается и достигает максимума на 3–7–й день лечения [4]. При длительном (1 год и более) приеме клопидогрела его антиагрегантное действие не ослабевает [5,6]. При прекращении лечения агрегационная способность тромбоцитов постепенно возрастает и возвращается к исходному уровню в среднем через 7 дней после приема последней дозы клопидогрела [1]. Синдром отмены при прекращении терапии клопидогрелом не возникает [7].
Ингибирующий эффект в отношении тромбоцитов постепено усиливается и достигает максимума на 3–7–й день лечения [4]. При длительном (1 год и более) приеме клопидогрела его антиагрегантное действие не ослабевает [5,6]. При прекращении лечения агрегационная способность тромбоцитов постепенно возрастает и возвращается к исходному уровню в среднем через 7 дней после приема последней дозы клопидогрела [1]. Синдром отмены при прекращении терапии клопидогрелом не возникает [7].
Клопидогрел при ИМ с подъемом сегмента ST и остром коронарном синдроме без подъема сегмента ST
В целом ряде обсервационных и проспективных контролируемых исследований установлено, что при ИМ с подъемом сегмента ST клопидогрел, назначенный в первые часы заболевания, уменьшает количество ишемических осложнений и увеличивает выживаемость. Причем эффект препарата не зависел от того, проводились или нет реваскуляризирующие процедуры (системный тромболизис или чрескожные коронарные вмешательства) [8–12].
В многоцентровое клиническое испытание COMMIT–CCS–2 (Clopidogrel and Metoprolol in Myocardial Infarction Trial) были включены 45 852 пациента, госпитализированные с предварительным диагнозом ИМ (у 93% больных отмечался подъем сегмента ST или полная блокада левой ножки пучка Гиса). В первые 24 часа после начала заболевания назначалась терапия клопидогрелом 75 мг/сут. или плацебо; все пациенты также получали АСК в дозе 162 мг в сутки. В группах клопидогрела и плацебо частота комбинированной конечной точки (смерть + повторный ИМ + инсульт) составила соответственно 9,2 и 10,1%, (отн. риск 0,91; p=0,002). В группе клопидогрела также наблюдалось достоверное снижение общей смертности по сравнению с контрольной группой (соот¬ветственно 7,5 и 8,1%; р=0,03) без повышения риска кровотечений [13].
В первые 24 часа после начала заболевания назначалась терапия клопидогрелом 75 мг/сут. или плацебо; все пациенты также получали АСК в дозе 162 мг в сутки. В группах клопидогрела и плацебо частота комбинированной конечной точки (смерть + повторный ИМ + инсульт) составила соответственно 9,2 и 10,1%, (отн. риск 0,91; p=0,002). В группе клопидогрела также наблюдалось достоверное снижение общей смертности по сравнению с контрольной группой (соот¬ветственно 7,5 и 8,1%; р=0,03) без повышения риска кровотечений [13].
В исследование CLARITY–TIMI–28 (Clopidogrel as Adjunctive Reperfusion Therapy–Thrombolysis in Myocardial Infarction – 28) был включен 3491 больной ИМ с подъемом сегмента ST. Участникам исследования случайным образом назначалась терапия клопидогрелом (нагрузочная доза 300 мг, поддерживающая 75 мг/сут. в течение 4 недель) или плацебо. Все пациенты получали АСК, тромболитическую терапию и при необходимости – гепарин. Кроме того, участникам исследования выполнялась коронарная ангиография через 48–192 часа после начала исследования.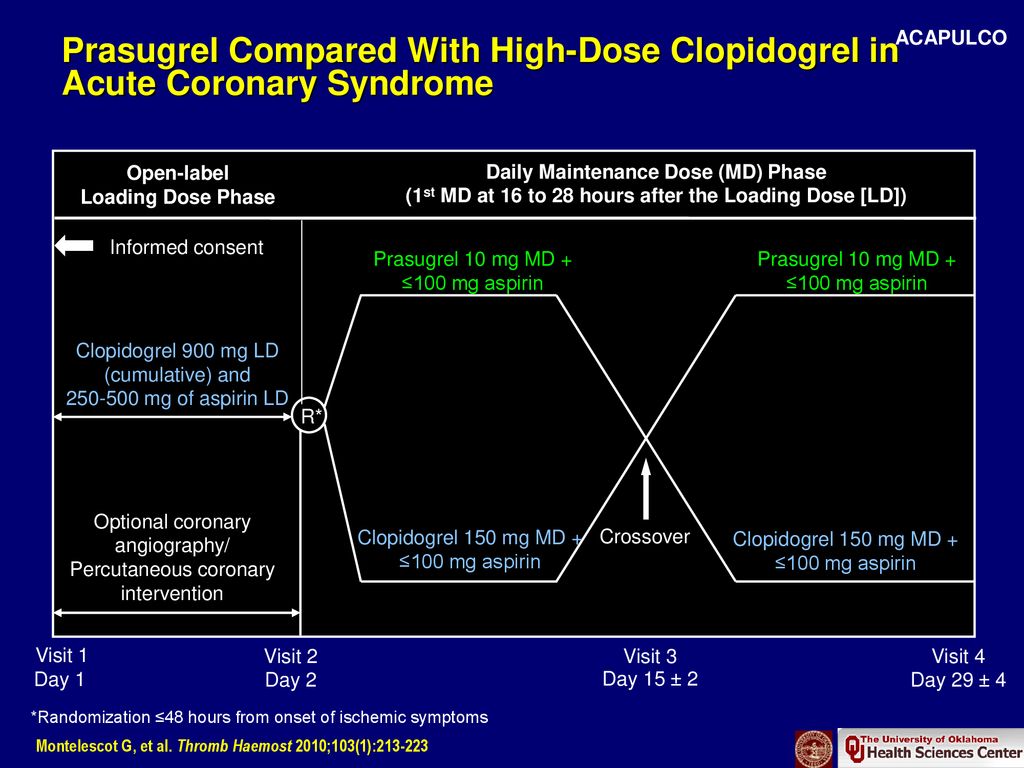 В группе клопидогрела первичная конечная точка (окклюзия ин¬фаркт–свя¬занной артерии + смерть + повторный ИМ до ангиографии) наблюдалась в 15%, а в группе плацебо – в 21,7% случаев (отн. риск 0,64; p
В группе клопидогрела первичная конечная точка (окклюзия ин¬фаркт–свя¬занной артерии + смерть + повторный ИМ до ангиографии) наблюдалась в 15%, а в группе плацебо – в 21,7% случаев (отн. риск 0,64; p
В крупном многоцентровом исследовании CURE (Clopidogrel in Unstable angina to prevent Recurrent Events) [15] участвовали 12 562 больных с острым коронарным синдромом без подъема сегмента ST. Пациентам случайным образом назначалась терапия клопидогрелом (нагрузочная доза 300 мг, поддерживающая доза 75 мг в сутки в течение 3–12 месяцев) или плацебо; все участники исследования принимали АСК. Терапия клопидогрелом и ацетилсалициловой кислотой (АСК) снизила риск развития первичных комбинированных конечных точек (сердечно–сосудистая смерть + ИМ + инсульт и сердечно–сосудистая смерть + ИМ + инсульт + рефрактерная ишемия миокарда) на 20% по сравнению с монотерапией АСК [16].
В заключение следует отметить, что согласно Рекомендациям Европейского общества кардиологов 2007 года [17] и Рекомендациям ВНОК 2006 года [18] клопидогрел в дозе 75 мг в сутки в течение 12 месяцев показан всем пациентам, перенесшим острый коронарный синдром без подъема сегмента ST и не имеющим высокого риска кровотечений, вне зависимости от того, проводились или нет реваскуляризирующие вмешательства в остром периоде заболевания. В соответствии с рекомендациями ВНОК 2007 года [19] комбинированная терапия клопидогрелом в дозе 75 мг в сутки АСК у больных ИМ с подъемом сегмента ST должна проводиться не менее 4 недель (желательно – в течение 12 месяцев) от начала заболевания вне зависимости от проведенного лечения в остром периоде. У пациентов, плохо отвечающих на клопидогрел, применение препарата в поддерживающей дозе 150 мг в сутки может обеспечить более выраженное антиагрегантное действие [20].
В соответствии с рекомендациями ВНОК 2007 года [19] комбинированная терапия клопидогрелом в дозе 75 мг в сутки АСК у больных ИМ с подъемом сегмента ST должна проводиться не менее 4 недель (желательно – в течение 12 месяцев) от начала заболевания вне зависимости от проведенного лечения в остром периоде. У пациентов, плохо отвечающих на клопидогрел, применение препарата в поддерживающей дозе 150 мг в сутки может обеспечить более выраженное антиагрегантное действие [20].
Клопидогрел при плановых
и экстренных чрескожных
реваскуляризующих вмешательствах
В других контролируемых исследованиях было продемонстрировано существенное улучшение кратко– и долгосрочных исходов экстренной коронарной реваскуляризации у пациентов с острыми коронарными синдромами [10]. Так, положительный эффект клопидогрела был отмечен у больных ИМ с подъемом сегмента ST, которым было выполнено ЧТКА и стентирование коронарной артерии [21]. В рандомизированном многоцентровом исследованим PCI–CLARITY (фрагмент более крупного исследования CLARITY–TIMI–28), были проанализированы исходы заболевания у 1863 пациентов после тромболитической терапии по поводу ИМ с подъемом сегмента ST. Одновременно с тромболизисом случайным образом назначался клопидогрел или плацебо; все пациенты также получали АСК. Коронарная ангиография выполнялась на 2–8–е сутки (в среднем – через 3,5 дня) после включения в исследование. Предварительная терапия клопидогрелом (нагрузочная доза 300 мг, поддерживающая доза 75 мг в сутки) достоверно снижала частоту первичной комбинированной конечной точки (сердечно–сосудистая смертность + рецидивирующий ИМ + ишемический инсульт) с момента проведения ЧТКА до 30–го дня после рандомизации (отношение рисков 0,54; р=0,008). Кроме того, лечение клопидогрелом ассоциировалось с меньшей частотой возникновения ИМ и инсультов до ЧТКА (отношение рисков 0,62; р=0,03). В целом терапия клопидогрелом по сравнению с плацебо значительно снижала частоту сердечно–сосудистой смертности, ИМ и инсультов в течение первых 30 дней с момента рандомизации (отношение рисков 0,59; p=0,001; число пациентов необходимое для предотвращения одного исхода = 23). Частота больших и малых кровотечений на фоне комбинированного лечения и монотерапии АСК оказалась сравнимой (2 и 1,9%; р>0,99) [22].
Одновременно с тромболизисом случайным образом назначался клопидогрел или плацебо; все пациенты также получали АСК. Коронарная ангиография выполнялась на 2–8–е сутки (в среднем – через 3,5 дня) после включения в исследование. Предварительная терапия клопидогрелом (нагрузочная доза 300 мг, поддерживающая доза 75 мг в сутки) достоверно снижала частоту первичной комбинированной конечной точки (сердечно–сосудистая смертность + рецидивирующий ИМ + ишемический инсульт) с момента проведения ЧТКА до 30–го дня после рандомизации (отношение рисков 0,54; р=0,008). Кроме того, лечение клопидогрелом ассоциировалось с меньшей частотой возникновения ИМ и инсультов до ЧТКА (отношение рисков 0,62; р=0,03). В целом терапия клопидогрелом по сравнению с плацебо значительно снижала частоту сердечно–сосудистой смертности, ИМ и инсультов в течение первых 30 дней с момента рандомизации (отношение рисков 0,59; p=0,001; число пациентов необходимое для предотвращения одного исхода = 23). Частота больших и малых кровотечений на фоне комбинированного лечения и монотерапии АСК оказалась сравнимой (2 и 1,9%; р>0,99) [22].
В исследование PCI–CURE были включены 2658 пациентов с острым коронарным синдромом без подъема сегмента ST. Все пациенты получали АСК. Частота первичной конечной точки (сердечно–сосудистой смерти, ИМ и потребности в повторной экстренной ангиопластике в течение первых 30 дней после ЧТКА) составила 4,5% в группе комбинированной терапии и 6,4% в группе пациентов, получавших только ацетилсалиловую кислоту (относительный риск 0,70; p=0,03). Длительное (в течение 12 месяцев) применение клопидогрела после ЧТКА привело к снижению относительного риска смерти и ИМ на 25% (соответственно р=0,03 и p=0,047) [23].
Эффективность клопидогрела при плановых (elective) реваскуляризирующих вмешательствах у больных хронической ИБС была изучена в многоцентровом клиническом испытании CREDO (Clopidogrel for the Reduction of Events During Observation). В него вошли 2116 пациентов, нуждавшихся в проведении плановой коронарной реваскуляризации и получавших АСК. За 3–24 часа до ЧТКА пациентам случайным образом назначалcя клопидогрел 300 мг или плацебо. После вмешательства все пациенты получали клопидогрел 75 мг в сутки в течение 28 дней. Затем участники основной группы продолжали прием препарата в течение 12 месяцев после вмешательства, а пациенты контрольной группы принимали плацебо. Частота первичной комбинированной конечной точки (общая смертность + ИМ + инсульт) на фоне терапии клопидогрелом в течение года снижалась на 26,9% (снижение абсолютного риска на 3%; р=0,02). В целом по выборке прием клопидогрела перед реваскуляризацией снижал комбинированный риск смерти, ИМ или экстренной повторной реваскуляризации целевой коронарной артерии в течение первых 28 дней исследования на 18,5% (статистически недостоверно) Однако у лиц, получивших клопидогрел за 6 и более часов до ЧТКА и стентирования, уменьшение частоты развития указанных событий почти достигало уровня статистической значимости (снижение риска на 38,6%; р = 0,051) [24].
После вмешательства все пациенты получали клопидогрел 75 мг в сутки в течение 28 дней. Затем участники основной группы продолжали прием препарата в течение 12 месяцев после вмешательства, а пациенты контрольной группы принимали плацебо. Частота первичной комбинированной конечной точки (общая смертность + ИМ + инсульт) на фоне терапии клопидогрелом в течение года снижалась на 26,9% (снижение абсолютного риска на 3%; р=0,02). В целом по выборке прием клопидогрела перед реваскуляризацией снижал комбинированный риск смерти, ИМ или экстренной повторной реваскуляризации целевой коронарной артерии в течение первых 28 дней исследования на 18,5% (статистически недостоверно) Однако у лиц, получивших клопидогрел за 6 и более часов до ЧТКА и стентирования, уменьшение частоты развития указанных событий почти достигало уровня статистической значимости (снижение риска на 38,6%; р = 0,051) [24].
Результаты указанных исследований, а также ряда других клинических испытаний легли в основу Рекомендаций Американской коллегии кардиологов и Американской ассоциации сердца по чрескожным коронарным инвазивным вмешательствам 2005 года [25] (которые затем были воспроизведены в Дополнении к указанным рекомендациям 2007 года [26]), а также в Рекомендациях Европейского кардиологического общества по чрескожным коронарным вмешательствам 2005 года [27] и в опубликованных в 2010 году Рекомендациях по миокардиальной реваскуляризации [28]. Согласно указанным рекомендациям в случае плановой реваскуляризации клопидогрел в нагрузочной дозе 300 мг должен быть принят не менее чем за 6 часов (в идеале – за 24 часа) до процедуры. Если это невозможно, то нагрузочная доза 600 мг должна быть принята не менее чем за 2 часа до вмешательства [27]. Однако вопрос об оптимальной нагрузочной дозе до конца не решен. Многие авторы указывают, что стандартная нагрузочная доза клопидогрела (300 мг) не вызывает существенного дополнительного угнетения агрегационной способности тромбоцитов у больных стабильной ИБС, ранее получавших АСК [29–31]. В то же время увеличение нагрузочной дозы клопидогрела до 600–900 мг позволяет значимо подавить агрегацию тромбоцитов [32] (в том числе у лиц, ранее длительно принимавших клопидогрел [33]) и достоверно снижает частоту неблагоприятных коронарных событий после инвазивных процедур [34–38]. Эти данные нашли частичное отражение в Европейских рекомендациях 2010 года, которые предписывают возможно более раннее назначение клопидогрела в нагрузочной дозе 600 мг перед экстренной реваскуляризацией при ИМ с подъемом сегмента ST и при остром коронарном синдроме без подъема сегмента ST рекомендуется [28].
Согласно указанным рекомендациям в случае плановой реваскуляризации клопидогрел в нагрузочной дозе 300 мг должен быть принят не менее чем за 6 часов (в идеале – за 24 часа) до процедуры. Если это невозможно, то нагрузочная доза 600 мг должна быть принята не менее чем за 2 часа до вмешательства [27]. Однако вопрос об оптимальной нагрузочной дозе до конца не решен. Многие авторы указывают, что стандартная нагрузочная доза клопидогрела (300 мг) не вызывает существенного дополнительного угнетения агрегационной способности тромбоцитов у больных стабильной ИБС, ранее получавших АСК [29–31]. В то же время увеличение нагрузочной дозы клопидогрела до 600–900 мг позволяет значимо подавить агрегацию тромбоцитов [32] (в том числе у лиц, ранее длительно принимавших клопидогрел [33]) и достоверно снижает частоту неблагоприятных коронарных событий после инвазивных процедур [34–38]. Эти данные нашли частичное отражение в Европейских рекомендациях 2010 года, которые предписывают возможно более раннее назначение клопидогрела в нагрузочной дозе 600 мг перед экстренной реваскуляризацией при ИМ с подъемом сегмента ST и при остром коронарном синдроме без подъема сегмента ST рекомендуется [28]. Однако окончательно этот вопрос, по–видимому, будет разрешен после публикации результатов текущих клинических испытаний (в частности, исследований CURRENT–OASIS–7 [39] и CIPAMI [40]).
Однако окончательно этот вопрос, по–видимому, будет разрешен после публикации результатов текущих клинических испытаний (в частности, исследований CURRENT–OASIS–7 [39] и CIPAMI [40]).
В соответствии с международными рекомендациями после имплантации металлического (непокрытого) стента следует продолжать прием клопидогрела в дозе 75 мг в сут. в сочетании с АСК в течение месяца (желательно – в течение 12 месяцев) после процедуры. Если пациенту был имплантирован стент с лекарственным покрытием, то клопидогрел в дозе 75 мг в сут. (вместе с АСК) следует принимать в течение 12 месяцев. [25,26,28]. Однако вопрос об оптимальной поддерживающей дозе клопидогрела после реваскуляризации также остается открытым. По данным ряда краткосрочных исследований, прием препарата в дозе 150 мг/сут. обеспечивает лучший антиагрегантный эффект по сравнению с его стандартной поддерживающей дозировкой 75 мг/сут. (в том числе у пациентов с доказанной резистентностью к препарату) [41–42]) а также предотвращает тромбозы стента и развитие сердечно–сосудистых событий [43].
Предметом дискуссии является и проблема оптимальной продолжительности приема клопидогрела после ангиопластики и стентирования венечных артерий. Так, по данным некоторых авторов, более продолжительный (чем рекомендуется) прием клопидогрела может уменьшить частоту сердечно–сосудистых событий и смертность в отдаленном периоде после имплантации металлических стентов [44] и стентов с лекарственным покрытием [45]. Однако в более поздних исследованиях преимущества применения двойной антитромботической терапии более 12 месяцев после имплантации сиентов с лекарственным покрытием не получили подтверждения [46,47]. По мнению некоторых авторов, оптимальная длительность терапии клопидогрелом находится в пределах от 6 до 12 месяцев после стентирования [48] и должна быть определена в дополнительных рандомизированных проспективных исследованиях.
Применение клопидогрела
для вторичной профилактики
сердечно–сосудистых событий
у пациентов с сосудистым
атеросклерозом различной
локализации
В исследовании CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischaemic Events) было показано, что у больных с тяжелым атеросклеротическим поражением артерий (облитерирующий атеросклероз сосудов ног или недавно перенесенный инфаркт миокарда или недавний инсульт) длительная монотерапия клопидогрелом снижает риск развития комбинированной конечной точки (сердечно–сосудистая смерть + ИМ + инсульт) на 8,7% (р=0,043) по сравнению с приемом АСК [49]. По данным исследования CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance) двойная антитромботическая терапия снижает смертность в группе больных, перенесших ИМ, инсульт или страдающих атеросклерозом сосудов ног, однако повышает риск смерти у бессимптомных пациентов с факторами риска атеротромбоза [50,51].
По данным исследования CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance) двойная антитромботическая терапия снижает смертность в группе больных, перенесших ИМ, инсульт или страдающих атеросклерозом сосудов ног, однако повышает риск смерти у бессимптомных пациентов с факторами риска атеротромбоза [50,51].
Проведенные исследования показали, что клопидогрел не менее эффективно, чем АСК, предотвращает развитие повторных ишемических инсультов у пациентов с высоким сосудистым риском [52]. Согласно другим данным клопидогрел (в виде монотерапии) более эффективен в плане профилактики повторных нарушений мозгового кровообращения, чем АСК, однако существенно уступает комбинированной терапии АСК и дипиридамолом [53,54]. Наконец, было доказано, что клопидогрел предотвращает возникновение сосудистых событий у больных с атеросклеротическим поражением артерий нижних конечностей и перемежающей хромотой [55,56].
Геморрагические осложнения
Как показали проведенные исследования, при монотерапии клопидогрелом частота кровотечений составляет 0,52% [57]. На фоне двойной антитромботической терапии (клопидогрел + АСК) тяжелые кровотечения развиваются в 1,6–1,7% случаев [58,59]. Риск геморрагических осложнений возрастает при длительном применении клопидогрела и при его сочетании с антикоагулянтами непрямого действия [60,61]. Для уменьшения риска кровотечений рекомендуется по мере возможности избегать длительного использования клопидогрела (особенно в сочетании с иными антитромботиками).
На фоне двойной антитромботической терапии (клопидогрел + АСК) тяжелые кровотечения развиваются в 1,6–1,7% случаев [58,59]. Риск геморрагических осложнений возрастает при длительном применении клопидогрела и при его сочетании с антикоагулянтами непрямого действия [60,61]. Для уменьшения риска кровотечений рекомендуется по мере возможности избегать длительного использования клопидогрела (особенно в сочетании с иными антитромботиками).
Резистентность к клопидогрелу
У некоторых пациентов повышенная активность тромбоцитов сохраняется, несмотря на прием клопидогрела как в виде монотерапии, так и в сочетании с АСК. Как показывают обсервационные исследования, неоптимальное антиагрегантное действие монотерапии клопидогрелом у больных ИБС отмечается в 15–30% случаев (в среднем у 21% пациентов) [5,62]. Наиболее часто неадекватная реакция на клопидогрел отмечается при сахарном диабете 2 типа [63]. Резистентность к двойной антиагрегантной терапии (клопидогрел + АСК) встречается реже (примерно в 6% случаев [64]).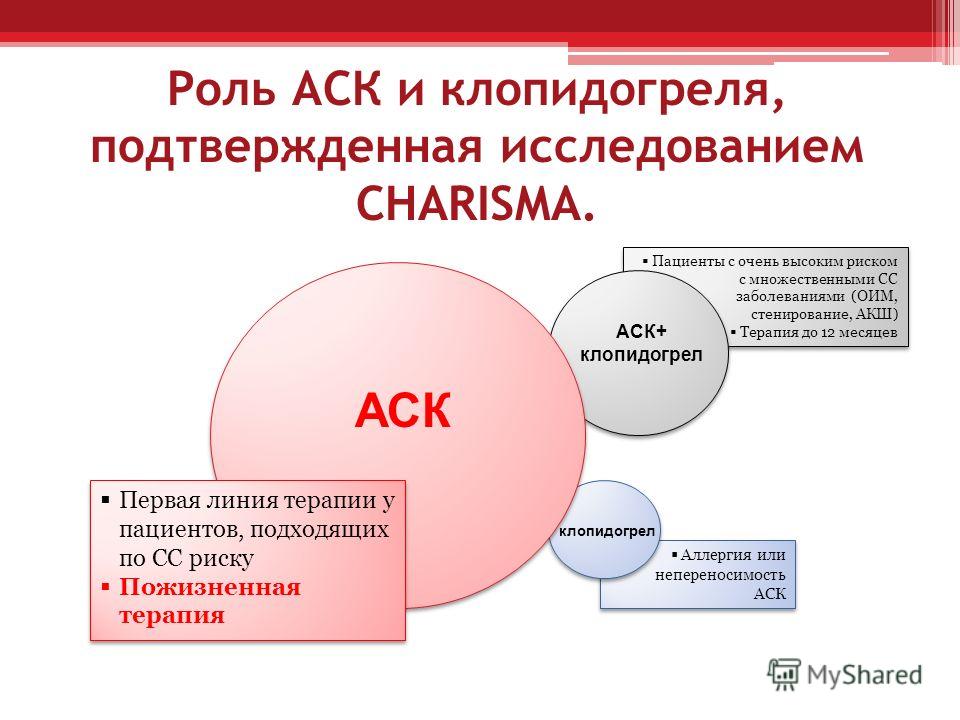
Особую остроту проблема резистентности к лечению приобретает у пациентов, перенесших ангиопластику и стентирование коронарных артерий. Показано, что низкая реакция на клопидогрел ассоциируется с повышенным риском острого и подострого тромбоза стента в ранние (первые 30 суток) и поздние сроки после вмешательства, а также с увеличением сердечно–сосудистой смертности [64–66]. В качестве возможных причин резистентности к клопидогрелу указываются применение недостаточных доз препарата, лекарственные взаимодействия [67], а также генетически детерминированные различия активности циклооксигеназы, рецепторного аппарата тромбоцитов и печеночных ферментов микросомального окисления, ответственных за выведение препарата из организма [68,69].
В настоящее время отсутствуют рекомендации по преодолению резистентности к антитромботической терапии, базирующиеся на результатах контролируемых исследований. В качестве профилактической меры чаще всего предлагается использование повышенной нагрузочной дозы клопидогрела перед инвазивным вмешательством1 [62,70]. Другие исследователи для преодоления резистентности рекомендуют повысить поддерживающую дозу клопидогрела c 75 до 150 мг в сутки [73,74].
Другие исследователи для преодоления резистентности рекомендуют повысить поддерживающую дозу клопидогрела c 75 до 150 мг в сутки [73,74].
Фармакоэкономические аспекты
Известно, что тщательное соблюдение международных рекомендаций по медикаментозной терапии у больных ИБС ассоциируется с более благоприятным течением заболевания и лучшим прогнозом [75]. Однако в реальности даже в странах Европы оптимальную терапию получают менее половины нуждающихся в ней пациентов [76]. Существенным фактором, влияющим на доступность лечения, является его высокая стоимость. Одним из способов решения этой проблемы является производство генерических лекарственных средств. В последние годы генерические препараты клопидогрела были созданы и апробированы во многих странах [77–80]. Недавно на отечественном фармацевтическом рынке появился препарат Листаб 75 производства компании Сотекс. Активная субстанция производится компанией Replekpharm AD (Скопье, Македония) в соответствии со стандартами GMP [81].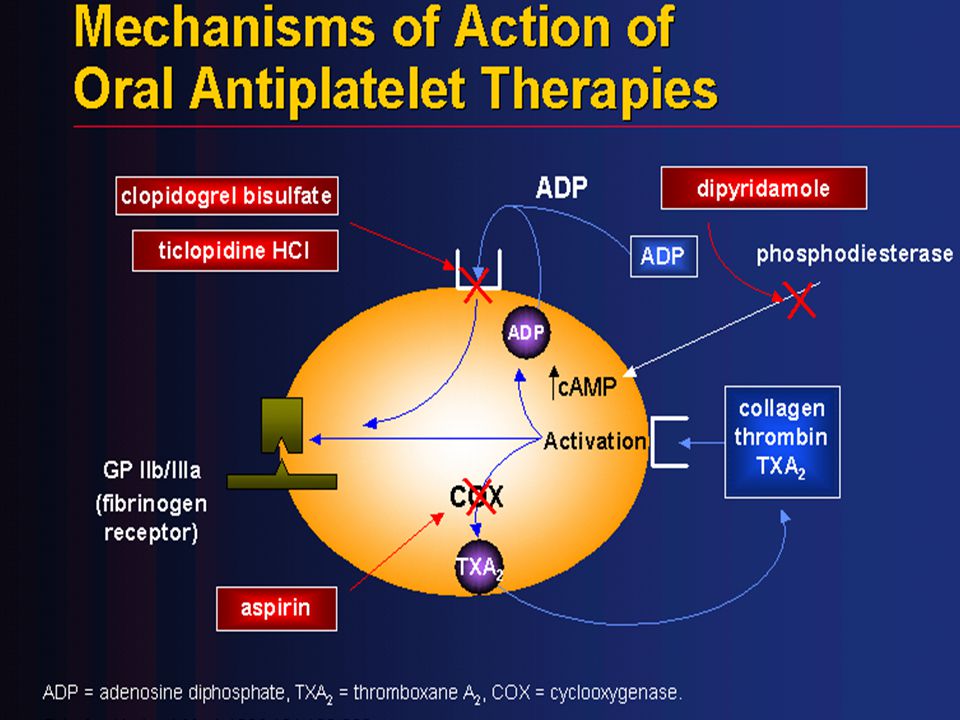 Биоэквивалентность Листаба 75 оригинальному клопидогрелу была доказана в двух небольших (24 и 40 пациентов соответственно) рандомизированных одноцентровых перекрестных клинических испытаниях, проведенных в Румынии [82] и Македонии [83]. В ходе второго исследования были также доказаны высокая эффективность, хорошая переносимость и безопасность Листаба 75 у больных в остром периоде ИМ. Таким образом, можно надеяться, что появление на российском фармацевтическом рынке доступного по цене препарата европейского качества с доказанной эффективностью и безопасностью сделает возможным проведение адекватной антитромбоцитарной терапии у всех больных, которые в ней нуждаются.
Биоэквивалентность Листаба 75 оригинальному клопидогрелу была доказана в двух небольших (24 и 40 пациентов соответственно) рандомизированных одноцентровых перекрестных клинических испытаниях, проведенных в Румынии [82] и Македонии [83]. В ходе второго исследования были также доказаны высокая эффективность, хорошая переносимость и безопасность Листаба 75 у больных в остром периоде ИМ. Таким образом, можно надеяться, что появление на российском фармацевтическом рынке доступного по цене препарата европейского качества с доказанной эффективностью и безопасностью сделает возможным проведение адекватной антитромбоцитарной терапии у всех больных, которые в ней нуждаются.
1 В некоторых исследованиях нагрузочные дозы клопидогрела
достигали 1200–2400 мг [71,72], что, однако, не сопровожда-
лось тяжелыми геморрагическими осложнениями
Литература
1. Weber A.A., Braun M., Hohlfeld T., et al. Recovery of platelet function after discontinuation of clopidogrel treatment in healthy volunteers. Br J Clin Pharmacol. 2001;52(3):333–6.
Br J Clin Pharmacol. 2001;52(3):333–6.
2. Savi P., Combalbert J., Gaich C., et al. The antiaggregating activity of clopidogrel is due to a metabolic activation by the hepatic cytochrome P450–1A. Thromb Haemost. 1994;72(2):313–7.
3. ACCF/AHA Clopidogrel Clinical Alert: Approaches to the FDA “Boxed Warning”. A Report of the American College of Cardiology Foundation Task Force on Clinical Expert Consensus Documents and the American Heart Association. Circulation. 2010;122;537–557.
4. http://www.rlsnet.ru/mnn_index_id_2533.htm
5. Saw J., Madsen E.H., Chan S., et al. The ELAPSE (Evaluation of Long–Term Clopidogrel Antiplatelet and Systemic Anti–Inflammatory Effects) study. J Am Coll Cardiol. 2008;52(23):1826–33.
6. Helgason C.M., Grossi E., Pandey D., et al. Platelet aggregation and recruitment with aspirin–clopidogrel therapy. Cerebrovasc Dis. 2008; 25(5):392–400.
7. Sibbing D., Stegherr J., Braun S., et al. A double–blind, randomized study on prevention and existence of a rebound phenomenon of platelets after cessation of clopidogrel treatment. J Am Coll Cardiol. 2010;55(6):558–65.
J Am Coll Cardiol. 2010;55(6):558–65.
8. Сулимов В.А., Малова Е.В., Сыркин А.Л., и др. Эффективность и безопасность клопидогрела бисульфата в комплексной терапии пациентов с острым коронарным синдромом с подъемом сегмента ST. Кардиология. 2006; 46(7):26–32.
9. Alexander D., Ou F.S., Roe M.T., et al. Use of and inhospital outcomes after early clopidogrel therapy in patients not undergoing an early invasive strategy for treatment of non–ST–segment elevation myocardial infarction: results from Can Rapid risk stratification of Unstable angina patients Suppress ADverse outcomes with Early implementation of the American College of Cardiology/American Heart Association guidelines (CRUSADE). Am Heart J. 2008;156(3):606–12.
10. Bowry A.D., Brookhart M.A., Choudhry N.K. Meta–analysis of the efficacy and safety of clopidogrel plus aspirin as compared to antiplatelet monotherapy for the prevention of vascular events.Am J Cardiol. 2008;101(7):960–6.
11. Dogan A. , Ozgul M., Ozaydin M., et al. Effect of clopidogrel plus aspirin on tissue perfusion and coronary flow in patients with ST–segment elevation myocardial infarction: a new reperfusion strategy. Am Heart J. 2005;149(6):1037–42.
, Ozgul M., Ozaydin M., et al. Effect of clopidogrel plus aspirin on tissue perfusion and coronary flow in patients with ST–segment elevation myocardial infarction: a new reperfusion strategy. Am Heart J. 2005;149(6):1037–42.
12. Zeymer U., Gitt A.K., Junger C., et al.; Acute COronary Syndromes (ACOS) registry investigators. Effect of clopidogrel on 1–year mortality in hospital survivors of acute ST–segment elevation myocardial infarction in clinical practice. Eur Heart J. 2006;27(22):2661–6.
13. Chen Z.M., Jiang L.X., Chen Y.P., et al. COMMIT (Clopidogrel and Metoprolol in Myocardial Infarction Trial) collaborative group. Addition of clopidogrel to aspirin in 45,852 patients with acute myocardial infarction: randomised placebocontrolled trial. Lancet. 2005;366:1607–1621.
14. Sabatine M.S., Cannon C.P., Gibson C.M., et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with STsegment elevation. N Engl J Med., 2005; 352:1179–1189.
15. Mehta S.R., Yusuf S. Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) Study Investigators. The Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) trial programme; rationale, design and baseline characteristics including a meta–analysis of the effects of thienopyridines in vascular disease. Eur Heart J. 2000;21(24):2033–41.
16. Budaj A., Yusuf S., Mehta S.R., et al; Clopidogrel in Unstable angina to prevent Recurrent Events (CURE) Trial Investigators. Benefit of clopidogrel in patients with acute coronary syndromes without ST–segment elevation in various risk groups. Circulation. 2002; 106(13):1622–6.
17. Guidelines for the diagnosis and treatment of non–ST–segment elevation acute coronary syndromes The Task Force for the Diagnosis and Treatment of Non–ST–Segment Elevation Acute Coronary Syndromes of the European Society of Cardiology. Eur Heart J. 2007; 28: 1598–1660. Available at: www.escardio.org.
18. Лечение острого коронарного синдрома без стойкого подъема сегмента ST на ЭКГ. Кардиоваскулярная терапия и профилактика 2006; 8(5):Приложение 1.
19. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST на ЭКГ. Кардиоваскулярная терапия и профилактика 2007; 6(8):Приложение 1.
20. Palmerini T., Barozzi C., Tomasi L., et al. A randomised study comparing the antiplatelet and antiinflammatory effect of clopidogrel 150 mg/day versus 75 mg/day in patients with ST–segment elevation acute myocardial infarction and poor responsiveness to clopidogrel: results from the DOUBLE study. Thromb Res. 2010;125(4):309–14. Epub 2009 Jul 14.
21. Vlaar P.J., Svilaas T., Damman K., et al. Impact of pretreatment with clopidogrel on initial patency and outcome in patients treated with primary percutaneous coronary intervention for ST–segment elevation myocardial infarction: a systematic review. Circulation. 200;118(18):1828–36.
22. Sabatine M.S., Cannon C.P., Gibson C.M., et al.; Clopidogrel as Adjunctive Reperfusion Therapy (CLARITY)–Thrombolysis in Myocardial TIMI) 28 Investigators. Effect of clopidogrel pretreatment before percutaneous coronary intervention in patients with ST–elevation myocardial infarction treated with fibrinolytics: the PCI–CLARITY study. JAMA. 2005 Sep 14;294(10):1224–32
23. Mehta S.R., Yusuf S., Peters R.J., et al.; Clopidogrel in Unstable angina to prevent Recurrent Events trial (CURE) Investigators. Effects of pretreatment with clopidogrel and aspirin followed by long–term therapy in patients undergoing percutaneous coronary intervention: the PCI–CURE study. Lancet. 2001;358(9281):527–33.
24. Steinhubl S.R., Berger P.B., Mann J.T. 3rd, et al.; CREDO Investigators. Clopidogrel for the Reduction of Events During Observation. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA. 2002;288(19):2411–20.
25. Smith S.C. Jr., Feldman T.E., Hirshfeld J.W. Jr., et al. ACC/AHA/SCAI 2005 guideline update for percutaneous coronary intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/SCAI Writing Committee to Update 2001 Guidelines for Percutaneous Coronary Intervention). Circulation. 2006;113(7): e166–286.
26. King S.B. 3rd, Smith S.C. Jr,, Hirshfeld J.W. Jr,, et al. 2007 focused update of the ACC/AHA/SCAI 2005 guideline update for percutaneous coronary intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice guidelines. J Am Coll Cardiol. 2008; 51(2):172–209.
27. Guidelines for Percutaneous Coronary Interventions. The Task Force for Percutaneous Coronary Interventions of the European Society of Cardiology. Eur Heart J. 2005; 26: 804–847. Available at: www.escardio.org.
28. Guidelines on myocardial revascularization. The Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio–Thoracic Surgery (EACTS) Eur Heart J. 2010 doi:10.1093/eurheartj/ehq277. Available at: www.escardio.org.
29. Weltermann A., Fritsch P., Kyrle P.A., et al. Effects of pretreatment with clopidogrel on platelet and coagulation activation in patients undergoing elective coronary stenting. Thromb Res. 2003;112(1–2):19–24
30. Gurbel P.A., Bliden K.P., Hiatt B.L., et al. Clopidogrel for coronary stenting: response variability, drug resistance, and the effect of pretreatment platelet reactivity. Circulation. 2003; 107(23): 2908–13.
31. Gurbel P.A., Samara W.M., Bliden K.P. Failure of clopidogrel to reduce platelet reactivity and activation following standard dosing in elective stenting: implications for thrombotic events and restenosis. Platelets. 2004; 15(2): 95–9.
32. L’Allier P.L., Ducrocq G., Pranno N., et al; PREPAIR Study Investigators. Clopidogrel 600–mg double loading dose achieves stronger platelet inhibition than conventional regimens: results from the PREPAIR randomized study. J Am Coll Cardiol. 2008;51(11):1066–72.
33. Collet J.P., Silvain J., Landivier A., et al. Dose effect of clopidogrel reloading in patients already on 75–mg maintenance dose: the Reload with Clopidogrel Before Coronary Angioplasty in Subjects Treated Long Term with Dual Antiplatelet Therapy (RELOAD) study. Circulation. 2008;118(12):1225–33.
34. Abuzahra M., Pillai M., Caldera A., et al. Comparison of higher clopidogrel loading and maintenance dose to standard dose on platelet function and outcomes after percutaneous coronary intervention using drug–eluting stents. Am J Cardiol. 2008; 102(4):401–3.
35. Cuisset T., Frere C., Quilici J., et al. Benefit of a 600–mg loading dose of clopidogrel on platelet reactivity and clinical outcomes in patients with non–ST–segment elevation acute coronary syndrome undergoing coronary stenting. J Am Coll Cardiol. 2006; 48(7): 1339–45.
36. Dangas G., Mehran R., Guagliumi G., et al. Role of clopidogrel loading dose in patients with ST–segment elevation myocardial infarction undergoing primary angioplasty: results from the HORIZONS–AMI (harmonizing outcomes with revascularization and stents in acute myocardial infarction) trial. J Am Coll Cardiol. 2009; 54(15):1438–46.
37. Lotrionte M., Biondi–Zoccai G.G., Agostoni P., et al. Meta–analysis appraising high clopidogrel loading in patients undergoing percutaneous coronary intervention. Am J Cardiol. 2007;100(8):1199–206.
38. Patti G., Colonna G., Pasceri V., et al. Randomized trial of high loading dose of clopidogrel for reduction of periprocedural myocardial infarction in patients undergoing coronary intervention: results from the ARMYDA–2 (Antiplatelet therapy for Reduction of MYocardial Damage during Angioplasty) study. Circulation. 2005;111(16):2099–106.
39. Mehta S.R., Bassand J.P., Chrolavicius S, et al. Design and rationale of CURRENT–OASIS 7: a randomized, 2 x 2 factorial trial evaluating optimal dosing strategies for clopidogrel and aspirin in patients with ST and non–ST–elevation acute coronary syndromes managed with an early invasive strategy. Am Heart J. 2008;156(6):1080–1088.e1/
40. Zeymer U., Arntz H.R., Darius H., et al. Efficacy and safety of clopidogrel 600 mg administered pre–hospitally to improve primary percutaneous coronary intervention in patients with acute myocardial infarction (CIPAMI): study rationale and design. Cardiology. 2007;108(4):265–72.
41. von Beckerath N., Kastrati A., Wieczorek A., et al. A double–blind, randomized study on platelet aggregation in patients treated with a daily dose of 150 or 75 mg of clopidogrel for 30 days. Eur Heart J. 2007;28(15):1814–9.
42. Aleil B., Jacquemin L., De Poli F., et al. Clopidogrel 150 mg/day to overcome low responsiveness in patients undergoing elective percutaneous coronary intervention: results from the VASP–02 (Vasodilator–Stimulated Phosphoprotein–02) randomized study. JACC Cardiovasc Interv. 2008;1(6):631–8.
43. Tavassoli N., Voisin S., Carrie D., et al. High maintenance dosage of clopidogrel is associated with a reduced risk of stent thrombosis in clopidogrel–resistant patients. Am J Cardiovasc Drugs. 2010;10(1):29–35.
44. Bernardi V., Szarfer J., Summay G,. et al. Long–term versus short–term clopidogrel therapy in patients undergoing coronary stenting (from the Randomized Argentine Clopidogrel Stent [RACS] trial). Am J Cardiol. 2007;99(3):349–52.
45. Banerjee S., Varghese C., Samuel J., et al. Comparison of the impact of short (<1 year) and long–term (> or =1 year) clopidogrel use following percutaneous coronary intervention on mortality. Am J Cardiol. 2008;102(9): 1159–62.
46. Park S.J., Park D.W., Kim Y.H., et al. Duration of dual antiplatelet therapy after implantation of drug–eluting stents. Engl J Med. 2010;362(15):1374–82. Epub 2010 Mar 15.
47. Schulz S., Schuster T., Mehilli J., et al. Stent thrombosis after drug–eluting stent implantation: incidence, timing, and relation to discontinuation of clopidogrel therapy over a 4–year period. Eur Heart J. 2009;30(22):2714–21. Epub 2009 Jul 11.
48. Roy P., Bonello L., Torguson R., et al. Temporal relation between Clopidogrel cessation and stent thrombosis after drug–eluting stent implantation. Am J Cardiol. 2009;103(6):801–5. Epub 2009 Jan 24.
49. Harker L.A., Boissel J.P., Pilgrim A.J., et al. Comparative safety and tolerability of clopidogrel and aspirin: results from CAPRIE. CAPRIE Steering Committee and Investigators. Clopidogrel versus aspirin in patients at risk of ischaemic events. Drug Saf. 1999;21(4):325–35.
50. Bhatt D.L., Flather M.D., Hacke W., et al.; CHARISMA Investigators. Patients with prior myocardial infarction, stroke, or symptomatic peripheral arterial disease in the CHARISMA trial. J Am Coll Cardiol. 2007;49(19):1982–8.
51. Wang T.H., Bhatt D.L., Fox K.A., et al.; CHARISMA Investigators. An analysis of mortality rates with dual–antiplatelet therapy in the primary prevention population of the CHARISMA trial. Eur Heart J. 2007;28(18):2200–7.
52. Sudlow C.L., Mason G., Maurice J.B., et al. Thienopyridine derivatives versus aspirin for preventing stroke and other serious vascular events in high vascular risk patients. Cochrane Database Syst Rev. 2009 (4):CD001246.
53. Hankey G.J. Antiplatelet therapy for the prevention of recurrent stroke and other serious vascular events: a review of the clinical trial data and guidelines. Curr Med Res Opin. 2007; 23(6):1453–62.
54. Diener H.C., Sacco R.L., Yusuf S., et al.; Prevention Regimen for Effectively Avoiding Second Strokes (PRoFESS) study group.Effects of aspirin plus extended–release dipyridamole versus clopidogrel and telmisartan on disability and cognitive function after recurrent stroke in patients with ischaemic stroke in the Prevention Regimen for Effectively Avoiding Second Strokes (PRoFESS) trial: a double–blind, active and placebo–controlled study. Lancet Neurol. 2008; 7(10):875–84.
55. Robless P., Mikhailidis D.P., Stansby G. Systematic review of antiplatelet therapy for the prevention of myocardial infarction, stroke or vascular death in patients with peripheral vascular disease. Br J Surg. 2001;88(6):787–800.
56. Girolami B., Bernardi E., Prins M.H., et al. Antithrombotic drugs in the primary medical management of intermittent claudication: a meta–analysis. Thromb Haemost. 1999;81(5):715–22.
57. Bhatt D.L., Hirsch A.T., Ringleb P.A., et al. Reduction in the need for hospitalization for recurrent ischemic events and bleeding with clopidogrel instead of aspirin. CAPRIE investigators. Am Heart J. 2000;140:67–73.
58. Berger P.B., Bhatt D.L., Fuster V., et al. Bleeding complications with dual antiplatelet therapy among patients with stable vascular disease or risk factors for vascular disease: results from the Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management, and Avoidance (CHARISMA) trial. Circulation. 2010;121(23):2575–83. Epub 2010 Jun 1
59. Helton T.J., Bavry A.A., Kumbhani D.J., et al. Incremental effect of clopidogrel on important outcomes in patients with cardiovascular disease: a meta–analysis of randomized trials. Am J Cardiovasc Drugs. 2007;7(4):289–97.
60. Eikelboom J.W., Hirsh J. Combined antiplatelet and anticoagulant therapy: clinical benefits and risks. J Thromb Haemost. 2007; 5(suppl 1):255– 63.
61. Hermosillo A.J., Spinler S.A. Aspirin, clopidogrel, and warfarin: is the combination appropriate and effective or inappropriate and too dangerous? Ann Pharmacother. 2008;42(6):790–805.
62. Snoep J.D., Hovens M.M., Eikenboom J.C., et al. Clopidogrel nonresponsiveness in patients undergoing percutaneous coronary intervention with stenting: a systematic review and meta–analysis. Am Heart J. 2007;154(2):221–31.
63. Ferguson A.D., Dokainish H., Lakkis N. Aspirin and clopidogrel response variability: review of the published literature. Tex Heart Inst J. 2008; 35(3): 313–20.
64. Gori A.M., Marcucci R., Migliorini A., et al.. Incidence and clinical impact of dual nonresponsiveness to aspirin and clopidogrel in patients with drug–eluting stents. J Am Coll Cardiol. 2008;52(9):734–9.
65. Sibbing D., Braun S., Morath T., et al. Platelet reactivity after clopidogrel treatment assessed with point–of–care analysis and early drug–eluting stent thrombosis. J Am Coll Cardiol. 2009;53(10):849–56.
66. Sofi F., Marcucci R., Gori A.M., et al. Clopidogrel non–responsiveness and risk of cardiovascular morbidity. An updatedmeta–analysis. Thromb Haemost. 2010;103(4):841–8. Epub 2010 Feb 2.
67. Nguyen T.A., Diodati J.G., Pharand C. Resistance to clopidogrel: a review of the evidence. J Am Coll Cardiol. 2005;45(8):1157–64.
68. Feher G., Feher A., Pusch G., et al. The genetics of antiplatelet drug resistance. Clin Genet. 2009; 75(1):1–18.
69. Geisler T., Schaeffeler E., Dippon J., et al. CYP2C19 and nongenetic factors predict poor responsiveness to clopidogrel loading dose after coronary stent implantation. Pharmacogenomics. 2008; 9(9):1251–9.
70. Gurbel P.A., Bliden K.P., Hayes K.M., et al. The relation of dosing to clopidogrel responsiveness and the incidence of high post–treatment platelet aggregation in patients undergoing coronary stenting. J Am Coll Cardiol. 2005; 45(9):1392–6.
71. Bonello L., Camoin–Jau L., Armero S., et al. Tailored clopidogrel loading dose according to platelet reactivity monitoring to prevent acute and subacute stent thrombosis. Am J Cardiol. 2009;103(1):5–10.
72. Gladding P., Webster M., Zeng I., et al. The pharmacogenetics and pharmacodynamics of clopidogrel response: an analysis from the PRINC (Plavix Response in Coronary Intervention) trial. JACC Cardiovasc Interv. 2008;1(6):620–7
73. Trenk D., Hochholzer W., Muller B., et al. Antiplatelet response to the 150–mg maintenance dose of clopidogrel in patients with insufficient platelet inhibition after clopidogrel loading for elective coronary stent placement. EuroIntervention. 2008;4(2):214–21.
74. Angiolillo D.J., Bernardo E., Palazuelos J., et al. Functional impact of high clopidogrel maintenance dosing in patients undergoing elective percutaneous coronary interventions. Results of a randomized study. Thromb Haemost. 2008; 99(1):161–8.
75. Chew D.P., Anderson F.A., Avezum A., et al. Six–month survival benefits associated with clinical guideline recommendations in acute coronary syndromes. Heart. 2010;96(15):1201–6. Epub 2010 Jun 7.
76. Bramlage P., Messer C., Bitterlich N., et al. The effect of optimal medical therapy on 1–year mortality after acute myocardial infarction. Heart . 2010;96(8):604–9. Epub 2010 Mar 29.
77. Di Girolamo G., Czerniuk P., Bertuola R., et al. Bioequivalence of two tablet formulations of clopidogrel in healthy Argentinian volunteers: a single–dose, randomized–sequence, open–label crossover study. Clin Ther. 2010;32(1):161–70.
78. El Ahmady O., Ibrahim M., Hussein A.M., et al. Bioequivalence of two oral formulations of clopidogrel tablets in healthy male volunteers. Int J Clin Pharmacol Ther. 2009; 47(12):780–4.
79. Jeong Y.H., Koh J.S., Kang M.K., et al.The impact of generic clopidogrel bisulfate on platelet inhibition in patientswith coronary artery stents: results of the ACCEL–GENERIC study. Korean J Intern Med. 2010;25(2):154–61. Epub 2010 Jun 1.;
80. Muller A., Octavio J., Gonzalez M.Y., et al. Clinical bioequivalence of a dose of clopidogrel Leti Cravid tablets 75 mg versus clopidogrel Sanofi Plavix tablets 75 mg administered on a daily dose for 7 dayson healthy volunteers: a clinical trial. Am J Ther. 2010;17(3):351–6.
81. http://www.sotex.ru/production/cardiology/listab/listabarticle.php
82. Voicu V.A. Mono–Center, Open, Two–Sequence Randomized, Two–Way Cross–Over Study of The Bioequivalence of Clopidogrel as a Film–Coated Tablet from One Test Formulation (Klopidogrel 2 x 75mg, film–coated tablets manufactured by Replekpharm AD) and One Reference Formulation (Plavix 2 x 75 mg film–coated tablets manufactured by Sanofi–Aventis), Each Given as a Single Oral Dose to 24 Healthy Subjects in the Fasting State. Pharminform AD. March 2008. Project No.: CLOP–REPL–0807
83. Petrovski B., Petrov S. Randomized, one–blinded, controlled clinical study, comparing the therapeutic efficacy and tolerance of CLOPIDOGREL 75 mg film coated tablets (REPLEKPHARM) versus PLAVIX® 75 mg tablets (SANOFI WINTHORP INDUSTRIE) in prevention of thrombosis after acute myocardial infarction. Replek Pharm AD Skopje. July 2005. 120 p
.
Антиагреганты во вторичной профилактике ишемического инсульта у пациентов с мультифокальным атеросклерозом
М.М. Танашян
профессор, доктор медицинских наук
М.А. Домашенко
кандидат медицинских наук
Вторичная профилактика ишемических нарушений мозгового кровообращения (НМК) остается одной из самых актуальных и дискуссионных проблем современной медицины. С одной стороны, это связано с мультидисциплинарностью этой проблемы и отсутствием единых подходов среди различных специалистов (неврологов, кардиологов, терапевтов, сосудистых хирургов), с другой – с высокой частотой повторных инсультов. Общий риск повторных НМК в первые 2 года после перенесенного инсульта составляет от 4 до 14%, причем после первого эпизода он особенно высок в течение первых нескольких недель и месяцев [1,2].
Наиболее частой причиной ишемических НМК является атеротромбоз, который в настоящее время рассматривается, как генерализованный прогрессирующий процесс, зависящий от эволюции атеросклеротических изменений в сосудах. Ежегодно в мире отмечается более 32 млн. крупных атеротромботических событий, связанных с острой ишемией в жизненно важных органах. Согласно современной концепции атеротромбоза причина и клиническая манифестация большинства сердечно–сосудистых катастроф непосредственно связана с процессом повреждения атеросклеротической бляшки. Наличие проявлений атеротромбоза в одном сосудистом русле резко повышает риск развития ишемических осложнений в другом. По данным самого крупного международного регистра по атеротромбозу REACH [3], каждый четвертый пациент из более чем 40 тыс. пациентов с атеросклеротическим поражением коронарных артерий имеет проявления атеротромбоза в других сосудистых бассейнах (цереброваскулярные заболевания и атеросклероз сосудов нижних конечностей). 3/5 из более чем 8 тыс. пациентов с симптоматической ишемией артерий нижних конечностей страдают ИБС и цереброваскулярными заболеваниями, а 2/5 из почти 19 тыс. пациентов с поражением церебрального сосудистого бассейна имеют мультифокальное поражение артерий коронарного русла и артерий нижних конечностей [3].
Более того, комбинированный риск возникновения ишемического инсульта, инфаркта миокарда или смерти от сосудистой причины у пациентов с атеротромботическим поражением двух сосудистых бассейнов на 25% выше, а при вовлечении трех сосудистых бассейнов – соответственно на 51% выше по сравнению с поражением единственного сосудистого бассейна [4]. При этом зачастую одно атеротромботическое событие может быть сопряжено с другим, в связи с чем частое мультифокальное поражение сосудистого русла еще раз подтверждает важность использования антитромботической терапии с мультифокальной направленностью действия.
Несмотря на патогенетический и клинический полиморфизм ишемических НМК, основным пусковым моментом их развития является повышенная агрегационная способность тромбоцитов, что и обосновывает первостепенную значимость антиагрегантной терапии в их медикаментозной профилактике. Основной целью антиагрегантной терапии является прекращение тромбообразования на стадии формирования тромбоцитарных агрегатов. Представленные на сегодняшний день антиагрегантные препараты сильно различаются по своим основным механизмам. Так, ацетилсалициловая кислота (АСК) блокирует циклооксигеназу, предотвращая образование тромбоксана A2, дипиридамол влияет на концентрацию циклических нуклеотидов, АДФ, тромбина, арахидоновой кислоты. Тиенопиридины, к которым относят клопидогрел и тиклопидин, являются необратимыми и селективными ингибиторами АДФ–индуцированной агрегации тромбоцитов путем блокирования АДФ–рецепторов тромбоцитов. Антагонисты и блокаторы гликопротеиновых рецепторов тромбоцитов [GP] IIb/IIIa воздействуют на конечный этап формирования тромбоцитарного агрегата [5].
Согласно доказательной базе многоцентровых клинических исследований антиагрегантная терапия является эффективной для предотвращения инсульта, сердечных приступов и смертности от сосудистых причин у лиц с симптомным атеросклерозом. Мета–анализ 287 исследований, включивший более 212 тыс. пациентов с высоким риском окклюзирующих сосудистых событий, показал, что назначение антитромбоцитарной терапии сократило число случаев несмертельного инсульта на 1/4 (25±3%), а сосудистой смертности на 1/6 (23±2%). При этом абсолютное снижение риска развития тяжелого сосудистого события составило 36 случаев на каждую 1000 больных с предшествующими ишемическими НМК, леченных антиагрегантами в течение 2 лет, и соответственно 9 случаев из 1000 пациентов с острым инсультом в течение трех первых недель [6]. Эти данные позволили признать данный путь профилактики цереброваскулярных заболеваний наиболее перспективным.
Однако несмотря на наличие широкого арсенала средств антитромбоцитарного действия использование антиагрегантов в клинической практике зачастую сталкивается с рядом проблем. Нерешенными и спорными остаются вопросы определения истинно лечебного либо профилактического действия тех или иных антиагрегантов, неоднозначны результаты эффективности их различных доз, практически отсутствуют данные по исследованию индивидуальной чувствительности и частоте встречаемости резистентности к ним у отдельных больных, не определены рекомендации по использованию антиагрегантов в раннем послеоперационном периоде после реконструктивных операций на брахиоцефальных артериях.
Наиболее многообещающими с позиций доказательной медицины препаратами для вторичной профилактики ишемического инсульта (ИИ) у пациентов с мультифокальным атеросклерозом выглядят антагонисты аденозиновых рецепторов, и прежде всего клопидогрел (Плавикс).
Плавикс обладает мощным поливалентным антиагрегантным эффектом на тромбоциты. Активный метаболит клопидогрела связывается с молекулой цистеина рецептора АДФ (P2Y12), подавляя активацию тромбоцитов за счет селективного и необратимого связывания со специфичными рецепторами АДФ (P2Y12), тем самым блокируя АДФ–зависимую активацию гликопротеинового комплекса IIb/IIIa и препятствуя образованию фибриногеновых мостиков. Кроме этого, клопидогрел может ингибировать агрегацию тромбоцитов, вызванную другими индукторами, через влияние на содержание внутриклеточного АДФ, необходимого для активации GP IIb/lIIa.
Клиническая эффективность клопидогрела во вторичной профилактике ИИ наиболее полно продемонстрирована в многоцентровом исследовании CAPRIE (Clopidogrel Versus Aspirin in Patients at Risk of Ischemic Events, 1996), оценившем потенциальное преимущество клопидогрела по сравнению с АСК (325 мг/сут) в уменьшении риска развития ИИ, инфаркта миокарда или сосудистой смерти у 19185 пациентов, недавно перенесших эти же сосудистые события. Частота развития первичной конечной точки (ИИ, ИМ, смерть от сосудистых причин) была на 8,7% ниже у пациентов, получавших клопидогрел, по сравнению с группой АСК (р=0,043), что выражалось в предотвращении 24 новых случаев ишемических событий на 1000 пациентов, получавших клопидогрел по сравнению соответственно с 19 пациентами, принимавшими АСК. Было также показано, что по сравнению с АСК клопидогрел сокращает риск возникновения ишемического инсульта на 7,3%.
Необходимо особо подчеркнуть, что у лиц с атеротромботическим поражением двух и более сосудистых бассейнов преимущество клопидогрела увеличивалось [7,8]. При этом показана большая эффективность клопидогрела (Плавикса) по сравнению с АСК у пациентов высокого сосудистого риска (с сахарным диабетом (13,1%), с атеросклерозом периферических артерий (23,8%), у пациентов, уже перенесших ишемический инсульт или инфаркт миокарда (14,9%) и пациентов после АКШ (36,3%)) [9–11].
В клинических исследованиях незаслуженно редко упоминается эндотелийпротекторная функция клопидогрела, хотя на сегодняшний день дисфункция эндотелия рассматривается, как облигатный маркер атеросклеротического поражения магистральных артерий головы и ишемических НМК [12,13]. Нами продемонстрировано, что даже непродолжительный курс терапии клопидогрелом (Плавикс в дозе 75 мг в течение 28 дней) у пациентов с хроническими ишемическими НМК приводил к улучшению атромбогенных возможностей эндотелия. При этом установлено как качественное (повышение антиагрегационной и фибринолитической активности эндотелия при проведении функциональной манжеточной пробы), так и количественое (увеличение числа пациентов с адекватной реакцией эндотелия на кратковременную ишемию тканей плеча) улучшение основных звеньев антитромботической активности сосудистой стенки [14,15].
Заслуживает особого внимания свойство клопидогрела влиять на показатели липидного профиля. Данные о большей эффективности клопидогрела по сравнению с АСК у больных с гиперхолестеринемией были приведены в результатах последовавшего за исследованием CAPRIE анализом данных [16]. Нами было доказано достоверное снижение уровня триглицеридов и положительная тенденция в изменении других параметров у пациентов с исходно нарушенной липидограммой и с ишемическими сосудистыми заболеваниями мозга на фоне даже 4–недельного курса лечения клопидогрелом [17]. В этом же исследовании также было показано, что Плавикс, наряду с антиагрегантной и эндотелийпротекторной активностью (улучшение атромбогенности сосудистой стенки), проявляет выраженную антилипидемическую активность у больных с ишемическими НМК и метаболическим синдромом.
Важным аспектом применения клопидогрела является использование его в ангионейрохирургии. Антиагрегантная терапия до и после реконструктивных операций на брахиоцефальных артериях способствует редукции тромботических осложнений, являющихся основной причиной эмболического по генезу инсульта [18,19].
Учитывая различные точки приложения и механизмы действия препаратов с антиагрегантным действием, а также вариабельность тромбоцитарного ответа, представляется теоретически оправданным их комбинированное использование для достижения аддитивного эффекта торможения агрегации. Предпосылками к сочетанному применению клопидогрела и АСК явились как экспериментальные данные о большей эффективности их комбинации по сравнению с монотерапией [20], так и широкое использование такого сочетания в кардиологической практике. В небольшом исследовании PLUTO (Clopidogrel and Aspirin versus Aspirin Alone in Stroke Patients, 2005) с участием 70 пациентов, перенесших ИИ в период от 1 до 3 месяцев, показано более эффективное ингибирование агрегации тромбоцитов у пациентов, получавших комбинацию АСК (81 мг в сутки) и клопидогрела (75 мг в сутки), по сравнению с монотерапией АСК (81 мг в сутки) [21]. В то же время в таком исследовании, как MATCH (Management of Atherothrombosis with Clopidogrel in High–risk Patients, 2004), была показана нецелесообразность добавления АСК (75 мг сутки) к клопидогрелу (75 мг) пациентам, перенесшим ИИ, с целью его вторичной профилактики, поскольку, несмотря на уменьшение на 6,4% частоты развития комбинированной конечной точки (включавшей ИИ, инфаркт миокарда, смерть от сосудистой причины либо повторную госпитализацию по поводу атеротромботического события), частота геморрагических осложнений была существенно выше в группе получавших комбинированную терапию [22].
Эффективность комбинированной терапии клопидогрелом (75 мг в сутки) и АСК (325 мг в сутки) в сравнении с монотерапией АСК (325 мг в сутки) у пациентов, перенесших атеротромботические события, а также у группы пациентов, имеющих лишь множественные факторы риска, оценивалась в исследовании CHARISMA (Clopidogrel for High Atherothrombotic Risk and Ischemic Stabilization, Management and Avoidance, 2006) [23]. Исследование не продемонстрировало преимуществ сочетанной терапии клопидогрелом и АСК над монотерапией АСК у данной категории пациентов. Спустя 30 месяцев наблюдения за пациентами частота развития комбинированной конечной точки, включавшей ИИ, инфаркт миокарда, смерть от сосудистой причины у пациентов, получавших комбинированную антиагрегантную терапию, составила 6,8% и оказалась меньше, чем в группе пациентов, получавших монотерапию, где данный показатель составил 7,3%; однако различие было статистически недостоверным (p=0,22).
Тем не менее в 2007 году был проведен более углубленный анализ исследования CHARISMA [24], включивший пациентов с мультифокальным атеросклерозом. Данное исследование ставило своей целью оценить частоту возникновения событий в так называемой «CAPRIE–like»–популяции пациентов, т.е. больных с подтвержденным инфарктом миокарда, ИИ и заболеваниями периферических артерий в анамнезе. В анализ вошли 9478 из 12153 пациентов с установленным атеротромбозом. Основное различие между критериями включения в когорту «CAPRIE–like» и оригинальным исследованием CAPRIE состояло во времени после перенесенного события до рандомизации. Так, в исследовании CAPRIE время было четко регламентировано (ИМ менее чем 35 дней до включения, инсульт от одной недели до 6 месяцев до рандомизации), в то время как в исследовании CHARISMA было только одно ограничение – по инсульту (до 5 лет). В результате, частота возникновения сосудистой смерти, ИМ, ИИ была достоверно ниже в группе, получавшей комбинированную антиагрегантную терапию (7,3%) по сравнению с группой, находившейся на монотерапии АСК (8,8%) (р=0,01). Кроме того, число госпитализаций по поводу ишемических событий было статистически значимо меньшим в группе сочетанной терапии (11,4%) в сравнении с группой монотерапии АСК (13,2%) (р=0,008). При этом не было продемонстрировано значимых различий между частотой сильных кровотечений: 1,7% в группе комбинированной терапии по сравнению с 1,5% в группе монотерапии (р=0,50), несмотря на большую частоту умеренных кровотечений в группе комбинированной антитромбоцитарной терапии: 2,0% по сравнению с 1,3% (р = 0,004). Этот анализ исследования CHARISMA показал статистически значимое преимущество комбинированной терапии АСК и клопидогрелом в снижении ишемических событий по сравнению с монотерапией АСК у пациентов с мультифокальным атеросклерозом.
Результаты международных плацебо–контролируемых исследований легли в основу рекомендаций Европейской организации по борьбе с инсультом (European Stroke Organization, 2008 [25]), в которых клопидогрел рекомендован в качестве препарата первой линии для вторичной профилактики инсульта. (Класс I, уровень доказательности А). По сравнению с АСК клопидогрел более эффективен у пациентов с высоким сосудистым риском (с инсультом в анамнезе, атеросклерозом периферических артерий, симптомным поражением коронарных артерий или сахарным диабетом) [26]. Пациентам, перенесшим ишемический инсульт с сопутствующей нестабильной стенокардией или не–Q–образующим инфарктом миокарда, а также после ангиореконструктивных операций (например, стентирования сонных артерий), рекомендована комбинированная антиагрегантная терапия клопидогрелом и АСК продолжительностью до 9 месяцев (Класс I, уровень доказательности А) [25].
Литература
1. Скворцова В.И., Чазова Е.И., Стаховская Л.В. Вторичная профилактика инсульта. – М.: ПАГРИ, 2002. –120 с.
2. Инсульт: диагностика, лечение, профилактика. Под ред. З.А. Суслиной, М.А. Пирадова. М.: Медпресс–информ, 2008.
3. Bhatt D.L. et al, for the REACH Registry Investigators. International prevalence, recognition, and treatment of cardiovascular risk factors in outpatients with atherothrombosis. JAMA 2006;295:180–189.
4. Steg P.G. et al, on behalf of the REACH Registry Investigators. JAMA 2007;297(11): 1197–1206.
5. Суслина З.А., Танашян М.М., Домашенко М.А. Антитромботическая терапия ишемических нарушений мозгового кровообращения. М.: ООО «МИА», 2009.
6. Antithrombotic Trialists’ Collaboration. Collaborative meta–analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ. 2002; 324: 71–86.
7. CAPRIE Steering Committee. A randomized, blinded trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE). Lancet 1996; 348: 1329–1339.
8. Harker L.A. et al. Comparative safety and tolerability of clopidogrel and aspirin: results from CAPRIE. CAPRIE Steering Committee and Investigators. Clopidogrel versus aspirin in patients at risk of ischaemic events. Drug Safety 1999; 21:325–335.
9. Ringleb P.A., Bhatt D.L., Hirsch A.T. et al. Benefit of clopidogrel over aspirin is amplified in patients with a history of ischemic events. Stroke 2004; 35: 528–532.
10. Bhatt D.L., Marso SP, Hirsch AT et al. Amplified benefit of clopidogrel versus aspirin in patients with diabetes mellitus. Am J Cardiol 2002; 90: 625–628.
11. Durand–Zaleski et al. Pharmacoeconomics 2004., 22 Suppl.4:19–27.
12. Домашенко М.А. Дисфункция эндотелия в остром периоде ишемического инсульта):
дисс. … канд. мед. наук. – М., 2006.–130 с.
13. Танашян М.М., Суслина З.А., Ионова В.Г. и соавт. Состояние функции эндотелия у больных с ишемическим инсультом при различной степени атеросклеротического поражения сонных артерий. Неврологический вестник 2007; Т. XXXIX, вып.1: 12–16.
14. Танашян М.М., Умарова Р.М., Гераскина Л.А., Фонякин А.В. Гемангиокорректорная эффективность Плавикса у больных с церебральной ишемией. Атмосфера, Нервные болезни. 2005; 3: 2–7.
15. Танашян М.М., Орлов С.В., Ионова В.Г., Умарова Р.М. Особенности лечения больных с цереброваскулярными заболеваниями на фоне метаболического синдрома. Атмосфера, Нервные болезни. 2006; 1: 12–16.
16. Bhatt D.L., Topol E.J. Scientific and therapeutic advances in antiplatelet therapy. Nature reviews. 2003. V.2. №1. P.15–28.
17. Суслина З.А., Танашян М.М., Умарова Р.М. Клопидогрель при ишемических цереброваскулярных заболеваниях. Лечение нервных болезней. 2003; 4: 14–18.
18. McKevitt F.M., Randall M.S., Cleveland T.J. et al. The benefits of combined anti–platelet treatment in carotid artery stenting. Eur J Vasc Endovasc Surg 2005; 29: 522–527.
19. Buhk J–F., Wellmer A., Knauth M. Late in–stent thrombosis following carotid angioplasty and stenting. Neurology 2006; 66: 1594–1596.
20. Caplain H., Levene F., Kieffer G. Enhanced antiplatelet effects of clopidogrel plus ASA compared with ASA alone or with extended release dipyridamole combined with low–dose ASA in healthy volunteers //Cerebrovasc Dis 2001; 11 (Suppl.4): 85.
21. Serebruany V.L. et al Effects of Clopidogrel and Aspirin in Combination versus Aspirin Alone on Platelet Activation and Major Receptor Expression in Patients After Recent Ischemic Stroke. Stroke 2005; 36: 2289–2292.
22. Diener H.C., Bogousslavsky J., Brass L.M. et al. Aspirin and clopidogrel compared with clopidogrel alone after ischaemic stroke or transient ischaemic attack in high–risk patients (MATCH): randomized, double–blind, placebo–controlled trial. Lancet 2004; 34: 331–337.
23. Bhatt D.L., Fox K.A., Hacke W. et al Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events. N Engl J Med 2006; 354: 1706–1717.
24. Bhatt D.L. et al. Patients With Prior Myocardial Infarction, Stroke, or Symptomatic Peripheral Arterial Disease in the CHARISMA Trial. J Am Coll Cardiol 2007;49:1982–8.
25. http://www.eso–stroke.org
26. ESO Executive comitee, cerebrovasc dis 2008; 25: 457–507.
Sanofi-Aventis подтверждает качество и продолжение поставок препаратов Плавикс, Исковер и Клопидогрел Винтроп
Sanofi-Aventis, разработчик и производитель препаратов Плавикс и Исковер (Iscover) (клопидогреля гидросульфат), подтверждает, что все препараты, содержащие клопидогрел, включая Плавикс и Исковер (Iscover), полностью соответствуют требованиям Европейского агентства по лекарственным препаратам (ЕМEА) и не подпадают под требование об отзыве, рекомендованном EMEA в отношении некоторых дженериковых препаратов на основе клопидогрела (клопидогрела бесилат), выпускаемых в Европе. В ряде стран Евросоюза препарат Исковер (Iscover) распространяется компанией Bristol-Myers Squibb.
Sanofi-Aventis производит все препараты на основе клопидогрела, предназначенные для распространения на рынках стран Европы, в Евроcоюзе, с полным соблюдением соответствующих действующих правил и требований, включая нормы надлежащей производственной практики (GMP). Препараты Плавикс, Исковер (Iscover) и Клопидогрель Винтроп (Clopidogrel Winthrop) содержат соль клопидогрела гидросульфата и производятся Sanofi-Aventis на своих заводах, соответствующих нормам GMP (Sisteron, Neuville, Ambares и Quetigny во Франции и Fawdon в Великобритании). Препарат Тромбекс (Trombex) также содержит соли клопидогрела гидросульфата, производимые на заводах Sanofi-Aventis в г. Глоговец (Словакия), отвечающих нормам GMP.
Плавикс (клопидогрела гидросульфат) присутствует на рынке уже более 10 лет. Клопидогрель — препарат, назначаемый пациентам с различными проявлениями атеротромбоза: острым коронарным синдромом (ОКС) (инфарктом миокарда с подъемом или без подъема сегмента ST, с нестабильной стенокардией с постановкой стента или без постановки стента), недавно перенесшим инфаркт миокарда, инсульт или с установленным диагнозом болезни периферических артерий. Плавикс обладает подтвержденным профилем эффективности и безопасности в предотвращении атеротромботических событий. Плавикс широко изучался в рамках 4 крупных клинических исследований с участием более 80 тыс. пациентов, в результате проведения которых было пролечено более 100 млн человек во всем мире. За период применения препарата не произошло ни одного случая отзыва препарата по причинам, связанным с его качеством.
КЛОПИДОГРЕЛЬ отзывы — Medcentre.com.ua
КЛОПИДОГРЕЛЬ отзывы — Medcentre.com.ua
КЛОПИДОГРЕЛЬ отзывы
КЛОПИДОГРЕЛЬ аналоги
Аналоги подобраны по действующему веществу, показанию и способу применения
Инструкция по применению
от 48 грн
272472 просмотровИнструкция по применению
от 27 грн
199360 просмотровИнструкция по применению
от 77 грн
154193 просмотровИнструкция по применению
от 25 грн
80257 просмотровИнструкция по применению
от 279 грн
64966 просмотров
Все аналоги
Смотрите также
Сердечно-сосудистая система и Сердечно-сосудистые препараты
5.0 1 отзыв
231 просмотров
5.0 1 отзыв
244 просмотров
5.0 1 отзыв
293 просмотров
5.0 1 отзыв
280 просмотров
5.0 1 отзыв
473 просмотров
4.5 2 отзыва
504 просмотров
КЛОПИДОГРЕЛЬ инструкция
Клопидогрель – синтетический антиагрегантный препарат, применяемый для профилактики тромботических осложнений при сердечно-сосудистых заболеваниях. Действие препарата осуществляется за счет способности клопидогреля избирательно ингибировать связывание аденозиндифосфата с рецепторами тромбоцитов, вследствие чего угнетается активация комплекса гликопротеинов IIb/IIIa и снижается способность тромбоцитов к агрегации. Препарат увеличивает время кровотечения. Антиагрегантное действие клопидогреля является дозозависимым, при применении препарата в рекомендованных терапевтических дозах максимальный терапевтический эффект развивается в течение 3-7 дней. Препарат необратимо блокирует АДФ-рецепторы тромбоцитов, вследствие чего они теряют способность к агрегации, восстановление нормальной функции отмечается спустя 7 дней после отмены препарата, по мере обновления тромбоцитов.
После перорального применения препарат быстро абсорбируется в желудочно-кишечном тракте. Биодоступность препарата составляет…
Подробнее
Статьи
Статьи на тему «Сердечно-сосудистая система»
Новости
Новости на тему «Сердечно-сосудистая система»
САМОЛЕЧЕНИЕ МОЖЕТ НАВРЕДИТЬ ВАШЕМУ ЗДОРОВЬЮ
Схема лечения ОРВИ с подозрением или подтвержденным COVID-19
Если вы болеете 1-3-ий день, сразу начинайте прием ВСЕХ ниже перечисленных препаратов по пяти пунктам:
1.Один из противовирусных препаратов: ингавирин 90мг 1 т утром 7 дней или арбидол 200 мг*4 р в день или фавиправир по схеме или триазаверин по инструкции или кагоцел по схеме. К этим препаратам нужно добавить капли гриппферон (интерферон альфа) по 3 капли в каждый носовой ход * 5 раз в день, 7 дней или виферон в свечах 500 тыс. ед. * 2раза в день – 7 дней.
- Жаропонижающие препараты: парацетамол 0,5 по 1 табл. до 4 раз в день при лихорадке свыше 38 гр., можно сочетать с ибупрофеном 400мг * 3раза в день или с аспирином 0,5*3раза в день
- Бромгексин 8 мг4р в день или амброксол по 1 т4р (отхаркивающий препарат, также блокирует попадание вируса в клетку), 2 недели.
- Верошпирон 50 мг утром – 2-3 недели( считается слабым мочегонным препаратом, но в данном случае используется для снижения тестостерона, блокады рецепторов АРА 2 на которые садится вирус, уменьшения фиброза легочной ткани, чтобы не было осложнений после перенесенной инфекции, одышки)
- Препараты разжижающие кровь (т.к. коронавирус вызывает воспаление мелких сосудов и в них образуются тромбы) – антикоагулянты — эликвис 2,5 мг*2р или ксарелто 10 мг (15 мг, 20 мг) утром – 3-4 недели. Начать их приме необходимо как можно раньше!!! При невозможности приобретения этих препаратов можно начать прием курантила или дипиридамола по 75 мг * 2раза в день (улучшает микроциркуляцию, для профилактики тромбов) + аспирин 500 мг по ¼ таблетке после ужина.
Длительность лечения, если нет ухудшения состояния, составляет 2 недели, потом можно отменить бромгексин, верошпирон и препараты, разжижающие кровь.
Если у вас на 4-5 (и более) день болезни сохраняется или нарастает температура, появляется одышка, кашель … необходимо ДОБАВИТЬ к лечению следующие препараты: - Противовоспалительные гормональные препараты дексаметазон 0,5 мг по 3-4 табл. в день или метипред (метилпреднизолон) 4 мг по 3-4 табл. в день или преднизолон 5 мг 4 табл. в день принимать в два приема (утро, день), строго после еды, примерно на 7 дней , затем постепенно уменьшать дозу на 0,5 (половину) таблетки 1 раз в 3-5 дней (чем медленней, тем лучше) до полной отмены.
- Увеличиваем дозу антикоагулянтов — эликвис до 5 мг*2р или ксарелто до 20 мг утром на 2 недели, в дальнейшем уменьшаем дозу только по согласованию с врачом.
- Т.к. противовоспалительные препараты раздражают слизистую оболочку желудка, необходимо начать прием следующих препаратов :
- фамотидин 40 мг на ночь или нольпаза 0,02 или омепразол 0,02 по 1 т*2раза в день на весь срок, пока принимаем гормоны)
- присоединяем антибактериальную терапию: азитромицин (сумамед) 500 мг 1 раз в день 5 дней или амоксиклав (флемоклав) 500 мг по 1 табл. 3раза в день на 7- 10 дней или левофлоксацин 500 мг по 1 табл. 2 раза в день 7 дней или другой антибиотик. Возможность выдачи рецепта можно согласовать по указанному телефону или с уч. врачом.
Если состояние с улучшением, то это лечение (кроме антибиотиков) продолжаем до 3-х недель.
Возможно на 5-7 день болезни появление или усиление одышки, подъем температуры, ухудшение общего состояния – нужна более интенсивная терапия, следует позвонить врачу, тел.: 89517340922, 89517341137 .
Дополнительно, с первых дней заболевания, в течении 14 дней , а при необходимости и дольше можно принимать:
- витамин Д ( аквадетрим или вигантол) по 8-10 капель в день ( помогают организму бороться с вирусом, при вирусной инфекции возникает очень сильный дефицит витамина Д, кто пьет, у того инфекция протекает легче)
- препараты цинка 15-50 мг в день (помогают организму бороться с вирусом)
- витамин С по 500 мг в сутки до 1 месяца.
Профилактика тромботических осложнений сердечно-сосудистых заболеваний: в фокусе клопидогрель
Статья опубликована на с. 10-11 (Укр.)
Несмотря на значительно возросший уровень медицинского обслуживания и развитие медицины в целом, сердечно-сосудистые заболевания удерживают лидирующие позиции в списках причин смертности и инвалидизации населения большинства стран мира. Так, по данным Всемирной организации здравоохранения, во всем мире почти каждая третья смерть вызвана заболеваниями сердечно-сосудистой системы.
В последнее десятилетие клопидогрель стал одним из наиболее часто используемых врачами-кардиологами антитромботических препаратов. В целом ряде исследований была доказана высокая эффективность клопидогреля при нестабильной стенокардии (НС) и инфаркте миокарда (ИМ). Кроме того, клопидогрель существенно улучшил отдаленные результаты чрескожной коронарной ангиопластики и стентирования венечных сосудов.
Краткая характеристика препарата
Клопидогрель является производным тиенопиридина. Он селективно ингибирует связывание аденозиндифосфата (АДФ) с P2Y12-рецепторами на тромбоците, препятствует активации гликопротеинового рецепторного комплекса IIb/IIIa под действием АДФ и других агентов и, таким образом, снижает агрегационную способность тромбоцитов. Клопидогрель необратимо связывается с тромбоцитарными рецепторами к АДФ. Соответственно, тромбоциты, подвергшиеся воздействию клопидогреля, остаются невосприимчивыми к стимуляции АДФ в течение всего срока их жизни (7–10 дней).
Клопидогрель фармакологически неактивен. Его активный метаболит представляет собой тиольное производное, которое образуется путем двухэтапного окисления клопидогреля в гепатоцитах и затем быстро связывается с тромбоцитарными P2Y12 аденозиновыми рецепторами. В превращении клопидогреля в активный метаболит участвуют различные печеночные изоферменты микросомального окисления (главным образом цитохром CYP2C19). Как показали проведенные исследования, генетический полиморфизм изофермента CYP2C19 может в определенной степени влиять на эффективность клопидогреля, однако выраженность такого влияния и его клиническое значение требуют дальнейшего изучения.
Значительное торможение тромбоцитарной агрегации наступает через 2 часа после приема препарата. Ингибирующий эффект в отношении тромбоцитов постепенно усиливается и достигает максимума на 3–7-й день лечения. При длительном (1 год и более) приеме клопидогреля его антиагрегантное действие не ослабевает. При прекращении лечения агрегационная способность тромбоцитов постепенно возрастает и возвращается к исходному уровню в среднем через 7 дней после приема последней дозы клопидогреля. Синдром отмены при прекращении терапии клопидогрелем не возникает.
Подтверждение клинической эффективности
В крупных клинических исследованиях (CAPRIE, CURE, CREDO) почти у 35 тыс. больных получены доказательства того, что клопидогрель является эффективным и безопасным средством профилактики тромботических осложнений атеросклероза, лежащего в основе ишемической болезни сердца (ИБС). Результаты исследования CURE оказались столь впечатляющими, что комбинация ацетилсалициловой кислоты (АСК) и клопидогреля была включена в рекомендации по лечению больных с острым коронарным синдромом (ОКС) без подъема ST на ЭКГ. Клопидогрель следует назначать вместе с АСК немедленно после установления диагноза ОКС без подъема ST (в 1-й день нагрузочная доза составляет 300 мг, в дальнейшем — по 75 мг ежедневно в течение 9–12 мес.). При возникновении потребности в проведении аортокоронарного шунтирования (АКШ) клопидогрель следует отменить за 5 дней до операции.
В исследовании CURE более чем у 20 % больных было выполнено чрескожное коронарное вмешательство (ЧКВ), в большинстве случаев со стентированием коронарной артерии. В рамках субисследования CURE-PCI (Clopidogrel in Unstable angina to prevent Recurrent Events — Percutaneous Coronary Intervention) планировалось оценить роль раннего назначения клопидогреля пациентам, подвергнутым ЧКВ. Для этого половине больных (n = 1313) назначили клопидогрель в день поступления в стационар (в среднем за 10 дней до ЧКВ). Остальным пациентам (n = 1345) клопидогрель был назначен в день выполнения ЧКВ (до этого они получали плацебо). Затем обе группы в течение 28 дней получали комбинацию АСК + клопидогрель в открытом режиме, после чего 1-я группа продолжила комбинированную антитромботическую терапию, а 2-я вернулась к приему АСК с плацебо.
Частота неблагоприятных исходов (сердечная смерть, ИМ и необходимость экстренной реваскуляризации) в течение 30 дней после ЧКВ в группе больных, получавших клопидогрель до операции, была достоверно ниже, чем в группе больных, начавших прием клопидогреля в день выполнения ЧКВ (4,5 и 6,4 % соответственно, p = 0,03). У больных, получавших клопидогрель до ЧКВ и продолживших его прием по окончании 28-дневного периода открытого использования клопидогреля после операции, частота неблагоприятных исходов (сумма смертей и ИМ) в период от ЧКВ до окончания наблюдения была достоверно ниже (6 %), чем в группе плацебо (8 %; p = 0,047).
Доказательства эффективности длительной (около 1 года) терапии клопидогрелем после ЧКВ, полученные у больных с ОКС в исследовании PCI-CURE, послужили основанием для организации нового крупномасштабного исследования CREDO (Clopidogrel for the Reduction of Events During Observation trial), целью которого было изучение эффективности 12-месячного лечения клопидогрелем в дозе 75 мг/сут на фоне стандартной терапии, включающей АСК, в сравнении с плацебо. В исследование вошли пациенты с ИБС и показаниями к ЧКВ (53 % имели клиническую картину нестабильной стенокардии). Все больные с 1-го дня после выполнения ЧКВ получали клопидогрель по 75 мг ежедневно в течение 28 дней. Осуществлялась рандомизация в две группы: больные в 1-й группе получали нагрузочную дозу клопидогреля 300 мг за 3–24 ч до ЧКВ, а затем по 75 мг ежедневно в течение 12 мес., во 2-й — плацебо вместо нагрузочной дозы клопидогреля, и после 28-го дня до окончания времени наблюдения (12 мес.) назначалось плацебо. Больные обеих групп на протяжении всего исследования получали АСК. Оказалось, что длительный прием клопидогреля после ЧКВ приводит к снижению риска смерти, развития ИМ и инсульта на 27 %.
Клопидогрель был признан обязательным элементом антитромботического лечения при стентировании коронарных артерий. Причем данные исследований PCI-CURE, CREDO указывали на необходимость начала лечения клопидогрелем не менее чем за 6 часов до внутрикоронарного вмешательства. Согласно Европейским рекомендациям АСС/АНА, пациентам, которым проводилось селективное ЧКВ или ЧКВ на фоне ОКС, клопидогрель должен назначаться в течение 30 дней, при установке непокрытого стента — в течение 1 года, драг-элютинг стента — также в течение 1 года (без наличия высокого риска развития кровотечений). Больным с высоким риском развития кровотечений клопидогрель назначается в течение как минимум двух недель.
Исследование CLARITY (CLоpidogrel as Adjunctive ReperfusIon TherapY) открыло новые возможности применения клопидогреля. Известно, что тромболизис, проводимый согласно стандартам лечения острого ИМ с подъемом сегмента ST, оказывается успешным немногим более чем у половины больных, причем у части пациентов даже после успешного тромболизиса развивается реокклюзия инфарктсвязанной коронарной артерии. Полагают, что это может быть обусловлено повышением активности тромбоцитов под действием тромболитиков. В исследование CLARITY были включены больные (n = 3491), доставленные в стационар в течение 12 ч от появления симптомов со стойким подъемом сегмента ST. Половине пациентов в дополнение к АСК и тромболитику назначался клопидогрель (нагрузочная доза 300 мг, затем — 75 мг/сут), половине — плацебо. Через несколько дней всем больным проводили коронарную ангиографию. Первичная комбинированная конечная точка включала в себя зарегистрированную при коронарографии окклюзию инфарктсвязанной артерии, смерть, рецидив ИМ. Частота достижения первичной конечной точки в группе плацебо составила 21,7 %, в группе клопидогреля — 15 %, т.е. в группе клопидогреля события, составляющие конечную точку, развивались на 36 % реже (p < 0,001). На 30-й день в группе клопидогреля такие неблагоприятные события, как сердечно-сосудистая смерть, повторный ИМ и повторная ишемия, потребовавшая реваскуляризации, развивались на 20 % реже, чем в группе плацебо. Больные, получавшие клопидогрель, значительно реже подвергались экстренной коронарографии в первые 2 сут. (15,4 против 18,6 %, p = 0,01) и неотложной реваскуляризации (19,5 против 23,3 %, p = 0,005). Частота крупных кровотечений и геморрагических инсультов в обеих группах достоверно не различалась.
Доказательства эффективности клопидогреля при остром ИМ также были получены в крупномасштабном исследовании COMMIT/CCS-2 (ClOpidogrel & Metoprolol in Myocardial Infarction Trial). В него были включены 45 852 пациента с подозрением на острый ИМ. Больные были рандомизированы в две группы: клопидогреля 75 мг/сут (без нагрузочной дозы) в течение 2–4 нед. и плацебо. Кроме того, все пациенты получали АСК, и более чем половине больных была проведена тромболитическая терапия. Комбинированную конечную точку составили смерть, рецидив ИМ и инсульт; частота ее развития у больных, получавших клопидогрель, в течение 28 дней наблюдения оказалась на 9 % ниже, чем у получавших плацебо. Кроме того, отмечено достоверное (на 7 %) снижение смертности. Было рассчитано, что клопидогрель, назначенный 1000 больных с подозрением на острый ИМ дополнительно к АСК, предотвратит 3 рецидива ИМ (p = 0,01), 1 инсульт (p = 0,3) и 5 смертельных исходов (p = 0,03). Следует отметить, что действие клопидогреля на конечную точку оказалось статистически значимым у больных, получивших тромболитик, но недостоверным у пациентов без тромболитического лечения.
Интересно исследование о влиянии клопидогреля на частоту мигрени после закрытия дефекта межпредсердной перегородки (ДМПП). Три месяца терапии клопидогрелем в комбинации с АСК ассоциировались с более низкой частотой мигрени у пациентов, которым было выполнено катетерное закрытие ДМПП. К таким выводам пришли авторы канадского исследования «Клопидогрель в профилактике новых случаев мигренозных головных болей после транскатетерного закрытия дефектов межпредсердной перегородки» (Clopidogrel For the Prevention of New Onset Migraine Headache Following Transcatheter Closure of Atrial Septal Defects, CANOA). Результаты исследования были представлены на проходившей 7–11 ноября 2015 г. в Орландо ежегодной научной сессии Американской кардиологической ассоциации и одновременно опубликованы онлайн в Journal of the American Medical Association.
Мигрень является хорошо известным осложнением закрытия ДМПП. Ранее уже были опубликованы результаты когортных исследований, которые позволяли предположить пользу клопидогреля в этой ситуации, однако только в исследовании CANOA впервые получена недвусмысленная информация. На данный момент некоторые клинические центры уже практикуют рутинное добавление клопидогреля к АСК в течение 3–6 месяцев, в то время как в других после закрытия ДМПП продолжают назначать только АСК. Авторы отмечают, что точный механизм, за счет которого клопидогрель эффективен у этой категории пациентов, на данный момент неизвестен. Исходя из эффективности антиагрегантов, можно предположить, что у этих больных в основе мигрени лежат какие-то протромботические механизмы, однако клопидогрель обладает также противовоспалительным и вазопротективным действием. Имеется ряд исследований, в которых показано повышение агрегации тромбоцитов у пациентов с мигренью или во время эпизодов мигренозных головных болей; также широко известно наличие ассоциации между мигренью и инсультом. Тем не менее два рандомизированных исследования с антитромботическими препаратами (в одном случае использовался клопидогрель, в другом — варфарин) оказались отрицательными. В то же время применительно к операции закрытия ДМПП можно предположить, что при использовании устройства для катетерного закрытия дефекта создается протромбогенная ситуация.
Также в г. Орландо обсуждался вопрос о применимости полученных результатов к аналогичным вмешательствам у детей. Несмотря на то что в исследовании участвовали только взрослые пациенты, вполне вероятно, что многие центры перейдут к рутинному назначению клопидогреля и в педиатрической практике, поскольку у детей при закрытии ДМПП используются такие же устройства и возникают те же проблемы, что и у взрослых.
В настоящее время продолжается ряд исследований, в которых проверяется гипотеза о том, что по ответу пациента с хронической мигренью на клопидогрель можно предсказать его ответ на закрытие открытого овального окна.
Современный препарат клопидогрель, так же как и тиклопидин, предотвращает развитие осложнений после проведения ангиопластики коронарных артерий со стентированием. Установлено, что переносимость клопидогреля лучше, при его применении меньше побочных эффектов. В ряде исследований получены лучшие результаты при использовании клопидогреля, в частности менее выраженные побочные явления и меньшая частота их возникновения. Однако не было выяснено, позволяет ли его применение уменьшить количество рестенозов.
Для решения этой проблемы доктор Eric J. Topol с коллегами из клиники Кливленда (США) выполнили метаанализ результатов трех рандомизированных исследований и семи исследований, проведенных медицинскими центрами. В их основе — сравнение результатов использования тиклопидина и клопидогреля у больных, которым была выполнена ангиопластика со стентированием. Общее число пациентов — 13 955. При применении клопидогреля количество осложнений составило 2,1 %, тиклопидина — 4,04 % (р < 0,001), смертность составила 1,09 % в группе тиклопидина и 0,48 % — в группе клопидогреля (р < 0,003). Лучшие результаты при использовании клопидогреля, по мнению авторов, могут объясняться более ранним началом его действия (влияние на тромбоцитарное звено) и лучшей переносимостью.
Безопасность и приверженность к антиагрегантной терапии
Назначение антиагрегантов позволило существенно снизить вероятность осложнений и продлить жизнь больных, однако сопряжено с рядом проблем, в первую очередь связанных с их безопасностью. Необходимо соотносить пользу и риск от применения данной группы препаратов с позиций доказательной медицины и современных клинических рекомендаций для наиболее эффективного и безопасного использования. В августе 2009 г. на конгрессе Европейского общества кардиологов в Барселоне были представлены результаты клинического исследования CURRENT-OASIS 7. В этом крупнейшем клиническом исследовании, включающем 25 087 пациентов с ИБС (ОКС, НС, ИМ без подъема сегмента ST, ИМ с подъемом сегмента ST), дана оценка различных режимов дозировки клопидогреля и АСК с целью оптимизации эффективности и безопасности применения двойной нагрузочной дозы клопидогреля (1-й день — 600 мг, 2–7-й дни — 150 мг, 8–10-й дни — 75 мг/сут) по сравнению с его стандартной дозировкой (1-й день — 500 мг, 2–30-й дни — 75 мг/сут). Результаты исследования CURRENT-OASIS 7 стали основанием для широкого использования в клинической практике нагрузочных и поддерживающих доз клопидогреля при двухкомпонентной антиагрегационной терапии различных форм ИБС.
Одной из современных проблем является низкая приверженность к приему пероральных антикоагулянтов. В новом когортном исследовании, проведенном исследовательской группой из Клиники Мейо, показано, что в реальной практике рекомендации по приему антикоагулянтов соблюдают лишь менее половины пациентов с фибрилляцией предсердий, даже если им был назначен один из пероральных антикоагулянтов. Авторы использовали крупную базу данных медицинского страхования в США, в которой был идентифицирован 64 661 пациент с фибрилляцией предсердий, начавший лечение варфарином или одним из трех зарегистрированных в стране антикоагулянтов в период с ноября 2010 по декабрь 2014 г. Медиана длительности наблюдения составила 1,1 года. В течение этого периода рекомендации по приему препарата в течение 80 % времени соблюдали не более 47,5 % принимавших антикоагулянты пациентов. Это было немного (хотя достоверно) выше, чем приверженность к приему варфарина: среди принимавших этот антагонист витамина К участников терапевтическая антикоагуляция в течение 80 % времени и более отмечалась лишь у 40,2 % пациентов (р < 0,001). Результаты были опубликованы в феврале 2016 года в журнале Journal of the American Heart Association.
По данным исследования COMMIT, на фоне приема клопидогреля с АСК большинство геморрагических осложнений не были жизнеугрожающими и отмечались лишь немногим чаще в группе двухкомпонентной антитромботической терапии (3,9 против 3,4 % в группе плацебо; р = 0,004). Частота развития фатальных и угрожающих жизни геморрагических осложнений, по данным этого же исследования, была одинаковой в обеих подгруппах (0,58 против 0,55 %; р = 0,59). Однако необходимо отметить, что в исследовании не применялась нагрузочная доза клопидогреля, а длительность двухкомпонентной антитромботической терапии составляла всего 2 нед. По данным исследования CURE, в группе клопидогреля по сравнению с группой плацебо отмечалось значительно больше случаев кровотечений (3,7 против 2,7 %; р = 0,001). Вместе с тем повышение риска ассоциировалось с увеличением дозы АСК, поскольку доза клопидогреля была фиксированной — 75 мг. При комбинации высокой дозы АСК (≥ 200 мг) и плацебо частота кровотечений была больше, чем при использовании клопидогреля в дозе 75 мг с низкой дозой АСК (≤ 100 мг), — 3,7 против 3,0 %. Эти результаты дают основание полагать, что польза двухкомпонентной антитромботической терапии при лечении больных с ОКС превосходит ее возможный риск, и одновременно оставляют резерв для возможности увеличения дозировок ее компонентов.
По результатам исследования, проведенного в Дании, большинство пациентов с ИМ, перенесших операцию АКШ, не принимают клопидогрель после выписки из стационара, несмотря на то что прием антиагрегантов улучшает результаты операции у таких больных. Dr. Rikke Sorensen (Copenhagen University Hospital, Дания) с коллегами провели анализ историй болезни пациентов (данные из пяти регистров), поступивших в больницы Дании с первым ИМ в период с 2002 по 2006 г. Предметом изучения было лечение, полученное больными, и его результаты у 3545 пациентов, которым была произведена реваскуляризация миокарда с использованием метода АКШ спустя 180 дней после ИМ и на 30-й день после выписки из стационара. Пациенты находились под наблюдением в среднем в течение 466 дней. Результаты исследования были опубликованы 8 марта 2011 г. в Journal of the American College of Cardiology.
В выводах говорится, что только 27 % пациентов, перенесших АКШ, получали лечение клопидогрелем после выписки из стационара, несмотря на то что в руководстве для специалистов, вышедшем в 2004 г., больным, перенесшим ИМ, рекомендуется принимать клопидогрель в течение 9–12 месяцев после операции. У пациентов, получавших клопидогрель, летальный исход или повторный ИМ были зарегистрированы в 4,1 % случаев, в то время как у не получавших клопидогрель частота этих осложнений составила 7,8 % (p = 0,0003). Отношение рисков развития ИМ у пациентов, получавших и не получавших клопидогрель, составило 0,59, летальный исход или повторный ИМ развился у 4 % больных, получавших клопидогрель, и у 6 % — не принимавших препарат (p = 0,05). Соответствующее отношение рисков составило 0,67 у получавших и не получавших клопидогрель. Хотя авторы стремились учесть возможные ошибки при сборе данных и минимизировать влияние различных факторов, отмечено, что проведение более крупного рандомизированного исследования позволило бы продвинуться гораздо дальше и получить более конкретные доказательства того, что рекомендованное назначение клопидогреля после выписки из стационара улучшает результаты проведенного АКШ у больных, перенесших ИМ (Sorensen R., Abildstrom S., Hansen P.R. et al. Efficacy of post-operative clopidogrel treatment in patients revascularized with coronary artery bypass grafting after myocardial infarction // J. Am. Coll. Cardiol. 2011; 57: 1202-1209).
Таким образом, в ходе многочисленных международных исследований клопидогрель зарекомендовал себя как высокоэффективный и безопасный антитромботический препарат, который является неотъемлемой частью современной терапии всех видов атеротромботических событий. Назначение препарата клопидогрель больным с ИМ и пациентам после ЧКВ со стентированием коронарных артерий не только необходимо с точки зрения его антитромботического действия, но и может обеспечить более высокую эффективность в предупреждении серьезных кардиоваскулярных событий. Доказанные эффективность и хорошая переносимость, доступность и однократный прием в сутки, возможность длительного применения позволяют рассматривать его как препарат первого выбора и признать использование клопидогреля обязательным элементом антитромботического лечения. Необходимость его применения не подвергается сомнению, однако в настоящее время остаются не до конца изученными вопросы, связанные с оптимальным режимом дозирования и длительностью его приема, а также проблемы лекарственного взаимодействия, что обусловливает необходимость дальнейших клинических испытаний.
Известно, что тщательное соблюдение международных рекомендаций по медикаментозной терапии ассоциируется с более благоприятным течением заболевания и лучшим прогнозом. Однако в реальности даже в странах Европы оптимальную терапию получают менее половины нуждающихся в ней пациентов. Существенным фактором, влияющим на доступность лечения, является его высокая стоимость. Одним из способов решения этой проблемы является производство генерических лекарственных средств. В последние годы генерические препараты клопидогреля были созданы и апробированы во многих странах. В Украине на заводе «Кусум Фарм» (г. Сумы) производится клопидогрель под торговым названием Платогрил. Препарат имеет доказанную биоэквивалентность оригинальному препарату. Цена препарата Платогрил доступна большинству пациентов. Можно надеяться, что наличие на украинском фармацевтическом рынке доступного по цене препарата европейского качества с доказанной эффективностью и безопасностью сделает возможным проведение адекватной антитромботической терапии у всех больных, которые в ней нуждаются.
О внесении изменений в инструкции по медицинскому применению клопидогрель-содержащих препаратов о риске снижения агрегации тромбоцитов при совместном применении с антиретровирусными лекарственными средствами
27.06.2019
Комитет по оценке рисков в сфере фармаконадзора (PRAC) Европейского медицинского агентства (EMA) по результатам рассмотрения имеющихся доказательств, включая данные литературных публикаций, данные базы нежелательных реакций EudraVigilance, пришел к выводу, что держателям регистрационных удостоверений клопидогрель-содержащих лекарственных средств необходимо в течение трех месяцев внести в инструкцию по медицинскому применению информацию о риске снижения агрегации тромбоцитов при совместном применении с антиретровирусными лекарственными средствами и мерам минимизации данного риска.
Департамент фармаконадзора и мониторинга безопасности, эффективности и качества медицинских изделий на основании пункта 48, 49 и 50 о внесении изменений в приказ МЗРК от 18 ноября 2009 года № 736 «Об утверждении Правил проведения экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» сообщает о необходимости внесения изменений в инструкции по медицинскому применению оригинального и генерических клопидогрель-содержащих лекарственных средств.
Раздел «Лекарственные взаимодействие» дополнить следующей информацией:
«У ВИЧ-инфицированных пациентов, получающих антиретровирусную терапию (АРТ), усиленную ритонавиром или кобицистатом, было продемонстрировано достоверное снижение плазменной концентрации активного метаболита клопидогреля и снижение подавления агрегации тромбоцитов.
Хотя клиническая значимость полученных результатов окончательно не подтверждена, в полученных спонтанных сообщениях описывались ВИЧ-инфицированные пациенты, получающие усиленную АРТ, у которых наблюдались случаи повторной окклюзии после эндоваскулярной реканализации или перенесенных тромботических явлений при применении нагрузочной дозы клопидогреля. Действие клопидогреля и средний уровень показателей ингибирования тромбоцитов может быть снижен при одновременном применении с ритонавиром. Исходя из вышесказанного, следует избегать одновременного назначения клопидогреля с усиленной АРТ».
Литература:
11 June 2019 EMA/PRAC/265212/2019 Pharmacovigilance Risk Assessment Committee (PRAC) PRAC recommendations on signals Adopted at the 13-16 May 2019 PRAC meeting http://www.ema.europa.eu
Эффективность, простота использования и удовлетворенность
Показать оценки и отзывы для
Эффективность
Значок всплывающей подсказки
Получивший наибольшее количество голосов положительный отзыв
41 Люди сочли этот комментарий полезным
Я принимаю это лекарство в течение одного месяца. Единственным побочным эффектом было то, что когда я порезался во время бритья, я не думал, что кровотечение остановится. За последние несколько дней я заметил, что чувствую себя лучше, чем когда-либо. После того, как я проехал на велосипеде 10 миль, мое время восстановления было короче, чем когда я проехал всего 5-7 миль до того, как мне установили стент и запустили этот препарат.
Общие обзоры и рейтинги
Состояние: Предотвращение образования тромбов после чрескожного коронарного вмешательства Эффективность Простота использования Удовлетворенность
Не слишком довольна болью в животе, это мучительная боль между и под моим ribcage
ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: лечение для предотвращения тромбоэмболии периферических артерий Эффективность Простота использования Удовлетворенность
Врач назначил мне это, чтобы предотвратить возможные проблемы с моими сонными артериями.Я принимал его в течение двух недель, а затем у меня появился неконтролируемый зуд в ладони, а затем сыпь и зуд по всему телу. Я перестал принимать. После МРА выяснилось, что все в порядке, но через три недели все еще чешется.
1 ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: лечение для предотвращения образования тромба в сосудистом стенке Эффективность Простота использования Удовлетворенность
Сегодня после двух недель приема этого препарата у меня отек губ и сильный зуд в ладонях обеих рук. руки
1 ShapeCreated with Sketch.thumb_up copy 5Создано в Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: предотвращение попадания сгустка крови в мозг Эффективность Простота использования Удовлетворенность
Единственные проблемы, которые у меня есть, это легкий синяк и следы крови на руках
1 ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: предотвращение образования тромба в мозгу Эффективность Простота использования Удовлетворенность
Никаких проблем не было, только у меня легко появлялись синяки, а порезы кровоточат гораздо дольше.Мне 42 года, два года назад у меня случился инсульт, и я, скорее всего, буду принимать этот препарат постоянно. Еще я принимаю аторвастаин, который был прописан, и его тоже нужно принимать ежедневно.
ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch.
ВАЖНАЯ ИНФОРМАЦИЯ О СОДЕРЖАНИИ ПОЛЬЗОВАТЕЛЯ НА WEBMD
Мнения, выраженные в областях пользовательского контента WebMD, таких как сообщества, обзоры, рейтинги или блоги, принадлежат исключительно Пользователю, который может иметь или не иметь медицинское или научное образование.Эти мнения не отражают точку зрения WebMD. Области контента, создаваемого пользователями, не проверяются врачом WebMD или любым членом редакционного персонала WebMD на предмет точности, сбалансированности, объективности или любой другой причины, за исключением соблюдения наших Положений и условий.
Подробнее
Эффективность, простота использования и удовлетворенность
Показать оценки и отзывы для
Эффективность
Значок всплывающей подсказки
Самый набранный положительный отзыв
77 Люди нашли этот комментарий полезным
Я принимал Плавикс 2 раза.Мне назначили лекарство после того, как в течение 1 года мне установили первый сердечный стент. прекратил прием лекарства.
Я принял его снова после того, как еще один сердечный стент принял его еще на год. Я сейчас не принимаю лекарства.
У меня не было проблем с плавиксом, кроме очень легко синяков.
Общие обзоры и оценки
Состояние: лечение для предотвращения сердечного приступа Эффективность Простота использования Удовлетворение
какого цвета
ShapeCreated with Sketch.thumb_up copy 5Создано в Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: предотвращение образования тромбов после чрескожного коронарного вмешательства Эффективность Простота использования Удовлетворенность
Я согласен с комментарием, сделанным «Что это за лицо». Плавикс — сильный разжижитель крови, длительное использование которого может привести к кровотечению в организме. Если бы я использовал его, я бы принимал только 1/2 таблетки каждый день.
ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: лечение для предотвращения образования тромба в сосудистом стенке Эффективность Простота использования Удовлетворенность 3 ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: Другое Эффективность Простота использования Удовлетворение Форма Создано с помощью Sketch.thumb_up copy 5Создано с помощью Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch. Состояние: предотвращение образования тромбов после чрескожного коронарного вмешательства Эффективность Простота использования Удовлетворенность
Плавикс вызвал у меня лекарственную волчанку. Меня беспокоят симптомы гриппа, озноб, усталость, просто ощущение, будто я болею гриппом или сильно заболею. Я рад, что это работает для большинства людей,
ShapeCreated with Sketch.thumb_up copy 5Created with Sketch. Пожаловаться на эту публикацию Fill 3Created with Sketch.
ВАЖНАЯ ИНФОРМАЦИЯ О СОДЕРЖАНИИ ПОЛЬЗОВАТЕЛЯ НА WEBMD
Мнения, выраженные в областях пользовательского контента WebMD, таких как сообщества, обзоры, рейтинги или блоги, принадлежат исключительно Пользователю, который может иметь или не иметь медицинское или научное образование. Эти мнения не отражают точку зрения WebMD. Области контента, создаваемого пользователями, не проверяются врачом WebMD или любым членом редакционного персонала WebMD на предмет точности, сбалансированности, объективности или любой другой причины, за исключением соблюдения наших Положений и условий.
Подробнее
Пользовательские обзоры на клопидогрель для Heart Attack
- Лекарства от А до Я
- Клопидогрель
- Отзывы пользователей
Также известен как:
Плавикс
Клопидогрел имеет средний рейтинг 7,9 из 10 из 27 оценок для лечения сердечного приступа.
78% тех, кто просматривал клопидогрел, сообщили о положительном эффекте, а 19% сообщили об отрицательном эффекте.
Фильтр по условию
Все состояния Острый коронарный синдром (3) Острый коронарный синдром, профилактика Сердечный приступ (33) Ишемический инсульт (14) Ишемический инсульт, профилактика (4) Инфаркт миокарда, профилактика Черепно-коронарное вмешательство (3) Угнетение периферических артериальных клеток (5) Заболевание периферических артерий (7) Ишемическая атака (6)
Обзор рейтингов клопидогреля
| 10 | 56% | |
|---|---|---|
| 9 | 11% | |
| 8 | 11% | |
| 7 | 4% | |
| 6 | 0% | |
| 5 | 0% | |
| 4 | 0% | |
| 3 | 0% | |
| 2 | 4% | |
| 1 | 15% |
Часто задаваемые вопросы
Больше FAQ
Эта информация НЕ предназначена для поддержки какого-либо конкретного лекарства.Хотя эти обзоры могут быть полезны, они не заменяют опыт, знания и суждения практикующих врачей.
Подробнее о сердечном приступе
IBM Watson Micromedex
Проверка симптомов
Симптомы и лечение
Центр здоровья Drugs.com
Справочная клиника Mayo Clinic
Подробнее о клопидогреле
Потребительские ресурсы
- Другие бренды
- Plavix
Профессиональные ресурсы
Соответствующие лечебные руководства
Клопидогрель, отзывы о препарате | www.meamedica.com
На этой странице представлена подробная информация о препарате, такая как статистика, отзывы пациентов и статьи по теме.
Действующее вещество: Клопидогрель
Код УВД: B01AC04.
Клопидогрель
Код АТХ: B01AC04, Действующее вещество: Клопидогрель
Уровень
Удовлетворенность
Что говорят пациенты…
Количество побочных эффектов 38%
Выраженность побочных эффектов 34%
Наши пациенты
Прочтите отзывы наших пациентов о Клопидогрел
Клопидогрель
31.07.2018 | | 54 модерируется Шарлоттой
Клопидогрель (75 мг) при инсульте
Клопидогрель
18.06.2018 | | 39 модерируется Филиппом
Клопидогрель (75 мг) при инсульте
Начиная с августа 2015 г. у меня дважды случился инфаркт мозга, вероятно, вызванный ПФО.Никаких побочных эффектов, пока работает нормально.
> прочитать обзор полностью …
Клопидогрель
03.03.2018 | | 67 модерируется Сьюзен
Клопидогрель (75 мг) при атеросклерозе
Выписал, когда лежал в больнице после 9 лет приема Асазантина после инфаркта головного мозга.Один в день вместо двух, как раньше. Прописал после проблемы с правой ногой, я уже потерял левую, и в моем возрасте это просто игра ожидания.
> прочитать обзор полностью …
Клопидогрель
24.11.2017 | | 70 модерируется Сьюзан
Клопидогрель (75 мг) при инсульте
У меня была ТИА.Я очень доволен таблетками, круглыми и не очень большими. Блистер работал нормально.
> прочитать обзор полностью …
Клопидогрель
06.10.2017 | | 70 модерируется Сьюзан
Клопидогрель (75 мг) при сердечном приступе
После сердечного приступа мне пришлось принимать этот антикоагулянт.Единственное, что я заметил, это то, что синяки у меня появляются намного легче. Но я думаю, это показывает, что он работает хорошо.
> прочитать обзор полностью …
Клопидогрель
16.04.2017 | | 70 модерируется Шарлоттой
Клопидогрель (75 мг) от боли в сердце
Мне поставили стент, после чего в течение года мне пришлось принимать это лекарство.Все мои мышцы болели, из-за чего я плохо спал. Есть ли лекарства получше, например, Плавикс. Было бы хорошо узнать.
> прочитать обзор полностью …
Клопидогрель
28.09.2016 | | 61 модерируется Филиппом
Клопидогрель (75 мг) при сердечном приступе
После установки стента.Первые два вмешательства (2 х 3 стента) пришлось взять Brilique. Множество побочных эффектов. Затрудненное дыхание и синяки. Для третьего вмешательства (через 8 месяцев) я перешел на 75 мг клопидогреля (по моей просьбе). По большей части исчезла одышка, с тех пор синяков больше не было. Установлен 7-й стент, и теперь я чувствую себя намного лучше.
> прочитать обзор полностью …
Клопидогрель
13.09.2016 | | 73 модерируется Филиппом
Клопидогрель (75 мг) при инсульте
После классической ТИА врач отделения A&E назначил мне клопидогрель 75 мг 1 раз в день вместо 100 мг карбазалааткальция для кардио.Побочные эффекты: одна гематома размером с ладонь и одна очень большая гематома на бедре, что привело к разрыву мышцы. Частые небольшие гематомы на коже при стуке.
> прочитать обзор полностью …
Клопидогрель
23.05.2016 | | 75 модерируется Филиппом
Клопидогрель (75 мг) при инсульте
К сожалению, я должен принять это, чтобы предотвратить возможный инсульт.У меня не было побочных эффектов, кроме изжоги, но они всегда были. Принимаю пантопразол. Я бы предпочел что-нибудь натуральное, но есть ли что-нибудь ….?
> прочитать обзор полностью …
Клопидогрель
14.05.2016 | | 72 модерируется Генри
Клопидогрель (75 мг) при инсульте
Я начал использовать аскаль и персантин.Мой невролог сказал мне, что теперь доступно другое лекарство. Одна таблетка, которая могла бы заменить их обоих (аскал и персантин). Мне это понравилось, на одну таблетку меньше. Но с тех пор, как я его использую, я заметил синие синяки и спонтанную экстравазацию, поэтому я собираюсь спросить невролога, могу ли я действительно вернуться к аскалу и персантину.
> прочитать обзор полностью …
Клопидогрель
11.05.2016 | | 75 модерируется Генри
Клопидогрель (75 мг) при инсульте
У меня случился инсульт во время операции на спине в июне 2014 года.После этого пришлось начать принимать Персантин. В ноябре 2015 года я спросил, есть ли другое лекарство вместо Персантина, потому что мне нужно было принимать одно два раза в день, а затем желудочные проктекторы. Он назывался дипиридимол, и я больше не хотел его принимать из-за побочных эффектов. Теперь я принимаю клопидогрель один раз в день по 1 пане.
> прочитать обзор полностью …
Клопидогрель
12.11.2015 | | 69 модерируется Генри
Клопидогрель (75 мг) при атеросклерозе
Поскольку у меня была операция на сонной артерии, я должен принимать клопидогрель 75А всю оставшуюся жизнь.У меня диарея, приступы кашля и одышка, когда я иду или езжу на велосипеде. Зуд тоже не был забавным. После того, как у меня была фирменная Teva, я получил небрендированную версию, и проблемы усугубились. Мой терапевт прописал мне Плавикс, он более дорогой и самый популярный у моих страховщиков. …
> прочитать обзор полностью …
Клопидогрель
11.11.2015 | | 65 модерируется Шарлоттой
Клопидогрель (75 мг) при сердечном приступе
После того, как мне установили стент, кардиолог сказал мне, что мне нужно принимать его целый год! Я испытал следующие побочные эффекты.Головная боль, мышечные спазмы и боли в суставах, плохое зрение, запор и боль в животе. У кого-нибудь еще был такой же опыт … и как они в конечном итоге были отсортированы?
> прочитать обзор полностью …
Лекарства, которые чаще всего рассматриваются
119
46
42
41 год
34
33
31 год
30
29
27
27
26 год
23
22
20
19
19
19
18
18
Содержимое этой страницы создается пользователями, читается и изменяется перед утверждением в соответствии с нашими стандартами проверки или реакции на наркотики.Мы не навязываем нашим пользователям какие-либо подтвержденные медицинские знания, чтобы они могли поделиться своим опытом. Таким образом, описанные мнения и опыт отражают только точку зрения авторов, а не владельца этого веб-сайта. Помните, что этот опыт отличается от человека к человеку, и что вам всегда следует обращаться к своему врачу или фармацевту за советом о лекарствах.
Разжижители крови: прасугрель против клопидогреля
Недавно одобренный препарат разжижает кровь быстрее, стабильнее и сильнее, чем стандартный препарат, который может не предотвратить смертельные тромбы у пациентов после того, как они пройдут обычную процедуру для предотвращения или лечения сердечного приступа.Но новый препарат, прасугрел (Effient), , также с большей вероятностью может вызвать потенциально смертельное кровотечение.
В целом, прасугрел во многих случаях может превосходить утвержденную дозу более старого препарата, клопидогреля (плавикс), . Но все больше врачей используют начальную дозу клопидогреля, превышающую стандартную, для повышения его эффективности, и неясно, как эта схема сочетается с прасугрелем по ключевым клиническим исходам. Принятие решения о том, кому, скорее всего, помогут — или навредят — различные варианты, требует внимательного рассмотрения многих факторов.
Острый коронарный синдром — нестабильная стенокардия (нарастающая боль в груди, связанная с сердцем) или прогрессирующий сердечный приступ — часто лечат чрескожным коронарным вмешательством (ЧКВ) или ангиопластикой, при которой кардиологи надувают крошечный баллончик внутри заблокированной артерии. При надувании препятствие прижимается к стенке артерии, проход расширяется, и кровь течет свободно. Чтобы предотвратить образование тромбов, которые могут снова заблокировать артерию после процедуры, врачи прописывают лекарства, которые подавляют действие тромбоцитов или тромбоцитов.
Прасугрель в организме преобразуется в активную форму значительно быстрее, чем клопидогрель. Действительно, утвержденная доза клопидогреля в 300 мг требует нескольких часов для достижения полной силы — потенциально значительный недостаток во время коронарного криза. Более того, клопидогрель, по крайней мере в более низкой дозе, не работает должным образом у значительного меньшинства пациентов, которые могут быть генетически устойчивыми к лекарству.
Но есть загвоздка: антиагреганты повышают вероятность кровотечений, а прасугрел, похоже, повышает этот риск больше, чем утвержденная доза клопидогреля.Действительно, вкладыш в упаковке прасугрела содержит предупреждение в виде черного ящика, самое сильное, об этом риске кровотечения, которое иногда заканчивается смертельным исходом.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов основало свое одобрение прасугрела в основном на многоцентровом клиническом исследовании с участием 13 608 пациентов, в котором его сравнивали с одобренной дозой клопидогрела для пациентов с острым коронарным синдромом, которым назначено ЧКВ; все они также получали аспирин. В течение следующих 6-15 месяцев преимущества прасугрела обычно перевешивали его риски.На каждые 1000 пролеченных пациентов он предотвратил на 24 сердечных приступа, инсульта и сердечно-сосудистых смертей больше, чем клопидогрель, и вызвал только на 10 случаев серьезных или смертельных кровотечений.
Прасугрель особенно полезен людям с диабетом. Но риск кровотечения превышал преимущества у тех, у кого в анамнезе были инсульты или преходящие ишемические атаки (мимолетные, похожие на инсульт симптомы). Он не имел преимущества перед клопидогрелом в двух других группах с повышенным риском кровотечения: у людей старше 75 лет или с массой тела менее 130 фунтов.А у тех, кто нуждался в операции аортокоронарного шунтирования после ЧКВ, риск при приеме прасугрела был значительно выше, чем при применении более старого препарата.
Но это исследование оставляет без ответа по крайней мере один важный вопрос: как прасугрел сравнивается с большей дозой клопидогреля 600 мг? Американский колледж кардиологии и Американская кардиологическая ассоциация теперь рекомендуют его как обычно предпочтительный вариант до или во время выполнения ЧКВ. И результаты недавнего клинического исследования показывают, что эта удвоенная доза может в целом превосходить утвержденную дозу.(Врачи могут по закону прописать неутвержденные, но разумные дозы и способы использования любых одобренных лекарств.)
Одно исследование показало, что прасугрель может подавлять активность тромбоцитов в большей степени, чем даже удвоенная доза клопидогреля; Эксперты говорят, что у некоторых пациентов устойчивость будет развиваться даже при более высоких дозах клопидогреля. Но остается неизвестным, приводит ли это потенциальное преимущество к меньшему количеству тромбов, сердечных приступов и инсультов. Какой режим вызывает меньшее кровотечение, также не определено.
Потенциальные потребители прасугрела должны знать о другом исследовательском наблюдении: по прошествии четырех месяцев у тех, кто принимал прасугрел, по-видимому, наблюдался повышенный риск раковых опухолей, чем у тех, кто принимал клопидогрель.Это могло произойти либо случайно, либо потому, что более высокая частота кровотечений требует более тщательного изучения и выявления рака. FDA не включило рак в список рисков, перечисленных во вкладыше к упаковке, хотя вкратце упомянуло о возможности в другом месте. Но он действительно приказал производителю продолжить работу над другим клиническим испытанием, которое уже ведется, чтобы оценить потенциал препарата вызывать рак.
Роль клопидогреля в 2020 году: переоценка
Антитромбоцитарная терапия является основой лечения и вторичной профилактики сердечно-сосудистых заболеваний (ССЗ), включая острый коронарный синдром (ОКС), транзиторную ишемическую атаку (ТИА) или малый инсульт, а также периферические артерии болезнь (ЗПА).Ингибиторы P2Y 12 , из которых клопидогрел был первым, играют важную роль в антитромбоцитарной терапии и, следовательно, в лечении и вторичной профилактике сердечно-сосудистых заболеваний. В этом обзоре обсуждаются имеющиеся данные, касающиеся антитромбоцитарной терапии у пациентов с сердечно-сосудистыми заболеваниями, с акцентом на роль клопидогреля. В сочетании с аспирином клопидогрель часто используется как часть двойной антитромбоцитарной терапии (ДАТТ) для вторичной профилактики ОКС. Хотя более новые, более сильные ингибиторы P2Y 12 (прасугрел и тикагрелор) демонстрируют большее снижение ишемического риска по сравнению с клопидогрелом в рандомизированных исследованиях пациентов с ОКС, эти новые ингибиторы P2Y 12 часто связаны с повышенным риском кровотечения.У некоторых пациентов с ОКС может потребоваться деэскалация ДАТТ путем перехода с прасугрела или тикагрелора на клопидогрель. Более того, реальные исследования пациентов с ОКС не подтвердили преимуществ новых ингибиторов P2Y 12 по сравнению с клопидогрелом. Пациентам с ТИА или инсультом очень высокого риска рекомендуется краткосрочная ДАТТ с клопидогрелом плюс аспирин в течение 21–28 дней с последующей монотерапией клопидогрелом на срок до 90 дней. Монотерапия клопидогрелом также может применяться у пациентов с симптоматическим ЗПА.В заключение, есть убедительные доказательства, подтверждающие использование антиагрегантной терапии клопидогрелом в нескольких клинических условиях, что подчеркивает важность этого препарата в клинической практике.
1. Введение
За последние несколько десятилетий наблюдается рост заболеваемости и распространенности сердечно-сосудистых заболеваний (ССЗ), включая острый коронарный синдром (ОКС), который стал ведущей причиной смертности и заболеваемости во всем мире [1 –5]. Количество смертей от сердечно-сосудистых заболеваний увеличилось на 12.5% за последнее десятилетие, что составляет примерно одну треть всех смертей в мире, в основном из-за роста населения и старения [3]. Пациенты с ОКС имеют повышенный риск новых ишемических событий [6, 7], а ишемическая болезнь сердца и инсульт являются основными причинами глобального бремени ССЗ [3].
У пациентов с сердечно-сосудистыми заболеваниями активация тромбоцитов запускается поврежденным или дисфункциональным эндотелием сосудов, что приводит к агрегации тромбоцитов и последующему образованию патологических тромбов и ишемическим событиям [8].Следовательно, антитромбоцитарная терапия является основой лечения и вторичной профилактики сердечно-сосудистых заболеваний. Первым лекарством, используемым в качестве антитромбоцитарного агента, был аспирин, конкурентный ингибитор циклооксигеназы, который снижает синтез тромбоксана A 2 и подавляет агрегацию тромбоцитов. Добавление ингибитора P2Y 12 в качестве второго антитромбоцитарного агента обеспечивает дальнейшее подавление функции тромбоцитов по дополнительному пути и показало значительные преимущества в снижении ишемических осложнений у пациентов с сердечно-сосудистыми заболеваниями.Таким образом, двойная антитромбоцитарная терапия (ДАТТ) является краеугольным камнем антитромботической терапии в нескольких клинических условиях, включая ОКС и ишемический инсульт [5, 9, 10].
Ингибитор P2Y 12 клопидогрель при добавлении к аспирину широко исследовался как часть DAPT. Клопидогрель — это тиенопиридин второго поколения, который был представлен в Соединенных Штатах (США) в 1998 году. Он вводится как неактивное пролекарство, при этом примерно 50% абсорбируется через желудочно-кишечный тракт с помощью переносчика оттока лекарственного средства Р-гликопротеина.Пролекарство требует печеночной конверсии с помощью ферментов цитохрома (CYP) P450, в основном 2C19, для производства активного метаболита. Следовательно, чувствительность к клопидогрелу может быть уменьшена путем одновременного приема препаратов, которые конкурентно ингибируют ферменты CYP [11, 12]. Кроме того, наблюдалась индивидуальная вариабельность ответа на клопидогрель из-за множества факторов, включая возраст, лекарственные взаимодействия, сопутствующие заболевания (например, диабет или почечную недостаточность) и генетический полиморфизм [13].
Прасугрель и тикагрелор представляют собой ингибиторы P2Y 12 третьего поколения, которые были разработаны для решения проблемы медленного проявления и гетерогенных ингибирующих свойств клопидогреля тромбоцитов.У пациентов с ОКС рандомизированные контролируемые исследования (РКИ) показали большее снижение повторяющихся ишемических событий при применении этих новых препаратов по сравнению с клопидогрелом [14–17]. Однако новые ингибиторы P2Y 12 были связаны с повышенным риском нефатальных кровотечений, что ограничивало пользу.
За последние несколько лет возникло несколько интересных вопросов, касающихся использования ингибиторов P2Y 12 . Во-первых, клопидогрел был включен в качестве препарата сравнения в РКИ тикагрелора и прасугреля [14–17], и хотя большинство пациентов с ОКС получают тикагрелор или прасугрел, клопидогрель по-прежнему широко назначается [18].Во-вторых, использование ингибиторов P2Y 12 нового поколения связано с повышенными затратами и повышенным риском кровотечения [16, 17, 19–21], а также с побочными эффектами, не связанными с кровотечением (например, одышкой при применении тикагрелора) [22]. . Следовательно, деэскалация при антитромбоцитарной терапии (т.е. переход от более новых более мощных ингибиторов P2Y 12 на клопидогрель) стала частью терапии, адаптированной к этапам [23]. Наконец, реальные исследования не подтвердили преимущества новых ингибиторов P2Y 12 над клопидогрелем в отношении эффективности и безопасности.Например, исследование CHANGE DAPT у пациентов с ОКС, получавших чрескожное коронарное вмешательство (ЧКВ), показало, что DAPT с тикагрелором была связана с повышенным риском неблагоприятных клинических и церебральных событий по сравнению с клопидогрелом [24], в отличие от исследования PLATO, которое показали уменьшение этих событий с тикагрелором [17]. Эти данные могут иметь значительное влияние на использование DAPT, и поэтому точная роль клопидогреля и новых ингибиторов P2Y 12 в различных клинических условиях еще предстоит определить.
В этом обзоре представлено всестороннее и критическое обсуждение имеющихся данных об использовании антитромбоцитов у пациентов с сердечно-сосудистыми заболеваниями, с акцентом на роль клопидогреля во вторичной профилактике ОКС, транзиторной ишемической атаки (ТИА) или малого инсульта и периферических артерий болезнь (ЗПА).
2. Клопидогрель при ОКС: аргументы в пользу деэскалации терапии
Глобальный регистр острых коронарных событий (GRACE) у пациентов с подозрением на ОКС показал, что, несмотря на вторичную профилактическую терапию, 7.1% пациентов умерли, 6,3% страдали сердечной недостаточностью (СН) и 4,4% пережили повторный инфаркт в течение первых 2 лет после ОКС [6]. Текущие руководства США и Европы рекомендуют ДАТТ у пациентов с ОКС [5, 25], а европейские рекомендации по реваскуляризации миокарда 2018 г. рекомендуют использовать прасугрел и тикагрелор вместо клопидогреля [23]. Прасугрель и тикагрелор эффективны при процедурном инфаркте миокарда в острой фазе ОКС из-за их способности повышать концентрацию в крови [23].
За последние несколько лет количество тромботических осложнений уменьшилось благодаря использованию стентов с лекарственным покрытием (DES) последнего поколения и более мощных ингибиторов P2Y 12 , в то время как осведомленность о влиянии кровотечений на неблагоприятные исходы, в том числе смертность, повысилась. увеличилось [26].В результате снижение риска кровотечений стало одной из основных целей DAPT, и в руководствах рекомендуется, чтобы при выборе лечения учитывался баланс пользы и риска между риском ишемии и кровотечений [23]. Необходимость оптимального баланса между ишемическим эффектом и риском кровотечения, а также снижением риска некровотечных побочных эффектов, таких как одышка, связанная с тикагрелором, или / и затрат, связанных с долгосрочным использованием новых ингибиторов P2Y 12 , имеет привело к развитию «деэскалации» DAPT (т.например, переход от более сильного ингибитора P2Y 12 к менее сильному, обычно клопидогрелу) [23].
Деэскалация появилась как среднесрочная и долгосрочная стратегия уменьшения кровотечений у пациентов после ЧКВ, когда риск тромбоза снижается, но риск кровотечения сохраняется, а также у пациентов, которые считаются неподходящими для долгосрочного приема сильнодействующих и более дорогих антиагрегантов (например, с высоким риском кровотечения или низким социально-экономическим статусом), а в клинических испытаниях оценивали преимущества деэскалации DAPT у пациентов с ОКС [27, 28].
2.1. Тестирование функции тромбоцитов
Тестирование функции тромбоцитов (PFT) может использоваться для оценки индивидуальной реакции на антитромбоцитарную терапию [29, 30]. Высокая реактивность тромбоцитов (HPR) во время лечения была связана с повышенным риском сердечно-сосудистых событий, включая тромбоз стента, в то время как низкая реактивность тромбоцитов (LPR) может приводить к усиленному ответу на ингибиторы P2Y 12 и повышенному риску кровотечения [29 –31]. В исследовании ARMYDA-2 PFT использовался для оценки того, может ли ударная доза 600 мг клопидогреля достичь более быстрого максимального ингибирования тромбоцитов, чем ударная доза 300 мг, с конечной целью предоставления индивидуализированной антитромбоцитарной терапии на основе результатов PFT [32] .Ударная доза клопидогреля 600 мг в настоящее время является стандартным подходом при применении этого препарата у пациентов, перенесших ЧКВ. Однако отсутствие стандартизированной методологии PFT и аналитической вариативности может привести к неправильной интерпретации результатов PFT [33].
РКИ, оценивающие клиническую пользу PFT для корректировки антитромбоцитарной терапии во время или в начале после PCI, включая GRAVITAS [34], TRIGGER-PCI [35], ARCTIC [36] и ANTARCTIC [37], не смогли продемонстрировать клинических преимуществ PFT. Одна из причин неудач этих исследований может заключаться в том, что пациенты с HPR были рандомизированы для продолжения приема клопидогреля или перехода на более мощный ингибитор P2Y 12 , несмотря на тот факт, что предыдущие исследования уже продемонстрировали, что положительная прогностическая ценность HPR для рецидивирующей ишемии событий низкий (<60%).Учитывая очень высокую отрицательную прогностическую ценность адекватного ответа на клопидогрель (> 90%), более подходящим подходом были бы исследования по изучению ишемических событий с продолжением приема клопидогреля по сравнению с переходом на тикагрелор у пациентов без HPR, с первичным анализом не меньшей эффективности продолжения приема клопидогреля. .
Предыдущая версия европейских руководств по реваскуляризации миокарда рекомендовала ограничить использование PFT или генетического тестирования определенными пациентами с высоким риском (например,g., те, у кого в анамнезе был тромбоз стента, проблемы с комплаентностью, подозрение на резистентность или высокий риск кровотечения) [38]. Однако, учитывая повышенный риск кровотечения при применении новых антитромбоцитарных препаратов и связанный с ними побочный эффект, который может привести к прекращению лечения, в РКИ были изучены альтернативные стратегии деэскалации, которые могут включать роль ПФП.
В исследовании TOPIC изучались исходы у пациентов с ОКС ( n = 646) после перехода на клопидогрел через 1 месяц после ОКС по сравнению с продолжением приема прасугрела или тикагрелора [27].Через 1 год после ОКС комбинированная конечная точка — смерть от сердечно-сосудистых заболеваний, инсульт, незапланированная госпитализация, приведшая к реваскуляризации, или кровотечение категории ≥2, определенное Консорциумом академических исследований кровотечений (BARC), — наблюдалась у значительно большего числа пациентов, продолжавших принимать прасугрел или тикагрелор, по сравнению с теми, кто перешел на клопидогрель [27]. Другие ограничения TOPIC включали одноцентровый и открытый дизайн, ограниченный размер выборки, количество пациентов, потерянных для последующего наблюдения или перехода в другую группу лечения, превышающее общее количество событий для многих отдельных конечных точек, профиль пациента с низким риском, отсутствие данных об ИМ без реваскуляризации и недостаточная мощность исследования в отношении тромбоза стента.Несмотря на эти ограничения, TOPIC было первым РКИ, в котором оценивалась стратегия деэскалации, не руководствовавшаяся PFT. Более того, не было значительных различий в ишемических осложнениях через 1 год при приеме прасугрела или тикагрелора по сравнению с клопидогрелом, что привело к чистой клинической пользе в пользу перехода на ДАТТ на основе клопидогреля [27].
В исследовании TROPICAL-ACS деэскалация DAPT под контролем PFT (ранний переход с прасугрела на клопидогрель) не уступала прасугрелу через 1 год в отношении риска сердечно-сосудистой смерти, инфаркта миокарда (ИМ) или инсульта (далее упоминается). как основные неблагоприятные сердечно-сосудистые события (MACE)) после ЧКВ по поводу ОКС [28].Это исследование было важным, поскольку оно представляло сравнение отсутствия PFT (более нового ингибитора P2Y 12 ) и стратегии, основанной на PFT. Однако некоторые ограничения TROPICAL-ACS заключались в том, что 40% пациентов в группе деэскалации требовали возврата к прасугрелу (тем самым сводя на нет любое преимущество кровотечения), и что трудно воспроизвести это исследование в клинической практике, так как было два терапевтических препарата. изменения через 2 недели. Кроме того, не использовалась ударная доза клопидогрела, не упоминалось о переходных событиях, более высокая, чем ожидалось, доля пациентов, принимавших прасугрел, имела HPR (15%), а данные в соответствии с типом антитромбоцитарной терапии в группе под контролем PFT не были в наличии [28].Были представлены доказательства того, что HPR является изменяемым фактором риска, при этом HPR на прасугреле ассоциируется с повышенным риском ишемических событий, а LPR является независимым предиктором кровотечения как при приеме прасугрела, так и при приеме клопидогрела.
Основываясь на данных этих исследований, недавние клинические руководства рекомендуют деэскалацию DAPT как стратегию, которую можно рассматривать как альтернативный вариант лечения пациентов с ОКС. Европейские рекомендации по реваскуляризации миокарда 2018 г. теперь рекомендуют рассматривать стратегию деэскалации DAPT под контролем PFT в качестве альтернативной стратегии DAPT, особенно у пациентов с ACS, у которых 12-месячная мощная антиагрегантная терапия может быть нецелесообразной [23].Более того, недавнее консенсусное заявление поддерживает деэскалацию под контролем PFT или генотипа, хотя эти эксперты заявили, что у пациентов, подвергающихся ЧКВ, деэскалация под контролем PFT может рассматриваться только в определенных клинических сценариях [39].
2.2. Тестирование генотипа
В недавнем рандомизированном контролируемом исследовании была изучена польза выбора антиагрегантной терапии на основе генотипа у пациентов, перенесших первичное ЧКВ с имплантацией стента ( n = 2488) [40]. В этом исследовании пациенты были назначены на терапию ингибитором P2Y 12 на основании раннего генетического тестирования CYP2C19 (группа на основе генотипа) или тикагрелора или прасугреля (группа стандартного лечения).В течение 12 месяцев терапия на основе генотипа не уступала стандартной терапии в отношении комбинированного чистого неблагоприятного клинического исхода смерти от любой причины, ИМ, определенного тромбоза стента, инсульта или большого кровотечения PLATO (5,1% против 5,9%; 95% ДИ , От −2,0 до 0,7; для неполноценности). Однако риск первичного кровотечения был значительно снижен при терапии на основе генотипа по сравнению со стандартным лечением (9,8% против 12,5%; отношение рисков (HR) 0,78; 95% ДИ от 0,61 до 0,98;). Следует отметить, что генотипирование CYP2C19 в этом исследовании было выполнено с использованием центральных лабораторных анализов или устройства для оказания медицинской помощи [40], которые представляют собой быстрые и простые методы выбора на основе генотипа пероральных ингибиторов P2Y 12 [41] .Кроме того, персонализированный фармакогеномный подход к выбору антитромбоцитарной терапии для пациентов с ОКС на основе генетических (таких как CYP2C19) и клинических характеристик пациента может уменьшить количество ишемических и кровотечений [42]. Кроме того, известно, что этническая и расовая изменчивость метаболизма лекарств вносит свой вклад в полиморфную экспрессию метаболизирующих ферментов [41]. Преимущества тестирования полиморфизма CYP2C19 перед назначением клопидогреля пациентам, получавшим имплантацию стента с лекарственным покрытием после ЧКВ, были предложены в некоторых исследованиях, в основном в азиатских популяциях [43].Однако генетические полиморфизмы могут объяснить только 12% вариабельности ответа на клопидогрель [44], о чем свидетельствует субоптимальное соответствие между генотипом и фенотипом подисследования ARCTIC-Gene [45].
2.3. Деэскалация DAPT у пациентов из группы высокого риска
В реальном исследовании итальянских пациентов с ACS и диабетом ( n = 559), DAPT был назначен при выписке из больницы у 88% пациентов (39%, 38% и 23% получали клопидогрель, тикагрелор и прасугрел соответственно) [46].Авторы пришли к выводу, что это подтверждает «парадокс» использования менее эффективных препаратов для лечения более больных пациентов в этой группе высокого риска [46]. Однако особенности повышенного риска ишемии могут также предсказывать более высокий риск кровотечения, что также может объяснять широкое применение клопидогреля. Было показано, что наличие диабета увеличивает риск ишемических событий, но также значительно увеличивает риск кровотечений. Таким образом, данные этого реального исследования показывают, что врачи используют «очень раннюю деэскалацию», прописывая при выписке из больницы лекарства, которые они считают лучшим вариантом для снижения риска тромбоза и кровотечения у этих пациентов с высоким риском.
Риск кровотечения вызывает особую озабоченность у пожилых пациентов, которые составляют значительную часть пациентов с ОКС; однако эта популяция пациентов была недостаточно представлена в исследованиях PLATO и TRITON [16, 17]. В недавно представленном исследовании POPular AGE у пациентов в возрасте ≥70 лет с ОКСбпST после 12 месяцев приверженность к лечению составила 76% клопидогрела по сравнению с 51% при использовании тикагрелора [47]. Наиболее частыми причинами отмены тикагрелора были кровотечение, начало приема пероральных антикоагулянтов и одышка.Относительный риск большого или малого кровотечения был значительно снижен на 26% при приеме клопидогреля, при этом большое кровотечение PLATO было зарегистрировано у 4,4% пациентов, принимавших клопидогрел, по сравнению с 8% при приеме тикагрелора или прасугрела. Чистая клиническая польза (определяемая как совокупность смертности от всех причин, инфаркта миокарда, инсульта или большого или незначительного кровотечения PLATO) показала абсолютную разницу в риске 3,4% в пользу клопидогреля, что не достигло заранее установленного порогового значения не меньшей эффективности [47 ]. Аналогичным образом, исследование ACS 2 для пожилых людей с участием пациентов в возрасте> 74 лет с ОКС, перенесших ЧКВ, было преждевременно прекращено после того, как запланированный промежуточный анализ не обнаружил существенной разницы между прасугрелом в сниженных дозах и клопидогрелом в стандартной дозировке в отношении первичной конечной точки (совокупность смерти, ИМ, инвалидизирующий инсульт или повторная госпитализация по поводу сердечно-сосудистых заболеваний или кровотечения) [48].В этом исследовании частота кровотечений BARC> 2 была сходной между прасугрелом и клопидогрелом (4,1% против 2,7%; отношение шансов (ОШ) 1,52; 95% ДИ от 0,85 до 3,16;) [48]. Хотя данные исследования ACS 2 для пожилых людей следует интерпретировать с осторожностью из-за его преждевременного прекращения, они предполагают отсутствие разницы в эффективности и безопасности между прасугрелом и клопидогрелом у пожилых пациентов с ACS.
3. Клопидогрель в ОКС: исследования в реальных условиях
Хотя РКИ считаются золотым стандартом клинических исследований, участники РКИ часто отличаются от пациентов, получающих лечение в обычной клинической практике, что может ограничивать обобщаемость результатов РКИ.В связи с этим проводится все большее количество поставторизационных (фаза IV) реальных исследований антитромбоцитарной терапии у пациентов с ОКС.
Группа PIRAEUS объединила данные из 10 европейских регистров ACS, чтобы получить исчерпывающий обзор эффективности и безопасности ингибиторов P2Y 12 у пациентов с ИМпST и ОКС без подъема сегмента ST (NSTE-ACS) в реальной жизни. клиническая практика [49–51]. Характеристики пациентов и основные исходы пациентов с NSTE-ACS и STEMI, получавших DAPT, показали аналогичные показатели смертности, ишемических событий и кровотечений, чем те, о которых сообщалось в РКИ различных ингибиторов P2Y 12 .Тем не менее, были обнаружены важные различия в использовании и выборе пациентов между клопидогрелом, прасугрелом и тикагрелором. Во всех реестрах зарегистрировано большое количество пациентов, получавших клопидогрел, и меньшее количество пациентов, получавших прасугрел, а использование тикагрелора было зарегистрировано только в ограниченном количестве реестров. Кроме того, клопидогрель назначали пожилым и более тяжелым пациентам [51]. Хотя сопоставимость результатов ограничена различиями между реестрами в условиях исследования, определениях конечных точек и выборе пациентов, PIRAEUS подчеркивает важность стандартизированного сбора данных для обеспечения более надежного общего анализа нескольких реестров [50, 51].
В исследование реестра PROMETHEUS были включены пациенты с ОКС, перенесшие ЧКВ в восьми центрах США, чтобы определить частоту использования прасугрела и ее связь с клиническими исходами в этой популяции пациентов [52]. Использование прасугрела было связано со значительно более низкой частотой MACE (HR, 0,58; 95% ДИ, от 0,50 до 0,67;) и кровотечений (HR, 0,65; 95% CI, 0,51-0,83;) через 90 дней по сравнению с клопидогрелом. Однако эти ассоциации были ослаблены и перестали быть значимыми после стратификации предрасположенности, поскольку пациенты, получавшие прасугрел, в целом были моложе и имели меньше сопутствующих заболеваний, чем пациенты, получавшие клопидогрель [52].
В исследовании реестра GRAPE изучалась долгосрочная эффективность и безопасность клопидогреля, прасугрела и тикагрелора у реальных пациентов с острым ОКС, перенесших ЧКВ [53]. Через 1 год наблюдения частота MACE была ниже при приеме прасугрела по сравнению с клопидогрелом (4,4% против 10,1%; ОР 0,53; 95% ДИ от 0,30 до 0,91), но была аналогичной для тикагрелора и клопидогрела (6,8% против 10,1%). ; HR 0,78; 95% ДИ от 0,54 до 1,12). По сравнению с клопидогрелом, риск кровотечения любого типа, классифицированного по классификации BARC, был выше при приеме прасугрела (HR, 1.61; 95% ДИ от 1,33 до 1,95) и тикагрелора (HR 1,81; 95% ДИ от 1,55 до 2,10). Скорректированное сравнение не показало разницы в результатах между пациентами, получавшими прасугрел и тикагрелор. В этом исследовании сделан вывод о том, что у пациентов с ОКС, получавших ЧКВ, прасугрел показал лучшие антиишемические свойства по сравнению с клопидогрелом, хотя использование прасугреля и тикагрелора было связано с повышенным риском кровотечений [53].
Следует отметить различия в исходных характеристиках пациентов между тремя группами ингибиторов P2Y 12 при интерпретации результатов исследования реестра GRAPE [53].Факторы риска ишемических или кровотечений были более распространены среди пациентов в группе клопидогрела, чем у пациентов, получавших прасугрел или тикагрелор (т. Е. Они были старше, чаще были женщины, и у них в анамнезе была гипертензия, предшествующий инсульт или нарушение функции почек) [53]. Подобные ошибки отбора пациентов ранее сообщались в реальных исследованиях, сравнивающих клопидогрель с другими ингибиторами P2Y 12 [54–56]. Кроме того, в исследовании реестра SWEDEHEART пациентов с ОКС, получавших или не получавших ЧКВ, показатели смертности были ниже при применении тикагрелора по сравнению с клопидогрелом, но значительно большее количество пациентов, принимавших тикагрелор, получали ЧКВ, а тикагрелор преимущественно использовался у пациентов с низким риском кровотечения и смерти (на что указывают более низкие оценки CRUSADE и GRACE, соответственно) [57, 58].
Текущие рекомендации рекомендуют использовать тикагрелор вместо клопидогреля у пациентов с ОКС, в основном на основе результатов рандомизированного исследования PLATO [17]. В PLATO тикагрелор значительно снижал риск MACE на 16% через 12 месяцев по сравнению с клопидогрелом (ОР 0,84; 95% ДИ 0,77–0,92;), но был связан с увеличением частоты крупных кровотечений, связанных с некоронарным шунтированием ( 4,5% против 3,8%;) [17].
Примечательно, что более 60% пациентов в PLATO, перенесших ЧКВ, получили голые металлические стенты (BMS), и большинство DES были устройствами первого поколения [17].Поскольку стали доступны DES нового поколения с более тонкими стойками стента, покрытыми более биосовместимыми или биоразлагаемыми полимерными покрытиями, клинические результаты улучшились по сравнению с BMS и DES первого поколения [59–61]. Таким образом, в клинической практике большинство пациентов с ОКС лечатся с помощью DES нового поколения, которые показали благоприятные результаты с помощью DAPT на основе клопидогреля в РКИ [62, 63].
В реальном исследовании CHANGE DAPT оценивалась безопасность и эффективность режима ДАТТ на основе тикагрелора и клопидогреля у пациентов с ОКС, получавших DES нового поколения [24].В многофакторном анализе, скорректированном по шкале предрасположенности, тикагрелор был связан с повышенным риском комбинированной конечной точки чистых неблагоприятных клинических и церебральных событий (определяемых как смерть от всех причин, любой ИМ, инсульт или большое кровотечение; ОР 1,75; 95% ДИ От 1,20 до 2,55;) и сильного кровотечения (ОР 2,75; 95% ДИ от 1,34 до 5,61;) по сравнению с клопидогрелом [24]. Эти результаты согласуются с данными реестра GRAPE [53]. Более того, при CHANGE DAPT повышенный риск кровотечения при применении тикагрелора наблюдался, несмотря на большее количество трансрадиальных процедур, большее применение ингибиторов помпы и меньшее использование ингибиторов гликопротеина IIb / IIIa, факторов, которые могут уменьшить перипроцедурное кровотечение [24].Эти данные также согласуются с исследованием TOPIC, в котором переход с прасугрела или тикагрелора на клопидогрель через 1 месяц после ЧКВ не был связан со значительными изменениями в исходах ишемии, но приводил к меньшему количеству кровотечений [27]. Таким образом, реальные исследования не подтверждают более высокую эффективность новых ингибиторов P2Y 12 по сравнению с клопидогрелем у пациентов с ОКС, получавших ЧКВ, и необходимы новые исследования по этой теме.
Помимо того, что клопидогрель эффективен и безопасен для пациентов с ОКС, исследования показали, что клопидогрель является рентабельным для этой популяции пациентов с расчетным соотношением рентабельности приблизительно 3000 долларов на год жизни [64, 65].Следовательно, согласно критериям Всемирной организации здравоохранения, клопидогрель экономически эффективен в странах с валовым внутренним продуктом более 1000 долларов на душу населения [66].
4. Клопидогрель при транзиторной ишемической атаке и остром инсульте
Характерной чертой ТИА и малых ишемических инсультов является быстрое выздоровление от симптомов церебральной ишемии [67, 68]. Это быстрое клиническое выздоровление может указывать на наличие ишемической ткани из группы риска, патофизиологический признак, который может быть ответственным за большую нестабильность [68, 69].Следовательно, хотя ТИА и малый инсульт не вызывают симптомов инвалидности, они часто предшествуют более тяжелому инсульту или другим сосудистым событиям [70, 71]. Систематический обзор и метаанализ показали, что риск инсульта составил 17% в течение 90 дней после ТИА [71], а в популяционном исследовании базы данных комбинированный риск инсульта, инфаркта миокарда или смерти был на 22% выше. наблюдение через 1 год после ТИА [72]. Более недавнее исследование реестра ТИА показало, что риск повторного ТИА или инсульта оставался одинаковым в течение 1–5 лет после индексного события [73].
Раннее начало антиагрегантной терапии рекомендуется пациентам с некардиоэмболическим инсультом или ТИА для предотвращения повторного инсульта или сердечно-сосудистых событий. В популяционном исследовании EXPRESS раннее лечение после ТИА было связано с 80% снижением 90-дневного риска повторного инсульта [74]. В другом исследовании ранний риск повторного инсульта был значительно ниже у пациентов, получивших быструю оценку и лечение ТИА, по сравнению со стандартным лечением (9,7% против 4.7%; ) [75].
Аспирин является наиболее распространенным антиагрегантом, используемым для лечения пациентов с ТИА или инсультом в анамнезе, поскольку он снижает риск рецидива инсульта. РКИ продемонстрировали, что ДАТТ также может быть эффективным у этих пациентов [76–79]. Однако до недавнего времени в итальянских руководствах указывалось, что DAPT следует рассматривать только для отдельных пациентов с ТИА высокого риска и незначительным инсультом и в течение короткого периода (2-3 недели) после начала инсульта [80].
4.1. ДАПТ для вторичной профилактики ТИА или инсульта
В нескольких РКИ изучалась эффективность и безопасность ДАТТ для вторичной профилактики у пациентов с ТИА или инсультом в анамнезе.
В исследовании MATCH с участием 7599 пациентов с недавним анамнезом ТИА или инсульта, аспирин плюс клопидогрель существенно не снижали риск комбинированной первичной конечной точки ишемического инсульта, ИМ, обострения заболевания периферических артерий, сосудистой смерти или повторной госпитализации по поводу острая ишемия по сравнению с плацебо плюс клопидогрел в течение 18 месяцев (снижение относительного риска, 6,4%; 95% ДИ, от -4,6 до 20,4;) [78]. Однако частота опасных для жизни кровотечений была выше при приеме аспирина плюс клопидогрель по сравнению с одним клопидогрелом (2.6% против 1,3%; разница 1,3%; 95% ДИ от 0,6 до 1,9; ). Таким образом, это исследование показало, что добавление аспирина к клопидогрелю у пациентов из группы высокого риска не привело к значительному снижению основных сосудистых событий и было связано с повышенным риском большого кровотечения [78]. Более того, кровотечения оставались постоянными на протяжении всего исследования, что может указывать на то, что существует временной интервал, по истечении которого риск кровотечения может перевесить любую пользу от ишемии.
В исследовании CHANCE с участием 5170 китайских пациентов с ишемическим инсультом, не приводящим к инвалидности, или ТИА, клопидогрель плюс аспирин в течение 21 дня с последующим приемом одного клопидогрела в течение 69 дней (ДАПТ) снижали риск рецидива ишемического и геморрагического инсульта по сравнению с одним аспирином на 32% ( 8.2% против 11,7%; HR 0,68; 95% ДИ от 0,57 до 0,81; ) [81]. DAPT ассоциировался с аналогичной частотой умеренных или тяжелых кровотечений (0,3% в каждой группе;) или геморрагического инсульта (0,3% в каждой группе;) по сравнению с одним аспирином [81]. Интересно, что в группе клопидогрела плюс аспирин по-прежнему был значительно более низкий риск инсульта после 1 года наблюдения (ОР 0,78; 95% ДИ от 0,65 до 0,93;) [82]. Эти данные показывают, что ДАТТ с аспирином и клопидогрелом, начатая в течение 24 часов после индексного события, превосходит только аспирин в предотвращении риска инсульта без увеличения риска кровотечения у пациентов с ТИА или легким инсультом [81].
Возможность обобщения результатов CHANCE может быть поставлена под сомнение, поскольку исследование проводилось полностью в Китае, в популяции с более высокой частотой внутричерепного атеросклероза крупных артерий, чем в других странах. Кроме того, CHANCE провела скрининг 41 561 пациента с инсультом или ТИА, чтобы найти 5 170 (12,4%) подходящих субъектов для включения в исследование, и пациенты с большим ишемическим инсультом, которые находятся в группе риска геморрагической трансформации, были исключены [81]. Наконец, результаты этого исследования не могут быть обобщены более чем через 90 дней после индексного события, поскольку после этого совокупный риск кровотечения при приеме клопидогрела плюс аспирин по сравнению с одним аспирином сводит на нет преимущества, как показано в более ранних исследованиях [77, 78, 83].
В исследовании POINT сравнивалась безопасность и эффективность клопидогрела в сочетании с аспирином и только аспирина в некитайской популяции из 4881 пациента с ишемическим инсультом, не приводящим к инвалидности, или ТИА [84]. В течение 12 часов после появления симптомов пациенты были рандомизированы для приема либо клопидогрела (ударная доза 600 мг, а затем 75 мг в день) плюс аспирин (50–325 мг в день) или только аспирин в течение 90 дней. Клопидогрель плюс аспирин был связан со значительно более низким риском серьезных ишемических событий (ишемический инсульт, инфаркт миокарда или ишемическая смерть сосудов) по сравнению с одним аспирином (5.0% против 6,5%; ЧСС 0,75; 95% ДИ от 0,59 до 0,95; ) и более высокий риск большого кровотечения через 90 дней (0,9% против 0,4%; ОР 2,32; 95% ДИ от 1,10 до 4,87;) [84]. Этот более высокий риск обширного кровотечения, вероятно, был связан с большей продолжительностью терапии клопидогрелем и аспирином и высокой начальной нагрузочной дозой клопидогрела (600 мг), использованной в исследовании POINT. Примечательно, что результаты POINT подтверждают и расширяют результаты исследования CHANCE, подтверждая гипотезу о том, что эффективное использование DAPT для ранней вторичной профилактики инсульта связано с этнической принадлежностью [84].
В предварительно заданном вторичном анализе POINT частота первичных событий эффективности при приеме клопидогрела плюс аспирин составляла 3,6% в течение 0–21 дня и 1,4% в течение 22–90 дней по сравнению с 5,6% в течение 0–21 дня и 0,9% в течение 22–21 дней. 90 дней только с аспирином [85]. Напротив, частота серьезных кровотечений оставалась постоянной в обеих группах в течение 90 дней (0,4% в течение 0–21 дня и 0,5% в течение 22–90 дней при приеме клопидогрела плюс аспирин по сравнению с 0,2% в течение 0–21 дня и 0,2% в течение 22–90 дней). 90 дней только с аспирином) [85].Эти результаты в сочетании с результатами исследования CHANCE показывают, что оптимальная продолжительность DAPT (клопидогрель плюс аспирин) составляет 21–28 дней. Более того, результаты CHANCE предполагают, что после первой фазы ДАТТ (22–90 дней) один клопидогрель более эффективен, чем один аспирин, по сравнению с 22–90 днями, без повышенного риска кровотечения [81]. Недавние метарегрессии 11 РКИ и 24 175 пациентов показали, что наибольшая польза от ДАТТ с точки зрения предотвращения повторного инсульта наблюдалась у пациентов с более высоким исходным профилем риска, повышенной тяжести инсульта или сопутствующей патологией сонной артерии, а также у пациентов, получавших раннее начало DAPT в течение ≤3 месяцев [86].
При рассмотрении эффекта новых ингибиторов P2Y 12 исследование SOCRATES показало, что тикагрелор не превосходит аспирин в снижении риска инсульта, инфаркта миокарда или смерти через 90 дней у пациентов с острым ишемическим инсультом или ТИА [87] . Хотя не было значительных различий в частоте серьезных нежелательных явлений между группами, окончательное прекращение приема тикагрелора чаще происходило в основном из-за одышки (известный побочный эффект тикагрелора [17, 88]) [87]. Интересно, что в метаанализе 12 РКИ аспирина по сравнению с контролем во вторичной профилактике после ТИА или ишемического инсульта ( n = 15778), аспирин снижал 6-недельный риск повторного ишемического инсульта на 58% (HR, 0.42; 95% ДИ от 0,32 до 0,55; ) и инвалидизирующим или смертельным ишемическим инсультом на 71% (HR, 0,29; 95% CI, от 0,20 до 0,42;), но эти преимущества уменьшались при более длительном применении [89]. Эти данные подтверждают необходимость более интенсивной антитромбоцитарной терапии (DAPT) в раннем послеродовом периоде, когда риск ишемии выше, и менее интенсивного лечения после этого, чтобы свести к минимуму риск кровотечений.
В рекомендациях Американской кардиологической ассоциации / Американской ассоциации по инсульту 2018 г. рекомендуется использование ДАТТ (аспирин и клопидогрель) в течение 21 дня у пациентов с легким инсультом (класс рекомендации IIa, уровень доказательности BR) [10], а также обновленные данные 2018 г. В канадских рекомендациях по инсульту предлагается ДАТТ с клопидогрелом плюс аспирин в течение 21-30 дней с последующей монотерапией аспирином или только клопидогрелом у пациентов очень высокого риска с ТИА (оценка ABCD2> 4) или легким инсультом некардиоэмболического происхождения (уровень доказательности A) [90 ].В 2018 г. рабочая группа Итальянской организации по инсульту (ISO) — Профилактика инсульта и распространение информации (SPREAD) рекомендовала ДАТТ с аспирином плюс клопидогрель в течение 30 дней пациентам с легким инсультом или ТИА [91].
5. Клопидогрель при заболевании периферических артерий
Заболевание периферических артерий (ЗПА) характеризуется сужением или закупоркой артерий нижних конечностей вследствие атеросклероза. Термин «заболевания периферических артерий» охватывает все атеросклеротические заболевания артерий, кроме коронарных артерий и аорты [92].ЗПА представляет собой глобальную проблему здравоохранения с высокими уровнями сопутствующей заболеваемости и смертности и предполагаемой общей распространенностью 3–10% и 15–20% среди лиц в возрасте> 70 лет [93]. Ожидается, что это бремя значительно возрастет в течение следующих 20 лет из-за старения населения и изменений факторов риска атеросклероза. За 10-летний период (2000–2010 гг.) ЗПА была заметно более распространена в странах с низким или средним уровнем доходов, чем в странах с высоким уровнем доходов [94].
Факторы риска ЗПА включают пожилой возраст, диабет, гиперлипидемию, гипертонию, курение и атеросклероз в других местах [95].На начальной клинической стадии ЗПА обычно протекает бессимптомно. Наиболее частым первым симптомом является перемежающаяся хромота (IC), определяемая как боль в нижних конечностях, вызванная физической нагрузкой, которая быстро проходит в покое [93]. Прогрессирование заболевания может привести к критической ишемии конечностей (CLI), определяемой как боль в покое или ишемическое изъязвление и гангрена [93], что связано с серьезным нарушением функции нижних конечностей и высоким риском ампутации, особенно у пациентов, которые не могут пройти хирургическая или эндоваскулярная реваскуляризация [96].Кроме того, пациенты с ЗПА обычно имеют многососудистое заболевание, а также могут иметь ишемическую болезнь сердца (ИБС) или заболевание артерий головного мозга, что еще больше снижает качество их жизни [97]. Пациенты с симптоматической или бессимптомной ЗПА имеют повышенный риск общей смертности, смертности от сердечно-сосудистых заболеваний, ИМ и инсульта даже после поправки на общепринятые факторы риска [92, 95].
Целью лечения ЗПА является облегчение симптомов и предотвращение прогрессирования заболевания и осложнений [92].Медицинское лечение включает изменения образа жизни, такие как изменение диеты и повышение физической активности, а также изменение факторов риска, например прекращение курения и назначение гипотензивных и гиполипидемических препаратов [92]. Поскольку факторы риска сердечно-сосудистых заболеваний могут привести к развитию атеросклероза и атеротромбоза из-за активации тромбоцитов [98, 99], антиагрегантная терапия в дополнение к модификации факторов риска является отличительным методом лечения для уменьшения сердечно-сосудистых событий у пациентов с ЗПА [92].
5.1. Антитромбоцитарная терапия при ЗПА
В рекомендациях Европейского общества кардиологов (ESC) / Европейского общества сосудистой хирургии (ESVS) от 2017 г. указано, что длительная однократная антиагрегантная терапия рекомендуется пациентам с симптомами ЗПА (класс рекомендации I, уровень доказательности A) и у всех пациентов, перенесших реваскуляризацию (класс рекомендации I, уровень доказательности C) [92]. В обоих случаях клопидогрель может быть предпочтительнее аспирина (класс рекомендации IIb, уровень доказательности B) [92].Однако антиагрегантная терапия обычно не показана пациентам с изолированной бессимптомной ЗПА из-за отсутствия доказанной пользы.
Эти рекомендации основаны, по крайней мере частично, на результатах исследования CAPRIE [100]. В этом исследовании с участием 19 185 пациентов с инфарктом миокарда, ишемическим инсультом или симптоматической ЗПА в анамнезе относительный риск первичного исхода (MACE) был значительно снижен при приеме клопидогреля по сравнению с аспирином (5,3% против 5,8%; снижение относительного риска 8,7%; 95% ДИ, 0.От 30 до 16,5; ) [100]. Хотя эти результаты предполагают, что длительная терапия клопидогрелом может превосходить аспирин в снижении риска сосудистых событий, эти преимущества были незначительными. Однако преимущество клопидогреля перед аспирином в основном было обусловлено значительным эффектом, продемонстрированным у пациентов с ЗПА, что повышает вероятность того, что клопидогрель и аспирин обладают эквивалентной эффективностью у пациентов с ИМ. В подгруппе пациентов с симптоматической ЗПА на исходном уровне ( n = 6,452) клопидогрель был связан со снижением на 22% по сравнению с аспирином относительного риска MACE (HR, 0.78; 95% ДИ от 0,65 до 0,93), а также значительное снижение риска смерти от сердечно-сосудистых заболеваний (ОР 0,76; 95% ДИ от 0,64 до 0,91). Обе группы лечения имели сопоставимую частоту серьезных кровотечений [100].
В исследовании CHARISMA ДАПТ с клопидогрелом плюс аспирин не была более эффективной, чем монотерапия аспирином, в предотвращении первичного исхода MACE у пациентов со стабильным атеросклеротическим заболеванием или множественными сердечно-сосудистыми факторами риска ( n = 15 603) [77]. Апостериорный анализ участников CHARISMA с ЗПА ( n = 3096) показал, что первичный результат наступил с одинаковой скоростью при приеме клопидогрела плюс аспирин по сравнению с монотерапией аспирином (7.6% против 8,9%; ЧСС 0,85; 95% ДИ, от 0,66 до 1,08; ) [101]. Однако DAPT снижает риск других вторичных конечных точек, таких как ИМ (ОР 0,63; 95% ДИ от 0,42 до 0,96;) и частоту госпитализаций по поводу ишемических событий (ОР 0,81; 95% ДИ от 0,68 до 0,95;) . При приеме клопидогреля плюс аспирин частота незначительных кровотечений увеличивалась по сравнению с одним аспирином (ОШ, 1,99; 95% ДИ, 1,69–2,34;), хотя частота тяжелых, смертельных или умеренных кровотечений не различалась между группами [101] .
В ретроспективном анализе исследования PLATO [17] пациенты с коронарной болезнью и сопутствующей ЗПА показали некоторое ишемическое преимущество при применении тикагрелора по сравнению с клопидогрелом [102], а в исследовании PEGASUS-TIMI 54 пациентов с предшествующим ИМ ( n = 21 162), пациенты с сопутствующей ЗПА ( n = 1143) показали значительно большее снижение абсолютного риска МАСЕ при приеме тикагрелора по сравнению с пациентами без ЗПА [103].
Большинство исследований, изучающих эффект антитромбоцитарной терапии при атеротромботических заболеваниях высокого риска, были сосредоточены на пациентах с ОКС и стабильной ИБС. Исследование EUCLID было разработано для оценки антитромбоцитарной терапии тикагрелором по сравнению с клопидогрелом у пациентов с симптоматической ЗПА ( n = 13 885) [104]. В этом исследовании частота первичной конечной точки эффективности (MACE) была аналогичной для тикагрелора и клопидогреля (10,8% против 10,6%; ОР 1,02; 95% ДИ от 0,92 до 1,13;) и первичной конечной точки безопасности (сильное кровотечение). произошло в 1.6% пациентов в обеих группах (ОР 1,10; 95% ДИ 0,84–1,43;). Частота острой ишемии конечностей и реваскуляризации была сходной между группами, тогда как относительный риск ишемического инсульта был значительно снижен при приеме тикагрелора по сравнению с клопидогрелом (1,9% против 2,4%; ОР 0,78; 95% ДИ от 0,62 до 0,98;). Было меньше случаев смертельных кровотечений при приеме тикагрелора, но больше случаев прекращения приема тикагрелора, чем клопидогрела, включая прекращение приема из-за кровотечения [104]. Таким образом, несмотря на то, что в более ранних исследованиях была продемонстрирована определенная польза у пациентов с ЗПА, монотерапия тикагрелором, более мощным ингибитором P2Y 12 , чем клопидогрел, не продемонстрировала какого-либо преимущества по сравнению с монотерапией клопидогрелом в снижении частоты неблагоприятных сердечно-сосудистых событий в исследовании EUCLID и показали аналогичную частоту серьезных кровотечений.
Интересно, что исследование COMPASS по применению ривароксабана (с аспирином или без него) у пациентов со стабильным ССЗ [105] может помочь уточнить наше понимание роли антитромбоцитарных и антитромботических стратегий у пациентов с ЗПА. В COMPASS, который включал пациентов с установленной ИБС, ЗПА или и тем, и другим, первичная конечная точка эффективности (MACE) наблюдалась у 4,1% пациентов в группе ривароксабана плюс аспирин, 4,9% в группе монотерапии ривароксабаном и 5,4% в группе монотерапии аспирином группа, представляющая снижение относительного риска MACE на 24% при приеме низких доз ривароксабана плюс аспирин по сравнению с одним аспирином (HR, 0.76; 95% ДИ от 0,66 до 0,86; ) [105]. Ривароксабан плюс аспирин также ассоциировался со снижением общей смертности по сравнению с одним аспирином (3,4% против 4,1%; ОР 0,82; 95% ДИ 0,71–0,96;). Напротив, применение одного ривароксабана было связано со значительным снижением риска MACE по сравнению с одним аспирином (ОР 0,90; 95% ДИ 0,79–1,03;). Сообщалось о более серьезных кровотечениях при монотерапии ривароксабаном и аспирином (3,1%) или монотерапии ривароксабаном (2,8%), чем при монотерапии аспирином (1.9%; для обоих сравнений) [105]. В предварительно определенном анализе пациентов с ЗПА в исследовании COMPASS ( n = 7470) было отмечено снижение риска MACE на 28%, снижение риска серьезных неблагоприятных событий со стороны конечностей (MALE) на 46% и Снижение риска серьезных ампутаций на 70% при применении ривароксабана с аспирином по сравнению с одним аспирином [106]. Однако при приеме ривароксабана в сочетании с аспирином наблюдалась повышенная частота больших и малых кровотечений по сравнению с монотерапией аспирином.
Интригующий вопрос, возникающий в результате критического анализа результатов исследования COMPASS: почему аспирин был выбран в качестве средства сравнения в этом исследовании? Учитывая, что почти у трети пациентов в исследовании была ЗПА, и данные несколько противоречивые доказательства в пользу аспирина в этих клинических условиях [107] по сравнению с таковым клопидогреля в исследованиях, таких как CAPRIE [100], гипотетически могут быть разные результаты. ожидается при сравнении ривароксабана и клопидогреля.Тем не менее, учитывая пределы косвенных сравнений и различия в дизайне вышеупомянутых исследований, эти данные позволяют предположить, что у пациентов с ЗПА безопасность одного клопидогреля может быть лучше, чем безопасность ривароксабана плюс аспирин, с сопоставимой эффективностью в отношении MACE.
6. Выводы
Деэскалация с тикагрелора или прасугрела на клопидогрель рекомендуется пациентам с ОКС для достижения оптимального баланса между ишемической пользой и риском кровотечения, а также для снижения риска побочных эффектов (таких как одышка) и / или связанных с этим повышенных затрат. при длительном применении новых ингибиторов P2Y 12 .Может быть предпочтительна деэскалация DAPT на основе генотипа. Более того, клопидогрель можно считать препаратом первого выбора для антитромбоцитарной терапии у пожилых пациентов с ОКС. Результаты реальных исследований поставили под сомнение более высокую эффективность новых ингибиторов P2Y 12 по сравнению с клопидогрелем у пациентов с ОКС, получавших ЧКВ.
Пациентам с инсультом или ТИА с очень высоким риском следует назначать интенсивную ДАТТ с аспирином и клопидогрелом в течение 21–28 дней после острого события с последующим менее интенсивным лечением до 90 дней, чтобы свести к минимуму риск кровотечений. ; клопидогрель потенциально более эффективен, чем аспирин, в качестве антиагрегантной монотерапии.Согласно результатам исследований CAPRIE и EUCLID, у пациентов с симптоматической ЗПА или у тех, кто прошел периферическую реваскуляризацию, клопидогрель является предпочтительным средством для монотерапии антитромбоцитами.
В заключение, учитывая убедительные доказательства, подтверждающие эффективность, безопасность и рентабельность клопидогреля для антитромбоцитарной терапии в нескольких различных клинических условиях, его известность в медицинском сообществе, его широкую доступность и низкую стоимость, клопидогрель остается важным лекарством. в клинической практике и является основой антиагрегантной терапии.
Конфликты интересов
GP является спикером / консультантом / консультативным советом для Amgen, Sanofi, Bayer, Boehringer-Ingelheim, BMS-Pfizer, Daiichi Sankyo, Astra Zeneca, Sigma-Tau, Malesci, PIAM и MSD. GM является спикером / консультантом Sanofi, Bayer и BMS-Pfizer. CC получила гонорары за консультационные услуги от Sanofi, Bayer, BMS-Pfizer и Daiichi Sankyo. LB является спикером / консультантом / консультативным советом компаний Amgen, Sanofi, Bayer, BMS-Pfizer, Daiichi Sankyo и Astra Zeneca.
Благодарности
Авторы хотели бы поблагодарить доктора Эрнана Поло Фриз и Сару Грейг из Springer Healthcare Communications, которые написали план и первый черновик этой рукописи.Помощь в написании медицинских документов финансировалась Санофи.
Клопидогрель Артикул
[1]
Wang XH, Tao L, Zhou ZH, Li XQ, Chen HS, Антиагрегант против R-tPA при остром легком ишемическом инсульте: проспективное, случайное и открытое многоцентровое исследование. Международный журнал инсульта: официальный журнал Международного общества инсульта. 2019 25 марта; [PubMed PMID: 30
1]
[2]
Лу Х, Гуань В., Чжоу Й, Тан З., Бао Х, кангрелор или клопидогрель у пациентов с сахарным диабетом 2 типа, подвергающихся чрескожному коронарному вмешательству: метаанализ рандомизированных контролируемых исследований.Диабетотерапия: исследование, лечение и обучение диабету и связанных с ним расстройствах. 2019 март 23; [PubMed PMID: 30
7]
[3]
Jackevicius CA, An J, Ko DT, Ross JS, Angraal S, Wallach JD, Koh M, Song J, Krumholz HM, Материалы SPRINT Data Analysis Challenge по прогнозированию клинического риска: перекрестная оценка. BMJ открыт. 2019 март 23; [PubMed PMID: 30
8]
[4]
Berwanger O, Lopes RD, Moia DDF, Fonseca FA, Jiang L, Goodman SG, Nicholls SJ, Parkhomenko A, Averkov O, Tajer C, Malaga G, Saraiva JFK, Guimaraes HP, de Barros E Silva PGM, Damiani LP, Santos RHN, Paisani DM, Miranda TA, Valeis N, Piegas LS, Granger CB, White HD, Nicolau JC, Тикагрелор по сравнению с клопидогрелом у пациентов с ИМпST, леченных фибринолитической терапией: TREAT Trial.Журнал Американского колледжа кардиологии. 2019 12 марта; [PubMed PMID: 30898608]
[5]
Лю Цзинь, Сян Ц., Му Г, Се Ц., Чжоу С., Ван З, Чен С., Ху К., Гун И, Цзян Дж, Цуй У., Эффективность и безопасность ингибиторов рецепторов ADP -P2Y12 тромбоцитов, на которые влияет статус курения: A Систематический обзор и метаанализ. Журнал Американской кардиологической ассоциации. 2 апреля 2019 г .; [PubMed PMID: 30898054]
[6]
Ма К., Чен Г.З., Чжан Ю.Х., Чжан Л., Хуанг Л.А., Клинические результаты и прогностическая модель реактивности тромбоцитов на клопидогрел после острых ишемических сосудистых событий.Китайский медицинский журнал. 2019 марта 19; [PubMed PMID: 30896564]
[7]
Pop C, Matei C, Petris A, Антикоагуляция при остром коронарном синдроме: обзор основных терапевтических достижений. Американский журнал терапии. 2019 март / апрель; [PubMed PMID: 30839367]
[8]
Holm M, Biancari F, Khodabandeh S, Gherli R, Airaksinen J, Mariscalco G, Gatti G, Reichart D, Onorati F, De Feo M, Santarpino G, Rubino AS, Maselli D, Santini F, Nicolini F, Zanobini M, Киннунен Э.М., Руджиери В.Г., Перротти А., Розато С., Дален М., Кровотечение у пациентов, получавших тикагрелор или клопидогрель перед шунтированием коронарной артерии.Летопись торакальной хирургии. 2019 марта 19; [PubMed PMID: 30898561]
[9]
Хикс Г.Л. Младший, Кровотечение у пациентов, получавших тикагрелор или клопидогрель перед шунтированием коронарной артерии (комментарий). Летопись торакальной хирургии. 2019 16 марта; [PubMed PMID: 308
]
.