Биологическая роль калия — это… Что такое Биологическая роль калия?
Калий (K) | |
|---|---|
| Атомный номер | 19 |
| Внешний вид простого вещества | Серебристо-белый мягкий металл |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,0983 а. е. м. (г/моль) |
| Радиус атома | 235 пм |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 4s1 |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность (по Полингу) | 0,82 |
| Электродный потенциал | -2,92В |
| Степени окисления | 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 0,856 г/см³ |
| Удельная теплоёмкость | 0,753 Дж/(K·моль) |
| Теплопроводность | 79,0 Вт/(м·K) |
| Температура плавления | 336,8 K |
| Теплота плавления | 102,5 кДж/моль |
| Температура кипения | 1047 K |
| Теплота испарения | 2,33 кДж/моль |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированая |
| Период решётки | 5,230 Å |
| Отношение c/a | n/a |
| Температура Дебая | 100,00 K |
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
Ка́лий — химический элемент с атомным номером 19 в периодической системе, обозначается символом K (лат. Kalium), мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щелочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
Kalium), мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щелочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щелок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 г. английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
potassium; это название до сих пор употребительно в английском, французском, испанском, португальском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl•NaCl, карналлита KCl•MgCl2•6H2O, каинита KCl•MgSO4•6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав почти всех растений.
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650°C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K+ + e— → K
2Cl— — 2e— → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH— — 4e— → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов)
Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими, как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды и пероксиды
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
- 2K + 2O2 → K2O4
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
- K2O4 + 6K → 4K2O
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
- 2K2O4 + 2CO2 → 2K2CO3 + 3O2
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г. воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.

Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Бихромат (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.

- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений
- Поддержание осмотической концентрации крови
- Поддержание кислотно-щелочного баланса
- Нормализация водного баланса
- Обеспечение мембранного транспорта
- Активация многих энзимов
- Нормализация ритма сердца
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Необходимость в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
Ссылки
Литература
- Пилипенко А.Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na | Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tс, Mn, Te, Rh, Po, Tl, Hg, Ag, Pb, Pd, Os, Ir, Pt, Au | |
| → активность металлов → |
Wikimedia Foundation.
2010.
Калий биологическая роль — Справочник химика 21
Какова биологическая роль натрия и калия [c.244]
Образование многочисленных фосфорных эфиров в процессе окисления различных веществ в животном организме играет важную биологическую роль. Дело в том, что при расщеплении связей фосфорной кислоты с углеродом в условиях животного организма освобождается большое количество энергии (12 000 кал на 1 моль фосфорной кислоты), в силу чего эта связь на- [c.296]
Для поддержания жизни, как показано в настоящее время, существенное значение имеют около 20 элементов, хотя живая ткань часто содержит в следовых количествах все элементы, находящиеся в окружающей среде. Основные элементы живых систем — это водород, углерод, азот и кислород (2—60 ат. %). Установлено, что из всех элементов, присутствующих в следовых количествах (0,02—0,1 ат. %), фосфор, сера, хлор, натрий, калий, магний и кальций необходимы для поддержания процессов жизнедеятельности.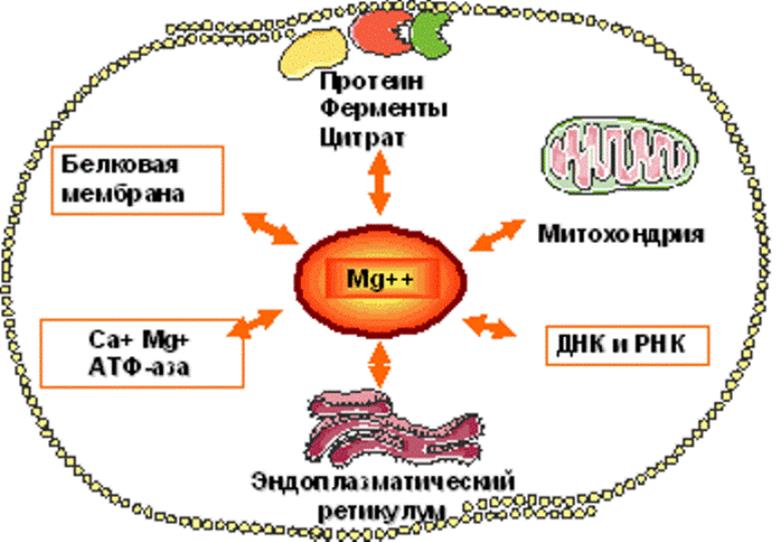 Некоторые из элементов, присутствующих в сверхмалых количествах (менее 0,001 ат. %), также относятся к числу необходимых. Это марганец, железо и медь. Весьма вероятно, что ванадий, кобальт, молибден, бор и кремний также имеют общее биологическое значение, однако показать, что тот или иной элемент, присутствующий в сверхмалых количествах, биологически необходим, часто весьма трудно. В отдельных случаях биологическая роль элемента для растений и животных может быть установлена по тем последствиям, которые вызывает его отсутствие в почве. Так, отсутствие меди в почве некоторых районов Австралии вызвало нарушения в нервной системе овец и привело к заболеванию их анемией и к выпадению шерсти. Утверждалось также, что недостаток в почве бора приводит к аномалиям в развитии свеклы и сельдерея и к ухудшению качества [c.7]
Некоторые из элементов, присутствующих в сверхмалых количествах (менее 0,001 ат. %), также относятся к числу необходимых. Это марганец, железо и медь. Весьма вероятно, что ванадий, кобальт, молибден, бор и кремний также имеют общее биологическое значение, однако показать, что тот или иной элемент, присутствующий в сверхмалых количествах, биологически необходим, часто весьма трудно. В отдельных случаях биологическая роль элемента для растений и животных может быть установлена по тем последствиям, которые вызывает его отсутствие в почве. Так, отсутствие меди в почве некоторых районов Австралии вызвало нарушения в нервной системе овец и привело к заболеванию их анемией и к выпадению шерсти. Утверждалось также, что недостаток в почве бора приводит к аномалиям в развитии свеклы и сельдерея и к ухудшению качества [c.7]
В природе с белками связано относительно небольшое число металлов. Если рассматривать также ферменты, активируемые металлами, то к этому списку элементов следует добавить лишь натрий, калий и магний. Биологическая роль иона металла в белке характеризуется высокой специфичностью. И тем не менее в зависимости от типа белка один и тот же ион металла осуществляет различные функции разнообразие выполняемых функций является, очевидно, следствием ограничений, накладываемых белковым окружением. В связи с этим биологическая специфичность функций металла имеет, по-видимому,- стереохимическую природу. Основная тема обзора — значение структурных и стереохимических данных и сведений о строении координационных центров металл —лиганд для выяснения функциональной роли металлов в ферментативных процессах — не требует, таким образом, дополнительного обоснования. [c.16]
Биологическая роль иона металла в белке характеризуется высокой специфичностью. И тем не менее в зависимости от типа белка один и тот же ион металла осуществляет различные функции разнообразие выполняемых функций является, очевидно, следствием ограничений, накладываемых белковым окружением. В связи с этим биологическая специфичность функций металла имеет, по-видимому,- стереохимическую природу. Основная тема обзора — значение структурных и стереохимических данных и сведений о строении координационных центров металл —лиганд для выяснения функциональной роли металлов в ферментативных процессах — не требует, таким образом, дополнительного обоснования. [c.16]
Липиды играют важную биологическую роль они являются источником энергии для животного организма, при окислении в организме 1 г жира выделяется 9,3 кал. Они хорошие растворители биологически активных веществ (например, витаминов), необходимы для осуществления нормальных функций животного организма. Жировая ткань образует мягкую изолирующую прослойку, защищая внутренние органы и все тело от толчков, ударов и переохлаждения. [c.267]
[c.267]
Собственно, все, о чем рассказано выше,— тоже на тему калий — человеку . А здесь коротко — о биологической роли элемента № 19 в жизни наиболее сложного из живых организмов Земли. [c.293]
Вообще ионные соединения переходных металлов, по всем данным, были теми каталитическими стимуляторами, которые направили ход эволюции в определенное русло и способствовали синтезу предбиологических соединений. Ионные соединения действуют в этом смысле более активно, если в их кристаллических решетках имеются различные дефекты , функционирующие как активные центры катализа. Другая роль ионов сводилась к активации органических катализаторов. На нынешнем этапе развития биологических систем ионы натрия, калия, кальция, магния действуют в ферментных системах как активаторы, иногда проявляя способность к взаимозаменяемости. [c.145]
В животных организмах калий необходим для нормальной ра боты мышечных клеток и нервной системы. Нормальный ритм ра боты организма, в частности ритм сокращения сердца, поддержи вается при определенном соотношении концентраций ионов калия и натрия. Оценивая роль ионов калия и натрия в развивающихся системах — клетках и организмах, — приходится констатировать, что не химическое сходство, казалось бы такое очевидное, а довольно тонкие различия между ионами стали основой для того распределения биохимических функций, которое необходимо для действия биологических систем связи и регулирования. [c.153]
Нормальный ритм ра боты организма, в частности ритм сокращения сердца, поддержи вается при определенном соотношении концентраций ионов калия и натрия. Оценивая роль ионов калия и натрия в развивающихся системах — клетках и организмах, — приходится констатировать, что не химическое сходство, казалось бы такое очевидное, а довольно тонкие различия между ионами стали основой для того распределения биохимических функций, которое необходимо для действия биологических систем связи и регулирования. [c.153]
Ионоселективные микроэлектроды находят применение главным образом для измерения активности ионов в отдельных клетках и биологических тканях. Их изготавливают на основе микропипеток с помощью вытягивающих устройств. Чаще всего применяют следующие ионоселективные микроэлектроды стеклянные — для измерения pH и определения ионов натрия в межклеточной жидкости, твердые мембранные (для определения хлорид-ионов) и жидкостные мембранные — для определения ионов калия, хлора и кальция. Среди них наибольшее распространение получили стеклянные микроэлектроды. Применяются два типа стеклянных микроэлектродов копьевидной формы и с заглубленным кончиком. В первом случае микроэлектрод вытягивают из капилляра ионообменного стекла, изолируют с внешней стороны и вставляют в микропипетку из неактивного стекла. Роль мембраны выполняет копьевидный кончик микроэлектрода. В микроэлектроде другой конструкции внешнюю микропипетку выдвигают относительно кончика микроэлектрода и прочно скрепляют с последним таким образом, чтобы контакт мембраны с раствором осуществлялся в пространстве между капиллярами. [c.220]
Среди них наибольшее распространение получили стеклянные микроэлектроды. Применяются два типа стеклянных микроэлектродов копьевидной формы и с заглубленным кончиком. В первом случае микроэлектрод вытягивают из капилляра ионообменного стекла, изолируют с внешней стороны и вставляют в микропипетку из неактивного стекла. Роль мембраны выполняет копьевидный кончик микроэлектрода. В микроэлектроде другой конструкции внешнюю микропипетку выдвигают относительно кончика микроэлектрода и прочно скрепляют с последним таким образом, чтобы контакт мембраны с раствором осуществлялся в пространстве между капиллярами. [c.220]
Минеральные соли играют очень важную роль в образовании буферной системы тканей и биологических жидкостей, поддерживая их pH на постоянном уровне. Установлено, что наибольшее значение в организме в качестве буферов имеют белки, а из минеральных соединений— бикарбонаты и фосфаты натрия и калия. [c.393]
Однако роль живых организмов для химического состава природных вод более обширна и многообразна. Не говоря уже о культурной деятельности человека, достаточно упомянуть имеющую громадное не только биологическое, но и геохимическое значение фотосинтетическую деятельность растений, в результате которой создается первичная продукция органического вещества и регулируется содержание СОг и Ог в атмосфере. Общеизвестна также роль многочисленных видов бактерий, незаметно, но непрестанно проделывающих громадную работу по вовлечению в круговорот самых различных неорганических веществ, многие из которых, наряду с фотосинтезирующими организмами, создают первичное органическое вещество. Избирательная деятельность организмов сказывается на концентрации не только многих микроэлементов, но и на концентрации ряда более распространенных элементов, таких, как кальций, калий, бор, кремний и др. Биосфера является важнейшим и универсальным механизмом, сообщающим подвижность большинству химических элементов. [c.38]
Остальные из названных выше элементов металлы. Каковы же их функции Какая роль, например, магния, для чего нужны организму калий и натрий, каковы функции ионов кобальта, сделавшие его необходимым для нормальной работы организма Не всегда удается дать исчерпывающие ответы на подобные вопросы. В дальнейшем мы изложим те сведения о роли ионов металлов в ферментных системах, которые могут считаться надежно установленными. Природа экономно использует металлы — их содержание в организмах невелико и ион каждого вида выполняет различные функции. Чаще всего они связаны с усилением действия биологических катализаторов или образованием специфических активных групп катализаторов — металлосодержащих ферментов. Известно, что металлы, как правило, входят в состав организмов в виде комплексных соединений. Так, железо с азотсодержащими веществами образует сложный комплекс — гем. Гем вступает во взаимодействие с белками, и в зависимости от того, с каким белком он соединился, получающееся вещество приобретает различные свойства. В одном случае получается превосходный переносчик кислорода — гемоглобин, в другом — фермент, разлагающий перекись водорода,— каталаза, в третьем — фермент пероксидаза и т. д. [c.10]
Ионы кальция, магния, калия и натрия регулируют многие биологические процессы они влияют на функции ферментов и играют роль в передаче нервного возбуждения. Между ними наблюдается антагонизм эффект избыточного количества калия подавляется увеличением концентрации натрия. [c.19]
Органические и минеральные азотные удобрения обогащают почву азотом и зольными элементами и значительно усиливают процессы минерализации в ней. С органическими удобрениями вносится не только органическое вещество, стимулирующее жизнедеятельность микроорганизмов, но и разнообразная микрофлора (например, с навозом), ускоряющая разложение органического вещества почвы. Минеральные удобрения повышают интенсивность биологических процессов в почве, так как являются источником питания микробов азотом, фосфором, калием, кальцием и другими элементами. В круговороте азота в земледелии процессы нитрификации наряду с положительным значением играют и отрицательную роль, так как нитраты могут не только накопляться в почве, но вследствие своей подвижности и вымываться из нее. [c.179]
Макроэлементами в живом веществе являются кислород, водород, углерод, азот, кальций, сера, фосфор, калий, магний, железо, кремний, натрий, хлор и алюминий. Их роль в живых организмах различна. Первые десять элементов (их названия выделены в перечне полужирным шрифтом) жизненно необходимы для животных и для растений. Натрий и хлор, безусловно, нужны всем животным и полезны для некоторых видов растений. Биологические функции кремния и алюминия изучены недостаточно. Все макроэлементы живого вещества располагаются в верхней части периодической системы. Большинство из них входит в состав второго и третьего периодов. [c.142]
Из этих цифр следует, что даже в странах с наиболее развитой химической промышленностью в разрешении азотного баланса главная роль принадлежит не этой промышленности, а азоту биологическому , т. е. азоту навоза, а дефицит по азоту в 20,8% (вернее, в 13 кг на 1 га) и дефицит по калию в 27% (вернее, в 20 кг на 1 га) но помешали Германии поднять урожаи пшеницы в докризисные годы до 21 и ржи до 18, а картофеля до 16 ц. [c.315]
В заключение отметим следующее. Как бы ни произошло разграничение ролей между азотом биологическим и химической продукцией, все равно нам предстоит иметь дело с очень крупным возрастанием количества минеральных удобрений. Если будет выполнен план, нами намечаемый, это приведет к цифре в 24 млн. т. Но если бы план полностью и не был выполнен, то минимум в 20 млн. т все же неизбежно должен быть обеспечен. При 24 млн. т мы могли бы перегнать Францию и занять пятое место по количеству удобрений на га (170 кг удобрений на га, или по 10 кг азота, фосфора, калия в среднем на всю площадь). Но если для целей сельскохозяйственных важно количество удобрений, приходящееся на 1 га посевной площади, то для целей обороны важно валовое количество химической продукции. Здесь мы имеем все шансы выступить на первое место. Ведь если бы любая западная держава стала производить 24 млн. т химических удобрений в год, куда бы она могла их девать Даже для Германии и Франции с их посевной площадью в 20—24 млн. га это означало бы необходимость применить на 1 га в три с половиной раза больше удобрений, чем их применяла Германия в докризисный период, и в девять раз больше, чем их применяет Франция. Но такого масштаба применения удобрений не существует нигде на земном шаре [c.327]
Подтверждением того, что комплексообразование калия с ферментами и субстратами играет важную роль в транспорте ионов, является образование комплексов этих катионов с антибиотиком валиномицином. Уже давно известно, что антибиотики, подобные валиномицину, вызывают транспорт ионов калия в митохондрии. Валиномицин образует прочный комплекс с ионами калия, в то время как ион натрия связывается этим антибиотиком в очень незначительной степени. Вследствие этого валиномицин можно рассматривать как биологическую модель переносчика ионов калия через плазматические мембраны в клетку. [c.239]
Однако было бы большой ошибкой ограничивать значение гумуса лишь его участием в снабжении растения азотом и другими элементами питания (фосфором, калием, серой и др. макро- и микроэлементами). Неоспорима роль гумуса и всего органического вещества почвы в целом в явлениях выветривания, структурообразования, в снабжении растения углекислотой и биологически-активными веществами. Все эти факторы служат непременным условием создания оптимального фона, необходимого для жизни растения. [c.149]
В прошедшей биологическую очистку сточной воде (из расчета на одного жителя в год) содержатся примерно следующие количества важных для роста растений питательных веществ азота— 4 кг фосфатов—1 кг калия—2,5 кг органических веществ—7 кг. Даже при некруглогодичном использовании сточных вод эти питательные вещества играют значительную роль для повышения урожайности сельскохозяйственных культур, так что в данном случае можно с полным правом говорить о сточных водах как о ценном удобрении . Разумеется, того количества питательных веществ, которое содержится в сточных водах, недостаточно для нормального роста растений и поэтому требуется дополнительное внесение в почву минеральных удобрений. Однако назначаемые в этом случае дозы могут быть значительно меньшими, чем для неорошаемых или орошаемых чистой водой земледельческих полей. Поскольку мы здесь заговорили об использовании сточных вод и содержащихся в них веществ для повышения плодородия почвы, следует [c.107]
Утверждение, что калий-натриевый градиент играет роль буфера протонного потенциала, позволяет понять не только биологическую функцию этого градиента, но и причину, которая в течение многих лет препятствовала выяснению его значения для жизнедеятельности клетки. Мысль о буферной роли калий-натриевого градиента не могла родиться, прежде чем был открыт протонный потенциал и было доказано, что он служит конвертируемой формой энергии. Все эти годы проблема калия и натрия просто ждала своего часа. [c.173]
Какова биологическая роль натрии и калия Каково практическое применение наиболее важных соеди1[е-ннй этих элементов [c.281]
Образование многочисленных фосфорных эфиров в процессе окисления различных веществ в животном организме играет важную биологическую роль. Дело в том, что при расщеплении связей фосфорной кислоты с углеродом в условиях животного организма освобождается большое количество энергии (12000 кал на 1 моль фосфорной кислоты), в силу чего эта связь называется макроэргической. Эфиры фосфорной кислоты, несущие в себе большой запас энергии, являются в животном организме своеобразными аккумуляторами энергии. Энергия, осво бождающаяся в процессе окисления различных органических веществ, не расходуется сразу, а откладывается, если так можно выразить, в запас в виде сложных эфиров фосфорной кислоты. Запасенная энергия расходуется по мере надобности, освобождаясь в результате расщепления эфиров фосфорной кислоты. [c.293]
Как указывалось в главе 4, фосфор находит примеггепие во многих областях, однако в наибольших количествах (более чем 90%) он используется в сельском хозяйстве в составе фосфорных или комплексных (вместе с питательными элементами — азотом и калием) удобрений и кормовых фосфатов (минеральной подкормкой сельскохозяйственных животных). Благодаря исключительной биологической роли фосфора академик А. Е. Ферсман называл его элементом ншзни . [c.140]
Следы серебра (порядка 0,02 мг. 5 на 100 г сухого вещества) содержится в организмах всех млекопитающих, но его биологическая роль не ясна. У человека повышенным содержанием Ад (0,03 мг на 100 г свежей ткани, или 0,002 вес. в золе) характеризуется головной мозг. Интересно, что в изолированных ядрах его нервных клеток — нейронов (число которых у человека составляет около 15 млрд.) — серебра гораздо больше (0,08 вес. % в золе). С пищевым рационом человек получает в среднем около 0,1 мг Ае за сутки. Относительно много его содержит яичный желток (0,2 мг в 100 г). Выводится серебро из организма главным образом с калом. [c.44]
Рубидий и цезий. По содержанию в организме человека рубидий (10 %) и цезий (10 %) относятся к микроэлементам. Они постоянно содержатся в организме, но биологическая роль их еще не выяснена. Являясь полным аналогом калия, рубидий также накапливается во внутриклеточной жидкости и может в различных процессах замещать эквивалентное количество калия. Синергист калия — рубидий активирует многие те же самые ферменты, что и калий, пируватфосфокиназу, альдегиддегидрогеназу и др. [c.239]
В начале XX в. считалось, что для нормального существования живых организмов необходимо регулярное снабжение их так называемыми органогенами, к которым относили атомы углерода, водорода, кислорода, азота и зольные элементы фосфор, калий, кальций, магний, натрий, сера, железо и йод. Остальные химические элементы, в тех случаях когда они обнаруживались в золе, считали случайными, засоряющими организм, бес-1юлезными для него, и попадающими с водою или продуктами питания. Однако с течением времени в связи с разработкой и применением новых методов анализа, позволяющих обнаружить и количественно определить ничтожно малые количества элементов, накоплялось все больше данных о наличии и важной биологической роли в организмах различных минеральных веществ. Оказалось, что круг биогенных элементов не ограничивается теми, которые встречаются в организмах в значительных количествах. Многие элементы, обнаруживаемые в минимальных количествах, как было выяснено, играют существенную роль, входя в состав таких важных для жизнедеятельности организмов веществ, как ферменты, гормоны и др. Вместе с этим было показано, что недостаток тех или иных минеральных веществ в пище вызывает глубокие расстройства в жизнедеятельности животных, в развитии растений. [c.202]
Биологическое действие -МСГ, как и других форм, не ограничивается меланотропной активностью, на которую прежде всего было обращено внимание, что и нашло отражение в названии семейства этих гормонов. Помимо влияния на пигментацию кожи и волос они обнаруживают ряд других активностей. Так, -МСГ является сильнодействующим натрий- и калий-уретическим фактором, влияет на выделение гормона роста, проявляет стероидогенную, липолитическую активность, оказьшает положительное влияние на нервную и мышечную системы. Инъекция -МСГ млекопитающим и человеку вызьшает увеличение частоты сердечных сокращений, гиперчувствительность и ряд поведенческих актов. Клинические данные показывают, что гормон повышает чувствительность сетчатки и улучшает адаптацию глаза к темноте. Имеются сведения, которые указывают на роль меланотропинов в качестве нейротрансмиттеров и нейромодуляторов центральной нервной системы. Отмечаются положительные эффекты МСГ на внимательность и память [198-206]. [c.363]
Успехи в биохимии и биофизике последних лет также тесно связаны с развитием краун-соединений. Примером может служить валиномицин — антибиотик, который в 1955 г. был выделен из гadioЬa illi. Как установил в 1963 г. Шемякин с сотр. [ 47], структура валиномицина представляет собой циклический додекадепсипептид (52). Механизм действия этого антибиотика был исследован после того, как Прессман и Моор [ 48] отметили изменение активности митохондрии печени крысы под действием ионов щелочных металлов. Исследование показало, что валиномиЦин избирательно образовывал комплекс с катионом калия, который активно переносился в направлении, противоположном концентрационному градиенту. Добавление валиномицина к митохондриальной фракции приводило к расходованию энергии. Эго явилось важным открытием в понимании роли N3 -К -АТРазы в биологической мем- [c.26]
Удалить такие продукты коррозии водой не удавалось. Бута-диено-акрилонитрильное покрытие не предотвращало коррозию металла и не выдерживало действия бактерий. Лучшим оказалось полиуретановое покрытие. Биологические отложения из топливного бака хорошо удалялись промывкой 2%-ным водным раствором двухромовокислого калия (КгСггО ), который играл также роль бактерицида [3]. [c.216]
Однако в последние пять лет было показано, что краун-эфиры, такие, как 18-краун-б или дициклогексил-18-краун-6, образуют комплексы и растворяют перекись калия в таких растворителях, как диметилсульфоксид, бензол, тетрагидрофуран, диметилформамид, диметоксиэтан и даже диэтиловый эфир [4]. В последнее время солч перекисей привлекли к себе значительное внимание в связи с интересом к их роли в биологических процессах, а также появившейся возможностью растворять их в органических растворителях. О некоторых достижениях в области применения перекисей в органическом синтезе и сообщается в этой главе. [c.139]
Система активного переноса и транспорта через биологические мембраны чрезвычайно сложна. Рабочим телом здесь служат специальные белки, а источником энергии является аденозинтрифосфор-ная кислота (АТФ). При активном переносе первым этапом поглощения является взаимодействие поглощаемых веществ с молекулами поверхностных структур протоплазмы. Адсорбированные молекулы переносятся затем в цитоплазму посредством механизма активного переноса. Предполагается, что в этих процессах ведущая роль принадлежит специальным транспортным системам — мембранным переносчикам, природа которых еще недостаточно изучена. Одним из звеньев такой системы могут быть мембранные транспортные АТФ-азы, активируемые ионами магния, калия и натрия. Так, в последнее время из мембран некоторых микроорганизмов выделены белки, участвующие в транспорте аминокислот. Обнаружены и изучаются белковые системы, ответственные за перенос сахаров в частности глюкозы. [c.15]
Натрий и калий играют решаюшую роль во многих биологических процессах. Хотя во всем организме натрия больше, чем калия, внутри клеток концентрация калия обычно выше. Так, межклеточная жидкость мышцы лягушки содержит 120 ммоль/л Ыа и 2,5 ммоль/л К» , а внутри клеток эти ионы присутствуют в концентрации 9,2 ммоль/л Ка+ и 140 ммоль/л К . [c.232]
Пептапласт можно использовать в качестве конструкционного материала для аппаратуры, подвергающейся воздействию растворов иодида и бромида калия различных концентраций с примесью иода при температуре до 70 С [45, с. 18], кислорода и щелочи при температуре 100 °С [45, с. 27], морской воды [45, с. 68], молочной кислоты и технологических сред производства различных пищевых продуктов [45, с. 21 194] и витаминов [45, с. 82]. В последних случаях важную роль играет биологическая нейтральность пентапласта в сочетании с определенными типами термостабилизаторов [45, с. 56 194]. [c.62]
Что касается питания растения, мы до сих пор придавали значение почти исключительно трем основным элементам азоту, фосфору и калию. Долгое время считали, что другие элементы, необходимые растению, имеются в почве в количествах, достаточных для того, чтобы земледельцу не надо было специально ими заниматься. Затем в связи с потребностями, связанными с интенсификацией культуры и успехами биологической химии, многие ученые, среди которых следует указать особенно Бертрана, систематически исследовали роль других элементов в питании растений, не считая трех основных элементов. Им удалось разделить элементы на совершенно необходимые и на другие, не являюшиеся незаменимыми, так как недостаточно, чтобы тот или иной элемент находился в золе растений, чтобы делать вывод о его абсолютной необходимости. [c.181]
Структурная и молекуля1рная организация биологических мембран. Эта проблема — одна из актуальнейших в современной биологии. Ее решение позволит не только адекватно представить структурную и функциональную организацию клетки, но и активно воздействовать на нее. Мембраны образуют большие площади и играют универсальную регуляторную роль. Функции биологических мембран многообразны активный транспорт веществ, общая н избирательная диффузия небольших молекул и рюнов, регулирование транспорта ионов и продуктов метаболизма внутри клеток, преобразование световой энергии в химическую энергию АТФ и энергии биологического окисления в химическую энергию макроэргических фосфорных связей. Мембраны поддерживают неравномерное распределение ионов (например, калия, натрия, хлора) между протопластом и окружающей средой и обусловливают появление разности биоэлектрических потенциалов. [c.65]
Калий биологическая функция — Справочник химика 21
Для нормального роста и вьшолнения биологических функций человеку и животным кроме витаминов необходим также целый ряд неорганических элементов. Эти элементы можно разделить на два класса макроэлементы и микроэлементы. Макроэлементы, к которым относятся кальций, магний, натрий, калий, фосфор, сера и хлор, требуются организму в относительно больших количествах (порядка нескольких граммов в сутки). Часто они выполняют более чем одну функцию. Например, кальций служит структурным компонентом неорганического вещества костей гидроксиапатита, состав которого можно приблизительно описать формулой [Саз (РО гЗз. Вместе [c.294]
Макроэлементами в живом веществе являются кислород, водород, углерод, азот, кальций, сера, фосфор, калий, магний, железо, кремний, натрий, хлор и алюминий. Их роль в живых организмах различна. Первые десять элементов (их названия выделены в перечне полужирным шрифтом) жизненно необходимы для животных и для растений. Натрий и хлор, безусловно, нужны всем животным и полезны для некоторых видов растений. Биологические функции кремния и алюминия изучены недостаточно. Все макроэлементы живого вещества располагаются в верхней части периодической системы. Большинство из них входит в состав второго и третьего периодов. [c.142]
Натрий и калий в живой клетке. Несмотря на большое сходство химических свойств натрия и калия, их биологические функции различны. В плазме клеток велико содержание катионов К+, но относительно мало катионов Ма+, и наоборот, во внеклеточном растворе много Ма+, но мало К+. Концентрация калия внутри клетки превышает концентрацию вне клеток в 10 раз и более. Катион калия связан с внутриклеточной активностью, а катион натрия участвует в процессах на внешней поверхности клетки и эти два катиона не могут заменить друг друга. Катион К+ является важным активатором более чем 60 ферментов внутри клетки. Катион Ма+ не действует на К+-зависимые ферменты. Катион Na+ также активирует несколько ферментов, а К+ не способен их активировать. [c.277]
Утверждение, что калий-натриевый градиент играет роль буфера протонного потенциала, позволяет понять не только биологическую функцию этого градиента, но и причину, которая в течение многих лет препятствовала выяснению его значения для жизнедеятельности клетки. Мысль о буферной роли калий-натриевого градиента не могла родиться, прежде чем был открыт протонный потенциал и было доказано, что он служит конвертируемой формой энергии. Все эти годы проблема калия и натрия просто ждала своего часа. [c.173]
В животных организмах калий необходим для нормальной ра боты мышечных клеток и нервной системы. Нормальный ритм ра боты организма, в частности ритм сокращения сердца, поддержи вается при определенном соотношении концентраций ионов калия и натрия. Оценивая роль ионов калия и натрия в развивающихся системах — клетках и организмах, — приходится констатировать, что не химическое сходство, казалось бы такое очевидное, а довольно тонкие различия между ионами стали основой для того распределения биохимических функций, которое необходимо для действия биологических систем связи и регулирования. [c.153]
Различная адсорбируемость солей калия и натрия почвенным комплексом привела к разделению ионов ионы натрия оказались в водах морей и океанов, а ионы калия закрепились в почве и, естественно, вошли как важнейший компонент в метаболические процессы растений. Различная способность ионов калия и натрия проходить через биологические мембраны обусловила и специфические функции этих ионов в передаче нервного импульса. [c.153]
Аккумулятивная функция Сущность этой функции заключается в накоплении в форме ГВ важнейших элементов питания живых организмов, органических соединений, несущих энергетические запасы или непосредственно необходимых и усваиваемых микроорганизмами или растениями, а также элементов, не участвующих в биологических процессах Такое накопление происходит не только в почвах, но также в природных водах, донных отложениях, где ГВ служат источниками энергии и питания для биоты Именно в форме ГВ в почвах накапливается до 90% всего азота, половина и более фосфора, серы [451] В этой же форме аккумулируются и сохраняются длительное время калий, кальций, магний, железо и практически все необходимые микроорганизмам микроэлементы В составе ГВ идентифицируются такие элементы, как Н , РЬ, N1, 2п, Си и Аи, которые они очень эффективно сорбируют [c.350]
В природе с белками связано относительно небольшое число металлов. Если рассматривать также ферменты, активируемые металлами, то к этому списку элементов следует добавить лишь натрий, калий и магний. Биологическая роль иона металла в белке характеризуется высокой специфичностью. И тем не менее в зависимости от типа белка один и тот же ион металла осуществляет различные функции разнообразие выполняемых функций является, очевидно, следствием ограничений, накладываемых белковым окружением. В связи с этим биологическая специфичность функций металла имеет, по-видимому,- стереохимическую природу. Основная тема обзора — значение структурных и стереохимических данных и сведений о строении координационных центров металл —лиганд для выяснения функциональной роли металлов в ферментативных процессах — не требует, таким образом, дополнительного обоснования. [c.16]
Липиды играют важную биологическую роль они являются источником энергии для животного организма, при окислении в организме 1 г жира выделяется 9,3 кал. Они хорошие растворители биологически активных веществ (например, витаминов), необходимы для осуществления нормальных функций животного организма. Жировая ткань образует мягкую изолирующую прослойку, защищая внутренние органы и все тело от толчков, ударов и переохлаждения. [c.267]
Важное биологическое значение имеют и некоторые щелочные и щелочноземельные элементы. По сравнению с переходными элементами они связываются менее прочно, и поэтому более легко и свободно перемещаются. Функция натрия и калия в клеточных мембранах связана с нервными импульсами. Магний и кальций участвуют в процессе превращения химической энергии в работу мышц. Определенную функцию в биохимических процессах выполняют и некоторые неметаллы [51]. [c.601]
Остальные из названных выше элементов металлы. Каковы же их функции Какая роль, например, магния, для чего нужны организму калий и натрий, каковы функции ионов кобальта, сделавшие его необходимым для нормальной работы организма Не всегда удается дать исчерпывающие ответы на подобные вопросы. В дальнейшем мы изложим те сведения о роли ионов металлов в ферментных системах, которые могут считаться надежно установленными. Природа экономно использует металлы — их содержание в организмах невелико и ион каждого вида выполняет различные функции. Чаще всего они связаны с усилением действия биологических катализаторов или образованием специфических активных групп катализаторов — металлосодержащих ферментов. Известно, что металлы, как правило, входят в состав организмов в виде комплексных соединений. Так, железо с азотсодержащими веществами образует сложный комплекс — гем. Гем вступает во взаимодействие с белками, и в зависимости от того, с каким белком он соединился, получающееся вещество приобретает различные свойства. В одном случае получается превосходный переносчик кислорода — гемоглобин, в другом — фермент, разлагающий перекись водорода,— каталаза, в третьем — фермент пероксидаза и т. д. [c.10]
Ионы кальция, магния, калия и натрия регулируют многие биологические процессы они влияют на функции ферментов и играют роль в передаче нервного возбуждения. Между ними наблюдается антагонизм эффект избыточного количества калия подавляется увеличением концентрации натрия. [c.19]
Растворимые соединения бария токсичны. Это объясняется тем, что вследствие близости ионных радиусов Ва + и катион бария может замещать катион калия в биологически активных соединениях, не выполняя его функцию. [c.307]
Спинномозговая жидкость. Функции механическая защита мозга, удаление продуктов метаболизма из мозга, транспорт биологически активных веществ. Общий объем СМЖ — 150 мл, плотность — 1,006—1,008, pH — 7,31, содержание белков — 200—400 мг/л, глюкозы — 2,5-4,44 ммоль/л, натрия — 138-150, калия — 2,7—3,9 ммоль/л. Равновесие между глюкозой крови и глюкозой СМЖ устанавливается за 4 ч. При спинномозговой пункции требуется одновременная оценка уровня глюкозы в крови и СМЖ. Белки проникают в СМЖ из плазмы крови путем пиноцитоза через эндотелий капилляров. [c.457]
В лейкопластах образуются крахмал и некоторые другие вещества клетки. В хромопластах, окрашенных в желтый, красный или оранжевый цвет, накапливаются биологически важные вещества— каротиноиды. Хлоропласты являются органами первичного синтеза углеводов — фотосинтеза. Они устроены очень сложно. Это округлые или овальные тельца, ярко-зеленого цвета, размером в несколько микрометров. Внутри них находятся очень мелкие зерна— граны, окрашенные в ярко-зеленый цвет. Хлоропласты состоят из хлорофилла, белков, липидов, каротиноидов и некоторого количества РНК- Из элементов, кроме магния, входящего в молекулу хлорофилла, в них обнаружены калий, кальций, марганец и др. Главная функция хлоропластов — биосинтез глюкозы, который идет при использовании солнечной энергии. [c.26]
В зависимости от химического состава ПАВ мицеллы могут быть неионными, катионными, анионными или амфотерными. Физические свойства ряда детергентов приведены в табл. 1. Наиболее широко применяемые неионные детергенты содержат полиоксиэти-леновую или полиоксипропиленовую цепь, связанную, как правило, со спиртами или фенолами имеющими длинную углеводородную цепь. К неионным ПАВ относятся также эфиры сахаров, жирные алканоламины, жирные окиси аминов. Все эти вещества довольно трудно получить в виде индивидуальных химических соединений, однако отсутствие ионов в мицеллах, которые они образуют, делает их особенно полезными в качестве детергентов и эмульгаторов и позволяет упростить теоретическое рассмотрение структуры таких мицелл. ККМ неионных ПАВ обычно в 100 раз меньше, чем ККМ ионогенных детергентов, содержащих сравнимые по величине гидрофобные группы. Поэтому масса мицелл неионных детергентов существенно больше, чем масса мицелл ионогенных ПАВ. Анионные детергенты обычно содержат длинную углеводородную цепь и карбоксилатную, сульфатную или сульфонатную группу. В качестве противоионов выступают натрий, калий, литий или водород. Длинноцепочечные четвертичные амины или пиридипы с бромид-, хлорид- или иодид-ионом в качестве противоиона образуют группу катионных ПАВ. Степень нейтрализации заряда противоионами в слое Штерна у катионных мицелл несколько меньше (это связано с некоторым экранированием заряда четвертичной аммониевой группы), поэтому их структура более компактна по сравнению с анионными мицеллами. Катионные мицеллы обладают несколько большей солюбилизующей способностью в отношении неполярных субстратов, чем анионные мицеллы, образованные ПАВ того же молекулярного веса. Амфотерные мицеллы образованы цвиттер-ионными молекулами, у которых тип диссоциации определяется pH раствора [45, 46]. Природные фосфатиды и липиды, такие, как лецитин и соли желчных кислот, также образуют мицеллы и определяют многие важные биологические функции in vivo и in vitro [20, 47—51]. [c.228]
Хорошо известно, что ионы кальция поступают в цитоплазму в ответ на нервную стимуляцию и что именно они вызывают различные ответные реакции в организме, такие, например, как мышечное сокращение. Весьма вероятно, что в результате присоединения ионов Са- к специфическим центрам связывания (как это имеет место, например, в каль-ций-связывающем белке карпа) в молекуле происходят конформационные изменения, инициирующие биологические ответные реакции. Кальций-связывающий белок содержит интересную систему внутренних полярных групп, связанных между собой специфическим образом с помощью водородных связей (рис. 4-5, ). Присоединение ионов кальция может вызывать перестройку этих внутренних связей (гл. 2, разд. Б.7) и изменять тем самым характер взаимодействия этого белка (функция которого точно не известна) с другим белком (ср., например, с действием тропонина С, разд. Е.1). В других кальций-связывающих центрах в белках содержатся остатки у-карбоксиглутаминовой кислоты, способной образовывать хелатные комплексы (дополнение 10-Г). [c.270]
Каждая клетка состоит из огромного числа атомов и молекул. Попробуем разобраться, насколько они универсальны и какие функции выполняют в клетках Оказалось, что из периодической системы элементов всего лишь шесть биоэлементов используются для построения подавляющего числа биологически значимых молекул углерод С, ьшслород О, водород Н, сера 8, азот N и фосфор Р. Еще 16 микроэлементов присутствуют в клетках в различных количествах и соотношениях. К ним относятся железо Ре, медь Си, цинк Zn, марганец Мп, кобальт Со, иод I, молибден Мо, ванадий V, никель N1, хром Сг, фтор Р, селен 8е, кремний 81, олово 8п, бор В, мышьяк Аз и пять ионов натрий Na , калий К , магний Mg , кальций Са » , хлор С1 . Каков бы ни был принцип отбора атомов для процессов жизнедеятельности, он не связан с их распространенностью в природе. Например, из галогенов только хлор и иод выбраны природой, хотя фтор и бром обладают не меньшей доступностью. По-видимому, в основу отбора положен принцип пригодности и целесообразности. Например, шесть основных биоэлементов имеют набор свойств, достаточный для построения почти всех необходимых для клетки молекул. [c.6]
Биология и медицина. Начало биологическим применениям стеклянных электродов с металлической функцией ( катион-чувствительных ) положили работы Эйзенмана с сотрудниками (1957 г.). Результаты работы, проведенной под руководством Эйзенмана, дали возможность биологам получать данные об активности ионов калия и натрия непосредственно с места их действия (in situ) в биологических процессах. В этих работах подчеркивается и другая сторона вопроса для ряда биологических явлений (возникновение биопотенциалов, клеточная проницаемость и связанные с ней процессы нервного возбуждения, кажущаяся специфичность многих клеток и тканей по отношению к ионам К ) физико-химические закономерности оказываются во многом сходными с теми, которые имеют важное значение в функционировании стеклянных и мембранных электродов. Это повышает интерес и значимость самой ионообменной теории стеклянного электрода. [c.331]
Если смешать соответствующие фосфолипиды и белки и нанести эту смесь на поверхность воды, то спонтанно образуются мембраноподобные структуры, сходные по толщине с биологическими мембранами. Исследование таких искусственных мембран, приготовленных из белков и липидов природных мембран, дает нам возможность лучше понять структуру и функцию биологических мембран. Искусственные мембраны обнаруживают разную проницаемость для разных ионов в зависимости от природы белков и липидов, входящих в их состав. Чрезвычайно-интересные эффекты можно наблюдать при добавлении к искусственным мембранам некоторых антибиотиков. Валиномицин, например, благодаря своей структуре (т. е. определенным размерам и заряду молекулы) оказывается способным притягивать и удерживать ионы калия, но не притягивает ионов натрия (рис. 2.5). Если добавить валиномицин к искусственной мембране, отделяющей растворы с ионами К+ и Ка+ от чистой воды. [c.28]
Этот последний член семейства ГР—ПРЛ— ХС не выполняет у человека строго определенной функции. При биологических испытаниях он проявляет лактогенную и лютеотропную активность, а его метаболические эффекты качественно сходны с действием гормона роста, включая торможение поглощения глюкозы, стимуляцию высвобождения свободных жирных кислот и глицерола, усиление задержки азота и кальция (несмотря на повыщение выделения кальция с мочой), а также снижение мочевой экскреции фосфора и калия. ХС может поддерживать рост развивающегося плода, однако и в тех случаях, когда ни у плода, ни в плаценте нет генов группы ГР—ХС (кроме генов ГР-Ы и ХС-Ь), внутриутробное развитие плода и рост младенца в неонатальном периоде протекают нормально. Поскольку [c.177]
Структурная и молекуля1рная организация биологических мембран. Эта проблема — одна из актуальнейших в современной биологии. Ее решение позволит не только адекватно представить структурную и функциональную организацию клетки, но и активно воздействовать на нее. Мембраны образуют большие площади и играют универсальную регуляторную роль. Функции биологических мембран многообразны активный транспорт веществ, общая н избирательная диффузия небольших молекул и рюнов, регулирование транспорта ионов и продуктов метаболизма внутри клеток, преобразование световой энергии в химическую энергию АТФ и энергии биологического окисления в химическую энергию макроэргических фосфорных связей. Мембраны поддерживают неравномерное распределение ионов (например, калия, натрия, хлора) между протопластом и окружающей средой и обусловливают появление разности биоэлектрических потенциалов. [c.65]
Роль электролитов в организме животных
Электролиты – это
минеральные соединения, которые способны проводить электрический заряд. Большинство
физиологических процессов, происходящих в организме, без участия электролитов
невозможно.
Находясь в тканях и крови организма в виде растворов солей, они помогают перемещению питательных веществ в клетки и выводу продуктов обмена веществ из клеток, поддерживают в них водный баланс и необходимый уровень кислотности. Электролиты обеспечивают поддержание гомеостаза, участвуют в метаболизме, играют важную роль в развитии костной ткани, необходимы для обеспечения сократительной способности мышечных волокон, а также для их расслабления. К основным электролитам крови относятся калий, магний, натрий, кальций, фосфор, хлориды, железо.
Натрий – главный внеклеточный элемент, помогающий организму активно расти и развиваться. Он обеспечивает транспорт питательных веществ к клеткам организма, участвует в генерации нервных импульсов, обладает спазмолитическим действием, активизирует пищеварительные ферменты и регулирует обменные процессы.
Хлориды – электролит крови, нормализующий водно-солевой обмен. Он помогает выровнять уровень кровяного давления, уменьшить отечность тканей, активизировать процесс пищеварения, улучшить функционирование гепатоцитов.
Калий поддерживает на должном уровне водный баланс, стимулирует сокращения миокарда, защищает кровеносные сосуды, в силу чего препятствует развитию кислородного голодания, способствует выведению шлаков, нормализует работу сердца, оказывает положительное влияние на иммунитет.
Кальций – электролит, отвечающий за нормальную работу свертывающей и сердечно-сосудистой систем, регуляцию обмена веществ, укрепление нервной системы, построение и обеспечение прочности костной ткани, поддержание стабильного ритма сердца.
Магний – жизненно важный электролит. Он нормализует сокращение миокарда и улучшает работу центральной нервной системы. Магний предотвращает развитие холецистита и мочекаменной болезни.
Железо – электролит, обеспечивающий перенос и доставку кислорода к клеточным элементам и тканям. В результате кровь насыщается кислородом, нормализуется процесс клеточного дыхания и образования красных кровяных телец в костном мозге. Железо поступает в организм извне, всасывается в кишечнике и разносится с током крови по всему организму.
Фосфор – микроэлемент, который необходим для осуществления липидного обмена, синтеза ферментов, распада углеводов. С его участием формируется зубная эмаль, протекает процесс образования костей, передача нервных импульсов. Фосфор поступает в организм с пищей, всасывается в ЖКТ только вместе с кальцием.
Содержание электролитов в крови часто нарушается у животных при отсутствии сбалансированного рациона или в случаях развития патологических процессов в организме. Расшифровкой полученных лабораторных результатов занимаются только ветеринарные специалисты.
В диагностическом отделе ФГБУ «Кемеровская МВЛ» проводится биохимический анализ крови по 23 показателям. Материалом для исследования уровня электролитов служит сыворотка крови. Следует отметить, что гемолизированная сыворотка крови не пригодна для исследования.
ФГБУ «Кемеровская МВЛ»
Подпишитесь на нас в
ЯНДЕКС.НОВОСТИ и в
Telegram
, чтобы читать новости сразу, как только они появляются на сайте.
Презентация Значение калия в организме | Презентация к уроку по биологии (9 класс) на тему:
Слайд 2
Калий – это минеральный элемент, необходимый для нормальной жизнедеятельности клеток живого организма – он является их важной частью. Даже небольшие изменения количества этого элемента в организме могут повлиять на его работу. Калий выводится через почки; если его выводится слишком много, развивается гипокалиемия – нехватка калия, а потом дефицит.
Слайд 3
Калий в основном содержится в растительных продуктах, однако некоторые виды животных продуктов могут быть источником калия. Наиболее богаты калием такие продукты , как: петрушка, курага, сухое молоко, шоколад, различные орехи (особенно миндаль и фисташки), картофель , бананы , авокадо, соя, отруби. Также калий присутствует в значительном количестве в большинстве фруктов, овощей, мясе и рыбе. Необходимо помнить, что в организме существует определенный баланс между калием и натрием. Если он был нарушен (чаще всего наблюдается дефицит калия), то прием продуктов — источников калия приводит к увеличению выведения натрия, и наоборот. .
Слайд 4
Продукты,содержащие Калий
Слайд 5
Продукты,содержащие Калий
Слайд 6
Биологическая роль калия Калий вместе с другими важнейшими электролитами обеспечивает необходимое осмотическое давление в биологических жидкостях организма и в клетках, является компонентом буферных систем, поддерживает электрический потенциал на мембранах клеток всех тканей. Главная биологическая функция калия — формирование совместно с другими электролитами ( натрий , хлор) разницы потенциалов на мембранах клеток и передача ее изменения по клеточной мембране, за счет обмена с ионами натрия, что особенно важно для нервных и мышечных клеток. Это обуславливает постоянное присутствие в клетках натрия, хлора и калия. В организме эти элементы содержатся в определенном соотношении, обеспечивая гомеостаз (постоянство внутренней среды). Нарушение равновесия между калием и натрием ведет к патологии водного обмена, обезвоживанию, мышечной слабости.
Слайд 7
Основные функции калия в организме: обеспечение возбудимости и проводимости клеток нервной системы и мышечных клеток, участие в передаче нервных импульсов и сокращении мышечных клеток поддержка осмотического давления в клетках, тканях и биологических жидкостях обеспечение кислотно-щелочного равновесия участие в нервной регуляции сердечных сокращений
Слайд 8
Дефицит калия Основные причины недостаточное поступление в результате нерационального питания нарушения обмена нарушения выделительных систем (почки, кишечник, кожа) чрезмерное выведение калия из организма под действием лекарств (прежде всего мочегонных и слабительных средств, а также гормональных препаратов) продолжительная рвота, диарея чрезмерные эмоциональные и нервные нагрузки избыточное поступление в организм натрия
Слайд 9
Последствия общая слабость, быстрое утомление мышечные судороги (часто возникают судороги ног по ночам) депрессия, снижение работоспособности снижение иммунитета и адаптационных возможностей организма к воздействию внешних факторов нарушения сердечнососудистой системы (нарушение ритма сердечных сокращений, сердечная недостаточность, обменные и функциональные нарушения в миокарде) ломкость волос, сухость кожи диспептические явления (тошнота, рвота, запор) нарушение функции почек невынашиваемость беременности
Слайд 10
Калий участвует в поддержании кислотно-щелочного равновесия и осмотического давления, а также в метаболических процессах, происходящих в клетке (особенно в обмене углеводов через активацию АТФ-азы). Калий является кофактором фермента, осуществляющего перенос фосфатной группы с АТФ на пировиноградную кислоту и, вероятно, активирует ряд других ферментов внутриклеточного метаболизма. В микросомальной фракции слюнных желез жвачных обнаружено, в частности, К+-зависимая фосфатаза, возможно ответственная за активный транспорт одновалентных ионов.
Слайд 11
Совместно с ионами Na+ ионы K+ участвуют в создании потенциала «покоя» и возникновении «потенциала действия» в нервных и мышечных образованиях. Соли калия в небольшой концентрации снижают частоту и амплитуду сердечных сокращений; избыток их вызывает остановку сердца в фазе диастолы. С участием ионов K+, содержащихся в эритроцитах, осуществляется перенос кислорода и углекислого газа гемоглобином.
Слайд 12
Роль калия в преджелудках жвачных состоит в поддержании определенной буферности и влажности содержимого, т. е. создании оптимальной среды для бактериальной ферментации. Предполагается, что калий необходим для нормальной жизнедеятельности микрофлоры, в частности целлюлозолитической. Калий, по-видимому, имеет непосредственное отношение и к процессам синтеза белков. Добавка его к рациону с недостатком протеина повышает привесы у поросят и использование ими корма Основной механизм, определяющий гомеостаз калия в организме, находится на уровне почек.
Слайд 13
В его регуляции принимают участие минералокортикоиды — альдостерон и дезоксикортикостерон. Влияние этих гормонов на экскрецию ионов K+ является, вероятно, вторичным, производным от их влияния на реабсорбцию в почечных канальцах ионов Na+. Тем не менее оба эти процесса взаимообусловлены, так как секреция альдостерона стимулируется лишь при одновременном снижении уровня Na+ и повышении K+ в плазме. Выводя избыток ионов K+ через почки, регуляторные механизмы поддерживают постоянное отношение Na : К во внеклеточных жидкостях организма. Вероятно, минералокортикоиды имеют также отношение к регуляции проницаемости мембран и механизму натрий-калиевого насоса. Детали этой регуляции неизвестны.
Слайд 14
Избыток калия Основные причины избыточное потребление с пищевыми продуктами (длительный прием препаратов калия, потребление соответствующих минеральных вод и др.) нарушение обмена быстрый и значительный выход калия из клеток (при гемолизе, цитолизе, синдроме раздавливания тканей) нарушение функции почек (почечная недостаточность)
Слайд 15
Последствия повышенная возбудимость нервной системы, раздражительность, беспокойство потливость слабость нейроциркуляторная дистония нарушения сердечнососудистой системы (аритмии, ослабление сократительной способности мышцы сердца) паралич скелетной мускулатуры кишечные колики частое мочеиспускание манифестация сахарного диабета
Роль химических элементов в жизни человека
Понедельник,
1
Апрель
2019
Роль макро, микроэлементов для человеческого организма велика. Ведь они принимают активное участие во многих жизненно важных процессах. На фоне дефицита того или иного элемента человек может столкнуться с появлением определенных заболеваний. Дабы избежать этого, необходимо понимать, для чего нужны макро и микроэлементы в человеческом организме, и какое их количество должно содержаться.
Что такое макро и микроэлементы
Все полезные и необходимые для организма вещества попадают в него благодаря продуктам питания, биологическим добавкам, призванным устранить дефицит определенных веществ. Поэтому к своему рациону необходимо отнестись предельно внимательно.
Перед тем как приступить к изучению функций микро и макроэлементов необходимо понимать их определение.
Так, макроэлементами принято считать соединения химических элементов или одиночные элементы, которые содержатся в организме в большом количестве, измеряемом граммами.
А значение микроэлементов отличается от макро количественными показателями. Ведь в данном случае химические элементы содержатся преимущественно в достаточно малом количестве.
Для того чтобы организм функционировал и в его работе не происходили сбои необходимо позаботиться о регулярном достаточном поступлении в него необходимых макро и микроэлементов. Информацию относительного этого можно рассмотреть на примере таблиц. Первая таблица наглядно продемонстрирует, какая суточная норма употребления тех или иных элементов является оптимальной для человека, а также поможет определиться с выбором всевозможных источников.
Роль химических элементов
Роль микроэлементов в организме человека, как и макроэлементов очень велика.
Многие люди даже не задумываются о том, что они принимают участие во многих обменных процессах, способствуют формированию и регулируют работу таких систем, как кровеносной, нервной.
Именно от химических элементов, которые содержит первая и вторая таблица, происходят значимые для жизни человека обменные процессы, к их числу можно отнести водно-солевой и кислотно-щелочной обмен. Это лишь небольшой перечень того, что получает человек.
Биологическая роль макроэлементов заключается в следующем:
· Функции кальция заключаются в формировании костной ткани. Он принимает участие в формировании и росте зубов, отвечает за свертываемость крови. Если этот элемент не будет поступать в необходимом количестве, то привести такое изменение может к развитию рахита у детей, а также остеопороза, судорог.
· Функции калия заключаются в том, что он обеспечивает водой клетки организма, а также принимает участие в кислотно-щелочном равновесии. Благодаря калию происходит синтез белка. Дефицит калия приводит к развитию многих заболеваний. К их числу можно отнести проблемы с желудком, в частности, гастрит, язва, сбой сердечного ритма, болезни почек, паралич.
· Благодаря натрию удается держать на уровне осмотическое давление, кислотно-щелочной баланс. Ответственный натрий и за поставку нервного импульса. Недостаточное содержание натрия чревато развитием заболеваний. К их числу можно отнести судороги мышц, болезни, связанные с давлением.
· Функции магния среди всех макроэлементов наиболее обширные. Он принимает участие в процессе формирования костей, зубов, отделении желчи, работе кишечника, стабилизации нервной системы, от него зависит слаженная работа сердца. Этот элемент входит в состав жидкости, содержащейся в клетках тела. Учитывая важность этого элемента, его дефицит не останется незамеченным, ведь осложнения, вызванные этим фактом, могут сказаться на желудочно-кишечном тракте, процессах отделения желчи, появлении аритмии. Человек ощущает хроническую усталость и нередко впадает в состояние депрессии, что может сказаться на нарушении сна.
· Основной задачей фосфора является преобразование энергии, а также активное участие в формировании костной ткани. Лишив организм этого элемента можно столкнуться с некоторыми проблемами, например, нарушениями в формировании и росте кости, развитием остеопороза, депрессивного состояния. Дабы избежать всего этого, необходимо регулярно пополнять запасы фосфора.
· Благодаря железу происходят окислительные процессы, ведь он входит в цитохромы. Нехватка железа может сказаться на замедлении роста, истощении организма, а также спровоцировать развитие анемии.
Биологическая роль химических элементов заключается в участии каждого из них в естественных процессах организма. Недостаточное их поступление может привести к сбою в работе всего организма. Роль микроэлементов для каждого человека неоценима, поэтому необходимо придерживаться суточной нормы их потребления, которую содержит приведенная выше таблица.
Так, микроэлементы в организме человека отвечают за следующее:
· Йод необходим для щитовидки. Недостаточное его поступление приведет к проблемам с развитием нервной системы, гипотиреоза.
· Такой элемент, как кремний, обеспечивает формирование костной ткани и мышц, а также входит в состав крови. Нехватка кремния может привести к чрезмерной слабости кости, в результате чего увеличивается вероятность получения травм. От дефицита страдает кишечник, желудок.
· Цинк приводит к скорейшему заживлению ран, восстановлению травмированных участков кожи, входит в состав большинства ферментов. О его нехватке свидетельствует изменения вкуса, восстановления поврежденного участка кожи на протяжении длительного времени.
· Роль фтора заключается в принятии участия в процессах формирования зубной эмали, костной ткани. Его нехватка приводит к поражению зубной эмали кариесом, затруднениям, возникшим в процессе минерализации.
· Селен обеспечивает стойкую иммунную систему, принимает участие в функционировании щитовидки. Говорить о том, что в организме селен присутствует в недостающем количестве можно в случае, когда прослеживаются проблемы с ростом, формированием костной ткани, развивается анемия.
· С помощью меди становится возможным перемещение электронов, ферментный катализ. Если содержание меди недостаточное, то может развиться анемия.
· Хром принимает активное участие в обмене углеводов в организме. Его нехватка сказывается на изменении уровня сахара в крови, что нередко становится причиной развития диабета.
· Молибден способствует переносу электронов. Без него возрастает вероятность поражения зубной эмали кариесом, появления нарушений со стороны нервной системы.
· Роль магния заключается в принятии активного участия в механизме ферментного катализа.
Микро, макроэлементы, поступающие в организм вместе с продуктами, биологически активными добавками жизненно необходимы для человека, и свидетельствуют об их важности проблемы, заболевания, возникающие в результате их дефицита. Для того чтобы восстановить их баланс необходимо правильно подбирать питание, отдав предпочтение тем продуктам, которые содержат необходимый элемент.
ОГБУЗ «Старооскольский кожвендиспансер»
желает Вам здоровья и долголетия!
Химические элементы в живых организмах — урок. Химия, 8–9 класс.
В организме человека содержатся атомы более чем \(70\) химических элементов.
Наибольшее значение имеют органогенные неметаллы углерод, водород, кислород и азот, которые входят в состав органических соединений.
Ионы натрия и калия очень важны для здоровья. Ион натрия — главный внеклеточный ион, а ион калия — внутриклеточный. Калий поддерживает работу сердечной мышцы.
Кальций входит в состав костной ткани. Ионы кальция необходимы для работы нервной системы, для работы сердца и свёртывания крови.
Магний является стимулятором обмена веществ, входит в состав печени, костей, нервной ткани, крови, мозга.
Железо входит в состав гемоглобина, который обеспечивает транспорт кислорода кровью.
Соединения фтора входят в состав костей и зубной эмали. Он является необходимым элементом обмена веществ в мышцах, железах, нервной ткани.
Хлор — один из химических элементов, без которых невозможно существование живых организмов. Хлорид натрия входит в состав плазмы крови. Он стимулирует обмен веществ, рост волос, придаёт бодрость и силу. Соляная кислота содержится в желудочном соке и участвует в переваривании пищи.
Соединения брома участвуют в регуляции процессов возбуждения и торможения в нервной системе.
Иод входит в состав гормонов щитовидной железы, регулирующих процессы обмена веществ в организме.
Атомы серы содержатся в белках, многих витаминах и гормонах.
Фосфор входит в состав нуклеиновых кислот и АТФ, содержится в костях, нервной ткани, крови.
Калий | Элементы | RSC Education
Калий является важным элементом почти для всех живых существ, и в нашем организме содержится около 120 г, которые содержатся в основном в красных кровяных тельцах, мышцах и головном мозге.
Один из его природных изотопов — калий-40. Это β-излучатель, преобразующий ядро в аргон-40, что объясняет, почему 1% этого газа содержится в атмосфере Земли.
Калий в нашем организме
Ионы калия выполняют множество метаболических функций, наиболее важными из которых являются регулирование внутриклеточной жидкости, растворение белков, управление нервными импульсами и сокращение мышц.Движение натрия и калия через мембраны нервных клеток позволяет передавать нервные импульсы. Это боковое движение заряда проходит как волна вдоль волокна, как если бы это был электрический ток.
Клеточные мембраны имеют каналы, по которым ионы натрия и калия протекают избирательно и против градиента концентрации. Есть триллионы этих натрий-калиевых насосов, которые могут переносить 200 ионов натрия и калия в секунду в клетку и из клетки.Некоторые каналы пропускают только калий.
Токсины и питательные вещества
Токсин черной змеи мамба убивает свою жертву, блокируя калиевые каналы. Убийства и казни совершались путем введения в кровоток концентрированного раствора хлорида калия для создания осмотического давления, препятствующего перемещению калия через клеточную мембрану. Затронуты все функции организма, но не более резко, чем сердечная мышца, которая перестает биться.
Калия в пище нужно гораздо больше, чем натрия. Нам требуется регулярное потребление, потому что у нас нет механизма для хранения этого элемента. Продукты, богатые калием, включают изюм и миндаль, которые содержат 860 мг на 100 г, смородину (750), арахис (680) и бананы (350). Существуют важные пищевые добавки на основе калия, такие как тартрат калия-натрия (KNaC 4 H 4 O 6 , он же E337), который является компонентом разрыхлителя и гидросульфита калия (KHSO 3 , он же E228). который добавляют в вина, чтобы предотвратить рост дрожжевых грибков.
Соли калия в форме нитрата калия (он же селитра, KNO 3 ), карбоната калия (он же поташ, K 2 CO 3 ) и сульфата алюминия калия (он же квасцы, KAl (SO 4 ) 2 ) известны веками. В 1600-х годах было известно, что калий — это способ улучшения почвы. Сегодня хлорид калия широко используется в качестве удобрения и называется его традиционным названием MoP, или хлорид калия.
Прошлое и настоящее
6 октября 1807 года Хэмфри Дэви (1778-1829) поместил немного влажного поташа на платиновый диск, подключенный к отрицательному полюсу своей батареи.Он поместил платиновую проволоку, подключенную к положительному полюсу, в контакт с калием и вскоре заметил образование металлических шариков на платиновом диске. Это был первый случай выделения металла с помощью электролиза. Он назвал новый металл калием и отметил, что при попадании в воду он образует шарики, которые скользят по поверхности и горят пламенем лавандового цвета.
Мировое производство калийных руд, таких как сильвит (KCl) и карналлит (KMgCl 3 .6H 2 O) составляет около 35 млн тонн. Великобритания добывает около 400 000 тонн KCl в год на руднике в Боулби в Йоркшире. Большинство из них превращается в удобрения, но некоторые из них используются для производства гидроксида калия (КОН) путем электролиза раствора KCl. Он используется для изготовления жидкого мыла и моющих средств или превращается в карбонат калия (K 2 CO 3 ) для производства стекла. Немного попадает в лекарства, капельницы и инъекции физраствора.
Из самого металлического калия производится около 200 тонн в год паров натрия вверх по колонне при 870 ° C, вниз по которой течет расплавленный хлорид калия.Они вступают в реакцию и выделяют пары калия, которые конденсируются в верхней части. Металлический калий производится для производства супероксида калия (KO 2 ), который образуется при сгорании в кислородном газе. Он хранится в шахтах, подводных лодках и космических аппаратах для регенерации кислорода в воздухе, когда он истощается. Этот оксид реагирует с диоксидом углерода с образованием карбоната калия (K 2 CO 3 ) и при этом выделяет газообразный кислород.
Подшивка с фактами
Атомный номер 19; атомная масса 39.0983; температура плавления 64 ° C (сплав с цезием и натрием остается жидким до -78 ° C), температура кипения 774 ° C, плотность: 0,86 г / см -3 . Калий — мягкий серебристый щелочной металл с высокой реакционной способностью. Его предпочтительное состояние — ион K + . Сам металл растворяется в жидком аммиаке с образованием синего раствора, который является мощным восстановителем.
Биологическое значение натрия и калия — материалы исследования для IIT JEE
Биологическое значение натрия
Фиг.1. Краткое изложение важности ионов натрия
Соли натрия, такие как хлорид натрия, используются в качестве консерванта при травлении.
Нормальный уровень натрия в сыворотке составляет около 135-145 ммоль / л. Падение уровня натрия в плазме крови ниже контрольного значения известно как Гипонатриемия . Гипонатриемия приводит к головной боли, тошноте, коме, судорогам и т. Д.
Биологическое значение калия / Каковы функции калия в организме?
Ионы калия поддерживают осмолярность (концентрацию раствора, выраженную как общее количество частиц растворенного вещества на литр) клетки.Они также регулируют открытие и закрытие устьиц.
Ионы калия действуют как кофактор некоторых ферментов, таких как пируваткиназа .
Калий важен для работы сердца, а также для сокращения скелета и мышц.
Диеты с низким содержанием калия приводят к гипертонии.
Поддерживает баланс электролитов в организме.
Натрий-калиевый насос
Натрий-калиевый насос — это АТФаза, обнаруженная в плазматической мембране клеток животных.
Рис. 2. Натрий-калиевый насос
Часто задаваемые вопросы (FAQ)
1 кв. Какова функция натрий-калиевого насоса?
Sol. Он перекачивает ионы натрия и калия против градиента концентрации.Ионы натрия откачиваются, а ионы калия перемещаются внутрь.
2 кв. Почему натриево-калиевый насос так важен для человеческого организма?
Sol. Натрий-калиевый насос очень важен для человеческого организма, так как он необходим для передачи нервных импульсов.
3 кв. Где в организме содержится больше всего калия?
Sol. Большая часть калия находится внутри клеток, то есть внутриклеточно.
Посмотрите это видео, чтобы получить дополнительную информацию
Другие показания
Биологическое значение натрия и калия
Электролитный баланс
| Безграничная анатомия и физиология
Натрий, электролиты и баланс жидкости
Электролиты играют жизненно важную роль в поддержании гомеостаза в организме.
Цели обучения
Определить важность натрия и баланса жидкости / электролитов
Основные выводы
Ключевые моменты
- Электролиты помогают регулировать миокардиальные и неврологические функции, баланс жидкости, доставку кислорода, кислотно-щелочной баланс и многое другое.
- Наиболее серьезные электролитные нарушения связаны с нарушениями уровней натрия, калия и / или кальция.
- Почки поддерживают постоянную концентрацию электролитов в крови, несмотря на изменения в организме.
Ключевые термины
- гомеостаз : способность системы или живого организма регулировать свою внутреннюю среду для поддержания стабильного равновесия; например, способность теплокровных животных поддерживать постоянную температуру.
- электролит : любой из различных ионов (например, натрия или хлорида), регулирующих электрический заряд клеток и поток воды через их мембраны.
- натрий : химический элемент с символом Na (от латинского: natrium) и атомным номером 11.Это мягкий серебристо-белый металл с высокой реакционной способностью, входящий в группу щелочных металлов.
Важность электролитного баланса
Электролиты играют жизненно важную роль в поддержании гомеостаза в организме. Они помогают регулировать миокардиальную и неврологическую функцию, баланс жидкости, доставку кислорода, кислотно-щелочной баланс и другие биологические процессы.
Электролиты важны, потому что это то, что клетки (особенно нервные, сердечные и мышечные) используют для поддержания напряжения на своих клеточных мембранах и для передачи электрических импульсов (нервных импульсов, мышечных сокращений) через себя и к другим клеткам.
Дисбаланс электролитов может развиваться из-за чрезмерного или недостаточного проглатывания, а также из-за чрезмерного или уменьшенного выведения электролита. Наиболее частой причиной электролитных нарушений является почечная недостаточность. Наиболее серьезные электролитные нарушения связаны с нарушениями уровня натрия, калия и / или кальция.
Другие нарушения баланса электролитов встречаются реже и часто возникают в связи с серьезными изменениями электролита. Хроническое злоупотребление слабительными, сильная диарея или рвота (гастроэнтерит) могут привести к электролитным нарушениям в сочетании с обезвоживанием.Люди, страдающие нервной булимией или нервной анорексией, особенно подвержены высокому риску электролитного дисбаланса.
Почки поддерживают постоянную концентрацию электролитов в крови, несмотря на изменения в организме. Например, во время тяжелых упражнений из-за потоотделения теряются электролиты, особенно натрий и калий, и потоотделение может увеличить потребность в замене электролитов (соли). Эти электролиты необходимо заменить, чтобы поддерживать их концентрацию в жидкостях организма на постоянном уровне.
Обезвоживание
Существует три типа обезвоживания:
- Гипотонический или гипонатремический (прежде всего потеря электролитов, в частности натрия).
- Гипертонический или гипернатремический (прежде всего потеря воды).
- Изотонический или изонатремический (равная потеря воды и электролитов).
У людей наиболее распространенным типом обезвоживания является изотоническое (изонатриемическое) обезвоживание; что эффективно приравнивается к гиповолемии; но различие изотонического обезвоживания от гипотонического или гипертонического может быть важным при лечении людей с обезвоживанием.
С физиологической точки зрения, несмотря на название, обезвоживание не означает просто потерю воды, поскольку и вода, и растворенные вещества (в основном натрий) обычно теряются примерно в равных количествах по сравнению с тем, как они присутствуют в плазме крови. При гипотонической дегидратации внутрисосудистая вода перемещается во внесосудистое пространство и увеличивает истощение внутрисосудистого объема для данного количества общей потери воды в организме.
Неврологические осложнения могут возникать при гипотоническом и гипертоническом состояниях. Первое может привести к судорогам, второе — к осмотическому отеку мозга при быстрой регидратации.
В более тяжелых случаях коррекция обезвоженного состояния осуществляется путем восполнения необходимого количества воды и электролитов (посредством пероральной регидратационной терапии или восполнения жидкости путем внутривенной терапии). Поскольку пероральная регидратация менее болезненна, менее инвазивна, менее дорога и более проста в применении, она является предпочтительным методом лечения легкого обезвоживания. Растворы, используемые для внутривенной регидратации, должны быть изотоническими или гипотоническими.
Клеточные электролиты : Эта диаграмма иллюстрирует механизм транспортировки воды и электролитов через эпителиальные клетки секреторных желез.
Регламент баланса натрия
Натрий — важный катион, который в основном распределяется вне клетки.
Цели обучения
Опишите механизмы, с помощью которых регулируется баланс натрия
Основные выводы
Ключевые моменты
- В организме есть мощный механизм удержания натрия: ренин-ангиотензиновая система.
- При истощении запасов натрия повышается уровень альдостерона; в состояниях избытка натрия снижается уровень альдостерона.
- Основным физиологическим регулятором секреции альдостерона является уровень ангиотензина II плазмы, который увеличивает секрецию альдостерона.
Ключевые термины
- натрий : химический элемент с символом Na (от латинского: natrium) и атомным номером 11. Это мягкий серебристо-белый металл с высокой реакционной способностью, входящий в группу щелочных металлов.
- альдостерон : минералокортикоидный гормон, который секретируется корой надпочечников и регулирует баланс натрия и калия в организме.
- ангиотензин : любой из нескольких полипептидов, которые сужают кровеносные сосуды и регулируют артериальное давление.
Регламент по натрию
Натрий — важный катион, который в основном распределяется вне клетки. Концентрация натрия в клетках составляет около 15 ммоль / л, но она варьируется в разных органах; он имеет внутриклеточный объем 30 литров, а внутри клетки находится около 400 ммоль.
Плазма и интерстициальный натрий составляют около 140 ммоль / л с внеклеточным объемом около 13 литров, 1800 ммоль находятся во внеклеточном пространстве.Однако общее содержание натрия в организме составляет около 3700 ммоль, так как в костях хранится около 1500 ммоль.
В организме есть мощные механизмы удержания натрия, и даже если человек принимает пять ммоль Na + в день, он может поддерживать баланс натрия. Дополнительный натрий выводится из организма за счет снижения активности ренин-ангиотензиновой системы, что приводит к увеличению потери натрия из организма. Натрий выводится через почки, пот и кал.
При истощении запасов натрия уровень альдостерона повышается.В состояниях избытка натрия уровень альдостерона снижается. Основным физиологическим регулятором секреции альдостерона является уровень ангиотензина II в плазме, который увеличивает секрецию альдостерона.
Высокий уровень калия в плазме также увеличивает секрецию альдостерона, потому что, помимо удержания Na +, высокий уровень альдостерона в плазме вызывает потерю K + почками. Уровни Na + в плазме мало влияют на секрецию альдостерона.
Ренин-ангиотензиновая система : Регулирование натрия через гормоны ренин, ангиотензин и альдостерон.В состояниях истощения натрия уровень альдостерона повышается, а в состояниях избытка натрия уровень альдостерона снижается.
Низкое перфузионное давление почек стимулирует высвобождение ренина, который образует ангиотензин I, который превращается в ангиотензин II. Ангиотензин II корректирует низкое перфузионное давление, вызывая сужение кровеносных сосудов, и увеличивает задержку натрия за счет своего прямого воздействия на проксимальные почечные канальцы и эффекта, действующего через альдостерон.Давление перфузии надпочечников имеет небольшое прямое влияние на секрецию альдостерона, а низкое кровяное давление управляет альдостероном через систему ренин-ангиотензин.
Альдостерон также действует на потовые протоки и эпителий толстой кишки, сохраняя натрий. Когда альдостерон активируется для удержания натрия, уровень натрия в плазме имеет тенденцию повышаться. Это немедленно вызывает высвобождение АДГ, что вызывает задержку воды, таким образом уравновешивая Na + и h3O в правильной пропорции для восстановления объема плазмы.
Помимо альдостерона и ангиотензина II, на экскрецию натрия влияют и другие факторы.
- Пептид предсердий вызывает потерю натрия почками: он секретируется сердцем в состояниях с высоким содержанием натрия из-за избыточного потребления или сердечных заболеваний.
- Повышенное кровяное давление также вызывает потерю Na +, а низкое кровяное давление обычно приводит к задержке натрия.
Положение о балансе калия
Калий — это в основном внутриклеточный ион.
Цели обучения
Описать механизмы регуляции баланса калия
Основные выводы
Ключевые моменты
- Большая часть калия в организме находится внутри клеток, и следующая по величине доля находится в костях.
- В необработанной диете калия намного больше, чем натрия, и он присутствует в виде органической соли, а натрий добавляется в виде NaCl.
- Высокое потребление калия может потенциально увеличить внеклеточный уровень K + в два раза, прежде чем почки смогут вывести лишний калий.
- Высокий уровень калия в плазме увеличивает секрецию альдостерона, что увеличивает потерю калия организмом для восстановления баланса.
Ключевые термины
- щелочные : Состояние, при котором снижается концентрация ионов водорода в плазме артериальной крови (алкалиемия). Обычно считается, что алкалоз возникает, когда pH крови превышает 7,45.
- Калий : химический элемент с символом K и атомным номером 19. Элементарный калий — это мягкий серебристо-белый щелочной металл, который быстро окисляется на воздухе и очень реагирует с водой — он может выделять достаточно тепла, чтобы воспламенить водород выделяется в результате реакции.
- ацидоз : Повышение кислотности крови и других тканей тела (т. Е. Повышенная концентрация ионов водорода). Если не уточнять, это обычно относится к кислотности плазмы крови.
Баланс калия
Калий — это преимущественно внутриклеточный ион. Большая часть калия в организме (около 4000 ммоль) находится внутри клеток, а следующая по величине доля (300–500 ммоль) находится в костях. Концентрация К + в клетках составляет около 150 ммоль / л, но варьируется в разных органах.Внеклеточный калий составляет около 4,0 ммоль / л, при внеклеточном значении около 13 литров, здесь присутствует 52 ммоль (т.е. менее 1,5%) и только 12 ммоль находится в плазме.
В необработанной диете калия гораздо больше, чем натрия. Он присутствует в виде органической соли, а натрий добавляется в виде NaCl. У охотника-собирателя потребление K + может достигать 400 ммоль / день, в то время как в западной диете оно составляет 70 ммоль / день или меньше, если человек ест минимальное количество свежих фруктов и овощей.
При переработке пищевых продуктов K + заменяется NaCl.В то время как организм может выделять большую нагрузку K +, он не может сохранять K +. При нулевом потреблении K + или у человека с его истощением, потеря K + с мочой и калом составляет 30–50 ммоль / день.
Кислотно-щелочной контроль статуса
Если есть высокое потребление калия, например, 100 ммоль, это потенциально может увеличить внеклеточный уровень K + в два раза, прежде чем почки смогут вывести лишний калий. Организм буферизует лишний калий, уравновешивая его в клетках.
Кислотно-щелочной статус контролирует распределение между плазмой и клетками. Высокий pH (то есть алкалоз> 7,4) способствует перемещению K + в клетки, а низкий pH (то есть ацидоз) вызывает движение из клетки. Высокий уровень калия в плазме увеличивает секрецию альдостерона, что увеличивает потерю калия из организма для восстановления баланса.
Это изменение распределения в зависимости от кислотно-основного статуса означает, что K + в плазме может не отражать общее содержание в организме.Следовательно, у человека с ацидозом (pH 7,1) и уровнем K + в плазме 6,5 ммоль / л может быть истощено содержание калия в организме. Это происходит при диабетическом ацидозе. И наоборот, у человека, страдающего алкалозом с уровнем K + в плазме 3,4 ммоль / л, может быть нормальный уровень общего калия в организме.
Положение о балансе кальция и фосфата
Кальций — ключевой электролит: 99% откладывается в костях, а оставшаяся часть связана с высвобождением гормонов и передачей клеточных сигналов.
Цели обучения
Описание регулирования кальциево-фосфатного баланса
Основные выводы
Ключевые моменты
- Всасывание кальция контролируется витамином D, а выведение кальция — паратиреоидными гормонами.
- Происходит постоянная потеря кальция почками, даже если его нет в рационе.
- Кальций в плазме существует в трех формах: ионизированной, неионизированной и связанной с белками.
Ключевые термины
- кальций : химический элемент с атомным номером 20, который является щелочноземельным металлом и встречается в природе в виде карбоната в известняке и силиката во многих породах.
- гормон паращитовидной железы : полипептидный гормон, который вырабатывается главными клетками паращитовидных желез и участвует в повышении уровня ионов кальция в крови.
- витамин D : жирорастворимый витамин, необходимый для нормального развития костей и предотвращающий рахит; он может образовываться в коже под воздействием солнечного света.
Кальций — очень важный электролит. Девяносто девять процентов или более откладывается в костях, а оставшаяся часть играет жизненно важную роль в нервной проводимости, сокращении мышц, высвобождении гормонов и передаче сигналов клетками.
Концентрация Са ++ в плазме — 2,2 ммоль / л, фосфата — 1.0 ммоль / л. Произведение растворимости Са и Р близко к насыщению в плазме. Концентрация Са ++ в цитоплазме <10–6 ммоль / л, но концентрация Са ++ в клетке намного выше, поскольку кальций поглощается (и может высвобождаться) клеточными органеллами.
В типичной австралийской диете содержится около 1200 мг / сут кальция. Даже если он полностью растворим, он не всасывается, так как он соединяется с фосфатами в кишечных секретах. Кроме того, всасывание регулируется активным витамином D; повышенное количество витамина D увеличивает всасывание Са ++.
Абсорбция контролируется витамином D, а выведение — паратиреоидными гормонами. Однако распределение из кости в плазму контролируется как гормонами паращитовидной железы, так и витамином D.
Также происходит постоянная потеря кальция через почки, даже если его нет в рационе. Выведение кальция почками и его распределение между костью и остальным телом в первую очередь контролируется паратиреоидным гормоном.
Кальций в плазме существует в трех формах:
- Ионизированный.
- Неионизированный.
- Связанный с белком.
Паращитовидная железа контролирует концентрацию ионизированного кальция: если она низкая, секреция паратироидного гормона увеличивается. Это увеличивает уровень ионизированного кальция за счет увеличения реабсорбции костями, уменьшения почечной экскреции и воздействия на почки, увеличивая скорость образования активного витамина D, тем самым увеличивая всасывание кальция в кишечнике.
Обычное количество фосфата в рационе составляет около 1 г / день, но не весь он усваивается.Избыток выводится почками, и это выведение увеличивается за счет паратироидного гормона.
Этот гормон также вызывает вымывание фосфатов из костей. Фосфат плазмы не оказывает прямого влияния на секрецию паратиреоидного гормона; однако, если он повышен, он соединяется с Ca ++, чтобы уменьшить ионизированный Ca ++ в плазме и, таким образом, увеличить секрецию паратироидного гормона.
Регулирование кальция : Это иллюстрация того, как паратироидный гормон регулирует уровень кальция в крови.
Постановление об анионах
Анионы хлорид, бикарбонат и фосфат играют важную роль в поддержании баланса и нейтральности жизненно важных механизмов организма.
Цели обучения
Описать анионную регуляцию в организме
Основные выводы
Ключевые моменты
- Хлорид необходим для поддержания надлежащей гидратации, а также для баланса катионов и поддержания электрической нейтральности внеклеточной жидкости.
- Бикарбонат играет главную роль в поддержании кислотно-щелочного баланса организма через буферную систему.
- Фосфат является основным компонентом внутриклеточной жидкости, он важен для регуляции метаболических процессов и в качестве буферного агента в клетках животных.
- Почки регулируют солевой баланс в крови, контролируя выведение и реабсорбцию различных ионов.
Ключевые термины
- анион : отрицательно заряженный ион.
- гиперфосфатемия : повышенное количество фосфатов в крови.
- гипохлоремия : нарушение электролитного баланса, вызванное аномально низким уровнем хлорид-ионов в крови.
- гипофосфатемия : нарушение электролитного баланса, вызванное аномально низким уровнем фосфата в крови.
Постановление об анионах
Выведение ионов происходит в основном через почки, при этом меньшее количество ионов теряется с потом и калом.Кроме того, чрезмерное потоотделение может вызвать значительную потерю, особенно хлорида аниона. Сильная рвота или диарея также вызывают потерю ионов хлорида и бикарбоната.
Регулировка дыхательной и почечной функций позволяет организму регулировать уровни этих ионов во внеклеточной жидкости (ECF).
Хлорид
Хлорид является преобладающим внеклеточным анионом и вносит основной вклад в градиент осмотического давления между внутриклеточной жидкостью (ICF) и внеклеточной жидкостью (ECF).Хлорид поддерживает надлежащую гидратацию и балансирует катионы в ECF, чтобы сохранить электрическую нейтральность этой жидкости. Пути секреции и реабсорбции ионов хлора в почечной системе повторяют пути ионов натрия.
Гипохлоремия или уровень хлоридов в крови ниже нормы может возникать из-за нарушения всасывания почечными канальцами. Рвота, диарея и метаболический ацидоз также могут привести к гипохлоремии.
Напротив, гиперхлоремия или уровни хлоридов в крови выше нормы могут возникать из-за обезвоживания, чрезмерного потребления пищевой соли (NaCl) или проглатывания морской воды, интоксикации аспирином, застойной сердечной недостаточности и наследственных хронических заболеваний легких. болезнь муковисцидоз.У людей с муковисцидозом уровень хлоридов в поту в два-пять раз превышает нормальный уровень; поэтому анализ их пота часто используется для диагностики болезни.
Бикарбонат
Бикарбонат — второй по распространенности анион в крови. Его основная функция — поддерживать кислотно-щелочной баланс вашего тела, будучи частью буферных систем.
Бикарбонат-ионы возникают в результате химической реакции, которая начинается с молекул углекислого газа (CO 2 ) и воды (H 2 O), которые образуются в конце аэробного метаболизма.Лишь небольшое количество CO 2 может растворяться в жидкостях организма; таким образом, более 90 процентов CO 2 превращается в ионы бикарбоната, HCO 3 -, посредством следующих реакций:
CO 2 + H 2 O ↔ H 2 CO 3 ↔ H 2 CO 3 — + H +
Двунаправленные стрелки указывают на то, что реакции могут идти в любом направлении в зависимости от концентраций реагентов и продуктов. Углекислый газ в больших количествах вырабатывается в тканях с высокой скоростью метаболизма и превращается в бикарбонат в цитоплазме красных кровяных телец под действием фермента, называемого карбоангидраза.
Бикарбонат транспортируется в крови, а попав в легкие, реакция меняется в обратном направлении, и CO 2 регенерируется из бикарбоната и выдыхается как отходы метаболизма.
Бикарбонат как буферная система : В легких CO 2 образуется из бикарбоната и удаляется как отходы метаболизма посредством обратной реакции двунаправленного уравнения бикарбоната.
Фосфат
Фосфат присутствует в организме в трех ионных формах:
- H 2 PO 4 —
- HPO 4 2−
- ПО 4 3−
Добавление и удаление фосфата из белков во всех клетках является ключевой стратегией регуляции метаболических процессов.Фосфат полезен в клетках животных в качестве буферного агента, и наиболее распространенной формой является HPO 2- 4 . Кости и зубы связывают 85 процентов фосфатов в организме в составе солей фосфата кальция. Кроме того, фосфат содержится в фосфолипидах, таких как те, которые составляют клеточную мембрану, а также в АТФ, нуклеотидах и буферах.
Гипофосфатемия, или аномально низкий уровень фосфатов в крови, возникает при интенсивном употреблении антацидов, во время отмены алкоголя и во время недоедания.Перед лицом истощения фосфатов почки обычно сохраняют фосфаты, но во время голодания это сохранение сильно нарушается.
Гиперфосфатемия или аномально повышенный уровень фосфатов в крови возникает при снижении функции почек или в случаях острого лимфолейкоза. Кроме того, поскольку фосфат является основным компонентом ICF, любое значительное разрушение клеток может привести к сбросу фосфата в ECF.
Генетически закодированные флуоресцентные индикаторы для визуализации внутриклеточной концентрации ионов калия
Палмер, Б. Ф. Регулирование гомеостаза калия. Clin. Варенье. Soc. Нефрол. 10 , 1050–1060 (2015).
CAS
Статья
Google Scholar
Падмавар П., Яо X., Блох О., Мэнли Г. Т. и Веркман А. С. К + волны в коре головного мозга, визуализированные с помощью длинноволнового K + -чувствительного флуоресцентного индикатора. Nat. Методы 2 , 825–827 (2005).
CAS
Статья
Google Scholar
Флоренс Г., Перейра Т. и Куртс Дж. Динамика внеклеточного калия в гипервозбудимом состоянии иктальной активности нейронов. Commun. Нелинейные науки. Нумер. Simul. 17 , 4700–4706 (2012).
Артикул
Google Scholar
Sica, D. A. et al. Важность калия при сердечно-сосудистых заболеваниях. J. Clin. Гипертоническая болезнь. 4 , 198–206 (2002).
CAS
Статья
Google Scholar
Warny, M. & Kelly, C.P. Некроз моноцитарных клеток опосредуется истощением калия и каспазоподобными протеазами. Am. J. Physiol. 276 , C717 – C724 (1999).
CAS
Статья
Google Scholar
Yaron, J. R. et al. K (+) регулирует Ca (2+), чтобы управлять сигнализацией инфламмасом: динамическая визуализация ионного потока в живых клетках. Cell Death Dis. 6 , e1954 (2015).
CAS
Статья
Google Scholar
Groß, C.J. et al. K (+) отток-независимая активация инфламмасомы NLRP3 небольшими молекулами, нацеленными на митохондрии. Иммунитет 45 , 761–773 (2016).
Артикул
Google Scholar
Растегар А., Сулеймани М. и Растергар А. Гипокалиемия и гиперкалиемия. Аспирантура. Med. J. 77 , 759–764 (2001).
CAS
Статья
Google Scholar
Чаттерджи, Р., Йе, Х.-К., Эдельман, Д. и Бранкати, Ф. Калий и риск диабета 2 типа. Эксперт Rev. Endocrinol. Метаб. 6 , 665–672 (2011).
CAS
Статья
Google Scholar
Франт, М. С. и Росс, Дж. У. Мл. Электрод, специфичный для ионов калия, с высокой селективностью для калия по сравнению с натрием. Наука 167 , 987–988 (1970).
CAS
Статья
Google Scholar
Минта, А. и Цзянь, Р. Ю. Флуоресцентные индикаторы цитозольного натрия. J. Biol. Chem. 264 , 19449–19457 (1989).
CAS
PubMed
Google Scholar
Rimmele, T. S. & Chatton, J.-Y. Новый подход к оптической внутриклеточной визуализации динамики калия в астроцитах. PLoS ONE 9 , e109243 (2014).
Артикул
Google Scholar
Zhou, X. et al. Новый высокоселективный флуоресцентный датчик K +. J. Am. Chem. Soc. 133 , 18530–18533 (2011).
CAS
Статья
Google Scholar
Kong, X. et al. Высокоселективный флуоресцентный сенсор K (+), нацеленный на митохондрии. Angew. Chem. Int. Эд. Англ. 54 , 12053–12057 (2015).
CAS
Статья
Google Scholar
Ашраф, К. У. и др. Связывающий калий белок Kbp является цитоплазматическим сенсором калия. Структура 24 , 741–749 (2016).
CAS
Статья
Google Scholar
Йейтс К. и Бейтман А. Домен BON: предполагаемый домен связывания с мембраной. Trends Biochem. Sci. 28 , 352–355 (2003).
CAS
Статья
Google Scholar
Buist, G., Steen, A., Kok, J. & Kuipers, O. P. LysM, широко распространенный белковый мотив для связывания с (пептидо) гликанами. Мол. Microbiol. 68 , 838–847 (2008).
CAS
Статья
Google Scholar
Карлсон, Х. Дж. И Кэмпбелл, Р. Е. Генетически кодированные биосенсоры на основе FRET для многопараметрической флуоресцентной визуализации. Curr. Opin. Biotechnol. 20 , 19–27 (2009).
CAS
Статья
Google Scholar
Линденбург, Л. и Мерккс, М. Разработка генетически кодированных датчиков FRET. Датчики 14 , 11691–11713 (2014).
CAS
Статья
Google Scholar
Фроммер В. Б., Дэвидсон М. В. и Кэмпбелл Р. Е. Генетически кодируемые биосенсоры на основе сконструированных флуоресцентных белков. Chem. Soc. Ред. 38 , 2833–2841 (2009).
CAS
Статья
Google Scholar
Кэмпбелл Р. Э. Биосенсоры на основе флуоресцентных белков: модуляция передачи энергии как принцип конструкции. Анал. Chem. 81 , 5972–5979 (2009).
CAS
Статья
Google Scholar
Бэрд, Г. С., Захариас, Д.A. & Tsien, R. Y. Круговая перестановка и вставка рецептора в зеленые флуоресцентные белки. Proc. Natl Acad. Sci. США 96 , 11241–11246 (1999).
CAS
Статья
Google Scholar
Zhao, Y. et al. Расширенная палитра генетически закодированных индикаторов Ca 2+ . Наука 333 , 1888–1891 (2011).
CAS
Статья
Google Scholar
Miyawaki, A. et al. Флуоресцентные индикаторы Ca2 + на основе зеленых флуоресцентных белков и кальмодулина. Nature 388 , 882–887 (1997).
CAS
Статья
Google Scholar
Линденбург, Л. Х., Винкенборг, Дж. Л., Оортвейн, Дж., Апер, С. Дж. А. и Мерк, М. MagFRET: первый генетически кодируемый флуоресцентный сенсор Mg2 +. PLoS ONE 8 , e82009 (2013).
Артикул
Google Scholar
Диттмер, П. Дж., Миранда, Дж. Г., Горски, Дж. А. и Палмер, А. Е. Генетически закодированные сенсоры для выяснения пространственного распределения клеточного цинка. J. Biol. Chem. 284 , 16289–16297 (2009).
CAS
Статья
Google Scholar
Конли, Дж. М., Радхакришнан, С., Валентино, С. А. и Тантама, М. Визуализация внеклеточного АТФ с помощью генетически кодируемого ратиометрического флуоресцентного сенсора. PLoS ONE 12 , e0187481 (2017).
Артикул
Google Scholar
Hires, S. A., Zhu, Y. & Tsien, R. Y. Оптическое измерение синаптического спилловера и обратного захвата синаптического глутамата оптимизированными для линкера глутамат-чувствительными флуоресцентными репортерами. Proc. Natl Acad. Sci. США 105 , 4411–4416 (2008).
CAS
Статья
Google Scholar
Okumoto, S. et al. Обнаружение высвобождения глутамата из нейронов с помощью генетически закодированных наносенсоров FRET, отображаемых на поверхности. Proc. Natl. Акад. Sci. США 102 , 8740–8745 (2005).
CAS
Статья
Google Scholar
Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W. & Knöpfel, T. Разработка генетически кодируемого флуоресцентного датчика напряжения, использующего быстрые движения измерения напряжения Ci-VSP. PLoS ONE 3 , e2514 (2008 г.).
Артикул
Google Scholar
Gao, X. & Zhang, J. Пространственно-временной анализ дифференциальной регуляции Akt в микродоменах плазматической мембраны. Мол. Биол. Ячейка 19 , 4366–4373 (2008).
CAS
Статья
Google Scholar
Imamura, H. et al. Визуализация уровней АТФ внутри отдельных живых клеток с помощью генетически кодируемых индикаторов на основе флуоресцентного резонансного переноса энергии. Proc. Natl Acad. Sci. США 106 , 15651–15656 (2009).
CAS
Статья
Google Scholar
Bischof, H. et al. Новые генетически закодированные флуоресцентные зонды позволяют в реальном времени обнаруживать калий in vitro и in vivo. Nat. Commun. 8 , 1422 (2017).
Артикул
Google Scholar
Markwardt, M. L. et al. Улучшенный лазурный флуоресцентный белок с повышенной яркостью и уменьшенным обратимым фотопереключением. PLoS ONE 6 , e17896 (2011).
CAS
Статья
Google Scholar
Нагаи, Т., Ямада, С., Томинага, Т., Итикава, М. и Мияваки, А. Расширенный динамический диапазон флуоресцентных индикаторов для Ca (2+) за счет циркулярно пермутированных желтых флуоресцентных белков. Proc. Natl Acad. Sci. США 101 , 10554–10559 (2004).
CAS
Статья
Google Scholar
Cranfill, P.J. et al. Количественная оценка флуоресцентных белков. Nat. Методы 13 , 557–562 (2016).
CAS
Статья
Google Scholar
Fritz, R.D. et al. Универсальный набор инструментов для создания чувствительных биосенсоров FRET для визуализации сигналов во времени и пространстве. Sci. Сигнал. 6 , RS12 (2013).
Артикул
Google Scholar
Bajar, B.T. et al. Повышение яркости и фотостабильности зеленых и красных флуоресцентных белков для визуализации живых клеток и отчетов FRET. Sci. Отчетность 6 , 20889 (2016).
CAS
Статья
Google Scholar
Накай, Дж., Окура, М. и Имото, К. Зонд Ca2 + с высоким отношением сигнал-шум, состоящий из одного зеленого флуоресцентного белка. Nat. Biotechnol. 19 , 137–141 (2001).
CAS
Статья
Google Scholar
Qian, Y., Rancic, V., Wu, J., Ballanyi, K. & Campbell, R.E. Биолюминесцентный индикатор Ca2 +, основанный на топологическом варианте GCaMP6s. Chembiochem . https://doi.org/10.1002/cbic.201800255 (2018).
Wu, J. et al. Генетически закодированные индикаторы глутамата с измененным цветом и топологией. ACS Chem. Биол. 13 , 1832–1837 (2018).
CAS
Статья
Google Scholar
Барыкина Н.В. и др. Новый дизайн зеленого индикатора кальция с меньшим размером и уменьшенным количеством сайтов связывания кальция. Sci. Отчетность 6 , 34447 (2016).
CAS
Статья
Google Scholar
Андерссон, Б., Янсон, В., Бехнам-Мотлаг, П., Хенрикссон, Р. и Гранквист, К.Индукция апоптоза за счет истощения внутриклеточных ионов калия: использование флуоресцентного красителя PBFI в 96-луночном планшете в культивируемых клетках рака легких. Toxicol. Vitr. 20 , 986–994 (2006).
CAS
Статья
Google Scholar
Ohtsuka, K. et al. Флуоресцентная визуализация ионов калия в живых клетках с использованием флуоресцентного зонда на основе конъюгата тромбин-связывающий аптамер-пептид. Chem.Commun. 48 , 4740–4742 (2012).
CAS
Статья
Google Scholar
Дирнагл, У., Иадекола, К. и Московиц, М. А. Патобиология ишемического инсульта: комплексный взгляд. Trends Neurosci. 22 , 391–397 (1999).
CAS
Статья
Google Scholar
Yu, S. P., Yeh, C., Strasser, U., Tian, M. & Choi, D.W. Опосредованный рецептором NMDA отток K + и апоптоз нейронов. Наука 284 , 336–339 (1999).
CAS
Статья
Google Scholar
Hösli, L., Hösli, E., Landolt, H. & Zehntner, C. Отток калия из нейронов, возбужденных глутаматом и аспартатом, вызывает деполяризацию культивируемых глиальных клеток. Neurosci. Lett. 21 , 83–86 (1981).
Артикул
Google Scholar
Ballanyi, K. & Grafe, P. Внутриклеточный анализ движений ионов, связанных с гамма-аминомасляной кислотой, в симпатических нейронах крыс. J. Physiol. 365 , 41–58 (1985).
CAS
Статья
Google Scholar
Граф П. и Баллани К. Клеточные механизмы гомеостаза калия в нервной системе млекопитающих. банка. J. Physiol. Pharmacol. 65 , 1038–1042 (1987).
CAS
Статья
Google Scholar
Ballanyi, K., Grafe, P. & ten Bruggencate, G. Ионная активность и механизмы захвата калия глиальными клетками в срезах обонятельной коры головного мозга морских свинок. J. Physiol. 382 , 159–174 (1987).
CAS
Статья
Google Scholar
Белхаге Б., Хансен Г. Х. и Шоусбо А. Деполяризация под действием К + и глутамата активирует различные механизмы высвобождения нейромедиаторов в ГАМКергических нейронах: везикулярное или невезикулярное высвобождение ГАМК. Неврология 54 , 1019–1034 (1993).
CAS
Статья
Google Scholar
Shen, Y. et al. Генетически кодируемый индикатор Ca2 + на основе циркулярно пермутированного красного флуоресцентного белка морского анемона eqFP578. BMC Biol. 16 , 9 (2018).
Артикул
Google Scholar
Kuffler, S. W. Нейроглиальные клетки: физиологические свойства и опосредованный калием эффект нейрональной активности на потенциал глиальной мембраны. Proc. R. Soc. Лондон. B Biol. Sci. 168 , 1-21 (1967).
CAS
Статья
Google Scholar
Рэнсом, Б. Р. и Голдринг, С. Ионные детерминанты мембранного потенциала клеток, предположительно являющихся глией в коре головного мозга кошек. J. Neurophysiol. 36 , 855–868 (1973).
CAS
Статья
Google Scholar
Хенн, Ф.А., Хальямяэ, Х. и Хамбергер, А. Функция глиальных клеток: активный контроль внеклеточной концентрации K +. Brain Res. 43 , 437–443 (1972).
CAS
Статья
Google Scholar
Хорио Ю. Калиевые каналы глиальных клеток: распределение и функции. Jpn. J. Pharmacol. 87 , 1–6 (2001).
CAS
Статья
Google Scholar
Olsen, M. L. et al. Новые сведения об ионных каналах астроцитов: критически важны для гомеостаза и передачи сигналов нейрон-глии. J. Neurosci. 35 , 13827–13835 (2015).
CAS
Статья
Google Scholar
Horikawa, K. et al. Спонтанная сетевая активность визуализируется сверхчувствительными индикаторами Ca (2+), желтый Cameleon-Nano. Nat. Методы 7 , 729–732 (2010).
CAS
Статья
Google Scholar
Thestrup, T. et al. Оптимизированные ратиометрические датчики кальция для функциональной визуализации нейронов и Т-лимфоцитов in vivo. Nat. Методы 11 , 175–182 (2014).
CAS
Статья
Google Scholar
Lam, A.J. et al. Улучшение динамического диапазона FRET с помощью ярко-зеленых и красных флуоресцентных белков. Nat. Методы 9 , 1005–1012 (2012).
CAS
Статья
Google Scholar
Нгуен, А. В. и Догерти, П. С. Эволюционная оптимизация флуоресцентных белков для внутриклеточного FRET. Nat. Biotechnol. 23 , 355–360 (2005).
CAS
Статья
Google Scholar
Burnier, J. V. et al. Разработка слабых вспомогательных взаимодействий для высокоэффективных зондов FRET. Nat. Методы 10 , 1021–1027 (2013).
Артикул
Google Scholar
Shaner, N.C. et al. Яркий мономерный зеленый флуоресцентный белок, полученный из Branchiostoma lanceolatum. Nat. Методы 10 , 407–409 (2013).
CAS
Статья
Google Scholar
Bindels, D. S. et al. mScarlet: яркий мономерный красный флуоресцентный белок для визуализации клеток. Nat. Методы 14 , 53–56 (2017).
CAS
Статья
Google Scholar
Барнетт, Л. М., Хьюз, Т. Э. и Дробижев, М. Расшифровка молекулярного механизма, ответственного за Ca 2+ -зависимое изменение флуоресценции GCaMP6m. PLoS ONE 12 , e0170934 (2017).
Артикул
Google Scholar
Chen, T.-W. и другие. Сверхчувствительные флуоресцентные белки для визуализации активности нейронов. Природа 499 , 295–300 (2013).
CAS
Статья
Google Scholar
Enger, R. et al. Динамика ионных сдвигов при депрессии распространения коры. Cereb. Cortex 25 , 4469–4476 (2015).
Артикул
Google Scholar
Ding, F. et al. Изменения в составе интерстициальных ионов мозга контролируют цикл сна и бодрствования. Наука 352 , 550–555 (2016).
CAS
Статья
Google Scholar
He, Y., Hara, H. & Núñez, G. Механизм и регуляция активации инфламмасомы NLRP3. Trends Biochem. Sci. 41 , 1012–1021 (2016).
CAS
Статья
Google Scholar
питательное вещество | Национальное географическое общество
Питательные вещества — это химические вещества, обнаруженные в каждом живом существе на Земле. Они необходимы для жизни людей, растений, животных и всех других организмов. Питательные вещества помогают расщеплять пищу, давая организмам энергию.Они используются во всех процессах организма. Некоторые из процессов — это рост (построение клеток), восстановление (заживление ран) и поддержание жизни (дыхание).
Растения и другие автотрофы поглощают питательные вещества из почвы и воды. Автотрофы — это организмы, которые сами могут добывать себе пищу. Наиболее важные питательные вещества, в которых они нуждаются, — это углерод, водород и кислород. Другие питательные вещества, необходимые растениям, — это азот, фосфор, калий, кальций, магний и сера.
Из этих основных питательных веществ растения и другие автотрофы синтезируют или создают свои собственные питательные вещества, такие как сахар.Организм человека также может синтезировать некоторые питательные вещества, например, аминокислоты. Однако большинству организмов необходимы питательные вещества, созданные автотрофами. Люди и животные получают большую часть питательных веществ из пищи.
Основные питательные вещества — это питательные вещества, которые человеческий организм не может синтезировать. Их нужно получать с пищей или водой. Основные питательные вещества включают углеводы, белки, жиры, витамины и минералы.
Углеводы, белки и жиры являются частью группы основных питательных веществ, называемых макроэлементами.«Макро-» означает большой, и это те питательные вещества, в которых человек нуждается в наибольшем количестве. Продукты с высоким содержанием макроэлементов включают картофель с высоким содержанием углеводов; орехи с высоким содержанием белка; и авокадо с высоким содержанием жиров.
Каждый макроэлемент обеспечивает определенное количество энергии. Мы знаем, сколько энергии содержится в той или иной пище, по тому, сколько в ней калорий. Калория — это единица энергии. Думайте о калориях как о галлонах топлива в баке: если ваша машина может проехать 20 километров, используя один галлон топлива, а вы совершаете 40-километровую поездку, вы знаете, что вам нужно два галлона топлива.Калории — это топливо для человеческого тела.
Витамины и минералы являются частью группы основных питательных веществ, называемых микронутриентами. «Микро-» означает маленький; людям нужны микроэлементы в небольших количествах. Витамины имеют такие названия, как витамин A, витамин C и витамин D. Витамины содержат углерод, что означает, что они являются органическими соединениями. Минералы, такие как кальций и железо, поступают из земли или окружающей среды. Минералы не содержат углерода, что означает, что они неорганические соединения.
Питательные вещества в окружающей среде
Питательные вещества накапливаются или накапливаются в окружающей среде.Богатые питательными веществами почва или вода содержат большое количество азота, углерода, фосфора, серы и калия. Эти питательные вещества могут поступать из естественных источников, таких как останки растений и животных. Когда растения и животные умирают, они разлагаются. При разложении питательные вещества попадают в окружающую среду.
Деятельность человека также добавляет питательные вещества в почву и воду. Многие фабрики используют питательные вещества, чтобы сохранить свою продукцию. Питательные вещества выбрасываются в атмосферу в виде газа или жидкости. В любом случае питательные вещества попадают в круговорот воды.
Сточные воды и сточные воды также богаты питательными веществами, такими как углерод. Сточные воды часто используются на полях для гольфа, где они попадают в местные ручьи в качестве стока. Очищенные сточные воды иногда сбрасываются прямо в окружающую среду.
Удобрения, используемые в сельском хозяйстве, богаты углеродом, азотом и фосфором. Фермеры используют удобрения для выращивания таких культур, как зерновые, фрукты и овощи. Удобрения на основе фосфора также используются на полях для гольфа, парках и даже на лужайках в окрестностях.
Удобрение, которое не усваивается растениями, накапливается в почве.Питательные вещества из удобрений также могут попадать в грунтовые воды или сточные воды. Богатый питательными веществами сток попадает в ручьи, реки и заливы. Пруды, озера и даже океан могут поглощать огромное количество питательных веществ, особенно азота и фосфора.
Баланс питательных веществ
Питательные вещества, такие как углерод, кислород и азот, делают возможной всю жизнь. Бедные питательными веществами районы не могут поддерживать биологическое разнообразие. Например, болота — это бедные питательными веществами водно-болотные угодья в прохладном климате. Почва болот намного более кислая, чем плодородная или богатая питательными веществами почва.На бедной питательными веществами болотной почве могут расти некоторые виды растений. При меньшем количестве доступных видов растений экосистема не может поддерживать большое количество других организмов, таких как животные и грибы.
Введение питательных веществ в окружающую среду может сделать экосистему здоровой и плодородной. Апвеллинг — это естественный процесс выталкивания холодной, богатой питательными веществами воды в верхние слои океана. Апвеллинг приносит огромное количество питательных веществ рыбам, водорослям и морским млекопитающим.Экономическая активность также зависит от апвеллинга. Например, рыболовство у западного побережья Южной Америки зависит от ежегодного апвеллинга Тихого океана, который приносит питательные вещества в запасы рыбы и моллюсков.
Избыточные питательные вещества
Хотя жизнь зависит от питательных веществ, слишком много питательных веществ может оказать негативное влияние на экосистему. Например, цветение водорослей вызвано избытком питательных веществ. Они действительно могут препятствовать естественному притоку питательных веществ в водную экосистему.
Цветение водорослей происходит из-за того, что избыток питательных веществ из естественных и искусственных источников накапливается в водоеме. В подходящих условиях водоросли, бактерии и другие микробы быстро цветут или размножаются. При быстром размножении используются почти все питательные вещества, содержащиеся в воде. Цветение образует тонкий коврик у поверхности воды, не позволяя свету проникать снизу.
Организмы многих цветущих водорослей не поедаются другими организмами, поэтому они не являются частью пищевой сети.Цветение водорослей расходует важные питательные вещества, в том числе кислород, не влияя на водную среду. Некоторые цветущие водоросли даже содержат токсичные микробы. Этот тип цветения водорослей называется вредоносным цветением водорослей (ВЦВ). Без света и кислорода растения быстро погибают. Цветение водорослей расходует питательные вещества и препятствует развитию растений, от которых зависит выживание рыб и других живых существ.
Цветение водорослей может исчезнуть так же быстро, как и сформироваться. Мертвые водоросли и другие микробы опускаются на дно водоема.Солнечный свет и питательные вещества снова могут проникать в экосистему. Однако бактерии, которые помогают разложить цветение водорослей, теперь поглощают большую часть этих питательных веществ. Восстановление экосистемы после цветения водорослей может занять недели или даже месяцы.
Цветение водорослей может уменьшить количество питательных веществ в области до такой степени, что область известна как мертвая зона. Это означает, что немногие организмы могут выжить в окружающей среде. В мертвых зонах не хватает питательных веществ, чтобы поддерживать пищевую сеть.
Избыток питательных веществ в Чесапикском заливе
Мертвые зоны — частая проблема для Чесапикского залива, огромного лимана на восточном побережье США.В этом регионе проживает 13,6 миллиона человек. Его водораздел включает крупные городские районы Вашингтона, округ Колумбия, и Балтимора и Аннаполиса, штат Мэриленд.
Западный коридор Чесапикского залива является высоко индустриализированным. Восточный коридор является домом для многих фермерских общин. Сток с заводов, домов и ферм загрязнил залив избыточными питательными веществами.
Размер и продолжительность мертвых зон в Чесапикском заливе различаются. Они зависят от сезона и погоды. Во время сильных дождей в залив смывается больше питательных веществ.Весной и летом фермы удобряют посевы, что способствует увеличению стока питательных веществ. Около одной трети избытка питательных веществ в Чесапикском заливе является результатом загрязнения воздуха. При сжигании ископаемого топлива в воздух попадают углерод и азот. В конце концов, эти питательные вещества возвращаются в почву и воду через круговорот воды.
Люди и предприятия могут контролировать выделяемые ими питательные вещества. Дома люди могут помочь, используя удобрения, не содержащие фосфор, и не допускают попадания мусора с газона в желоб.Местные растения помогают фильтровать воду и предотвращают попадание мусора в водосбор. Обеспечение отсутствия протечек в септических системах, безопасная утилизация бытовой химии (например, краски и батарей) и минимизация действий, вызывающих эрозию почвы, также помогают предотвратить цветение водорослей.
Фабрики и фермы могут помочь контролировать количество питательных веществ, выбрасываемых в окружающую среду, за счет соблюдения стандартов безопасности и сокращения стока.
Удобрение 101: Большая тройка — азот, фосфор и калий | TFI
Это возделываемые пахотные земли, которые позволяют человечеству выжить и процветать.Растения дают пищу, клетчатку, жилье и множество других преимуществ, а удобрения играют ключевую роль в этом процессе. Поскольку ожидается, что к 2050 году численность населения мира превысит 9 миллиардов человек, удобрения будут необходимы больше, чем когда-либо, для увеличения производства сельскохозяйственных культур, чтобы люди были сыты и здоровы.
Все растущие растения нуждаются в 17 основных элементах, чтобы полностью раскрыть свой генетический потенциал. Из них 17 поглощаются растениями через почву, а остальные три поступают из воздуха и воды.
Поколения почвоведов дали знания о том, как проверять уровни питательных веществ в почве, как растения усваивают их и как лучше всего восполнить эти питательные вещества после сбора урожая.Вот тут-то и пригодятся удобрения.
Азот, фосфор и калий, или NPK, являются основными питательными веществами «большой тройки» в коммерческих удобрениях. Каждое из этих основных питательных веществ играет ключевую роль в питании растений.
Азот считается самым важным питательным веществом, и растения поглощают больше азота, чем любой другой элемент. Азот необходим для того, чтобы растения были здоровыми по мере их развития и питательными для употребления в пищу после сбора урожая. Это потому, что азот необходим для образования белка, а белок составляет большую часть тканей большинства живых существ.Ниже представлена фотография кукурузы с дефицитом азота.
Вторая из Большой тройки, фосфор, связана со способностью растений использовать и накапливать энергию, включая процесс фотосинтеза. Он также необходим для нормального роста и развития растений. Фосфор в коммерческих удобрениях поступает из фосфоритов. Ниже представлена фотография кукурузы с дефицитом фосфора.
Калий — третье по важности питательное вещество коммерческих удобрений.Он помогает укрепить способность растений противостоять болезням и играет важную роль в повышении урожайности и общего качества. Калий также защищает растение в холодную или сухую погоду, укрепляя его корневую систему и предотвращая увядание. Ниже представлена фотография кукурузы с дефицитом калия.
Большая тройка — азот, фосфор и калий — являются основными питательными веществами современных коммерческих удобрений. Следите за The Voice, поскольку мы продолжим углубленное изучение удобрений в предстоящие недели.
Для получения дополнительной информации о питательных веществах «большой тройки» в коммерческих удобрениях ознакомьтесь с обучающими модулями 4R по азоту , фосфору и калию .
Недавно обнаруженная группа клеток в кончике корня реагирует на дефицит калия и управляет сигнальными путями, опосредующими адаптацию растений — ScienceDaily
Калий является важным питательным веществом для всего живого. Он нужен растениям в больших количествах, особенно для роста и для того, чтобы лучше выдерживать стресс.По этой причине они поглощают большое количество калия из почвы. В сельском хозяйстве это приводит к недостатку доступного калия в почве, поэтому минерал является важным компонентом удобрений. Группа немецких и китайских исследователей впервые показала, где и как растения обнаруживают дефицит калия в своих корнях и какие сигнальные пути координируют адаптацию роста корней и абсорбцию калия, чтобы поддерживать снабжение растений калием.
Предпосылки: Поглощение и транспортировка калия на уровне отдельных клеток относительно хорошо изучены, и многие молекулярные структуры и механизмы, которые играют роль в этих процессах, известны.Кроме того, десятилетия назад исследователи продемонстрировали, что растения очень специфично приспосабливаются к дефициту калия. Однако остается одна загадка: как растения определяют наличие калия в почве и какие механизмы лежат в основе адаптационных реакций в организме растений. Новое исследование проливает свет на эти вопросы. Результаты опубликованы в журнале Developmental Cell
.
Наблюдения противоречат учебникам
Исследователи изучили кресс-салаты (Arabidopsis thaliana), трансформированные недавно разработанным репортерным белком калия GEPII.Этот репортерный белок позволяет под микроскопом определять концентрацию и распределение ионов калия в клетках и тканях. Даже когда не было дефицита калия, исследовательская группа сделала очень удивительное открытие: концентрация этого питательного вещества в цитоплазме клеток увеличивалась с каждым клеточным слоем внутри корня, снаружи внутрь.
«Эти наблюдения были действительно удивительными, — говорит профессор Йорг Кудла из Института биологии растений и биотехнологии Мюнстерского университета (Германия).«Они противоречат учебникам, в которых говорится, что питательные вещества передаются равномерно, снаружи внутрь, к сосудистой ткани корня — не только от клетки к клетке, но и через межклеточные пространства».
«Калий чувствительная ниша» реагирует на дефицит калия
Группа исследователей впоследствии изучила, как корни реагируют на дефицит калия. При этом они впервые продемонстрировали, что если растения испытывают дефицит калия, концентрация калия снижается только в определенных клетках кончика корня.Эти «постмеристематические клетки» непосредственно над жизнеспособными стволовыми клетками в кончике корня очень быстро реагируют на дефицит калия; концентрация калия внутри клетки (в цитоплазме) снижается за секунды. Ранее не было известно, что определенная группа клеток, расположенных в центре кончика корня, реагирует на дефицит калия в окружающей среде. Исследователи назвали эту группу клеток «калий-чувствительной нишей».
«Эти наблюдения тоже были очень неожиданными, — говорит Кудла.«Если растения лишены калия, реакция проявляется только в клетках в чувствительной к калию нише; концентрация калия в других клетках корня остается неизменной. Ранее предполагалось, что естественным образом клетки в самом внешнем слое клеток, эпидермисе, сначала отреагирует на снижение концентрации калия в почве ».
Визуализация пути калия
Одновременно со снижением концентрации калия в калий-чувствительной нише в этих клетках возникают кальциевые сигналы, которые распространяются в корне.Как передающее вещество кальций контролирует многие процессы в живых организмах — точно так же, как и здесь: кальциевые сигналы запускают сложный молекулярный сигнальный каскад. Эта цепочка сигналов, которую исследователи первыми определили в деталях, в конечном итоге вызывает не только повышенное образование белков транспорта калия, но также вызывает изменения в дифференцировке тканей корня. Это способствует более эффективному поглощению ионов калия и поддерживает его распределение в растении.«Впервые, — говорит Кудла, — с помощью методов визуализации мы визуализировали путь калия в живом организме».
Результаты дают фундаментальное представление о том, где растения обнаруживают наличие необходимого питательного вещества калия и как они к нему приспосабливаются. Понимание этих процессов может в будущем помочь в разведении лучших растений для сельскохозяйственных целей и более индивидуальном использовании удобрений.
Методика
Чтобы визуализировать распределение калия в корнях растений, исследователи использовали специальные микроскопические методы (например, резонансный перенос энергии Фёрстера, FRET) в сочетании с белками-сенсорами для калия, кальция и перекиси водорода.Чтобы изучить молекулярные механизмы, исследователи создали и сравнили трансгенные растения арабидопсиса, у которых из-за различных генетических мутаций проявлялись симптомы дефицита калия.

