инструкция по применению, аналоги, состав, показания
Фармакодинамика
Нимесулид – нестероидное противовоспалительное средство (НПВС), селективно ингибирует циклооксигеназу-2 (ЦОГ-2) и в незначительной степени циклооксигеназу-1 (ЦОГ-1). В связи с чем, избирательно тормозит синтез простагландинов, индуцированных воспалительной реакцией. В то же время минимально влияет на синтез регуляторных простагландинов, из-за чего побочные реакции, особенно со стороны пищеварительного тракта, выражены минимально.
Оказывает противовоспалительное, анальгезирующее и жаропонижающее действие. Нимесулид ингибирует синтез простагландинов в очаге воспаления, лейкотриенов, фактора активации тромбоцитов, регулируя миграцию нейтрофильных гранулоцитов через эндотелий сосудов, уменьшает выход гистамина из тучных клеток, устраняя воспаление и отек, действие фактора некроза опухоли (TNFa), способствующего накоплению брадикинина и цитокинов, которые вызывают боль. Препарат снижает агрегацию анионов супероксида зрелыми лейкоцитами, не влияя на их фагоцитарную активность и предотвращая дальнейшую альтерацию. Нимесулид ингибирует коллагеназу и металлопротеазу, уменьшая деградацию хряща и предотвращая прогрессирование остеоартрита.
Нимесулид ингибирует синтез простагландинов в очаге воспаления, лейкотриенов, фактора активации тромбоцитов, регулируя миграцию нейтрофильных гранулоцитов через эндотелий сосудов, уменьшает выход гистамина из тучных клеток, устраняя воспаление и отек, действие фактора некроза опухоли (TNFa), способствующего накоплению брадикинина и цитокинов, которые вызывают боль. Препарат снижает агрегацию анионов супероксида зрелыми лейкоцитами, не влияя на их фагоцитарную активность и предотвращая дальнейшую альтерацию. Нимесулид ингибирует коллагеназу и металлопротеазу, уменьшая деградацию хряща и предотвращая прогрессирование остеоартрита.
Фармакокинетика
Адсорбция при приеме внутрь – высокая. Прием пищи снижает скорость абсорбции, не оказывая влияния на ее степень. Время достижения максимальной концентрации активного вещества в плазме крови – 2–3 ч. Связь с белками плазмы составляет 97,5%. Доза препарата не влияет на степень его связывания с белками крови. Максимальная концентрация нимесулида в плазме крови достигает 3–4 мг/л. Объем распространения – 0,19–0,35 л/кг. Метаболизируется в печени тканевыми монооксигеназами. Основной метаболит – 4-гидроксинимесулид (25%) – обладает сходной фармакологической активностью. Период полувыведения 4-гидроксинимесулида составляет 3,2–6 часов. 4-гидроксинимесулид выводится почками (50%) и с желчью (29%). У больных с легкой или умеренной почечной недостаточностью (клиренс креатинина 30–80 мл/мин), а также у лиц пожилого возраста фармакокинетический профиль нимесулида существенно не меняется.
Максимальная концентрация нимесулида в плазме крови достигает 3–4 мг/л. Объем распространения – 0,19–0,35 л/кг. Метаболизируется в печени тканевыми монооксигеназами. Основной метаболит – 4-гидроксинимесулид (25%) – обладает сходной фармакологической активностью. Период полувыведения 4-гидроксинимесулида составляет 3,2–6 часов. 4-гидроксинимесулид выводится почками (50%) и с желчью (29%). У больных с легкой или умеренной почечной недостаточностью (клиренс креатинина 30–80 мл/мин), а также у лиц пожилого возраста фармакокинетический профиль нимесулида существенно не меняется.
Частота указана в зависимости от встречаемости случая: очень часто (≥1/10), часто (<1/10 и ≥1/100), нечасто (<1/100 и ≥1/1000), редко (<1/1000 и ≥1/10000), очень редко (<1/10000).
Со стороны системы крови и лимфатической системы: редко – анемия, эозинофилия; очень редко – тромбоцитопения, панцитопеническая пурпура.
Со стороны иммунной системы: редко – гиперчувствительность, очень редко – анафилаксия.
Со стороны обмена веществ: редко – гиперкалиемия.
Со стороны психики: редко – тревога, нервозность, кошмары.
Со стороны нервной системы: нечасто – недомогание, астения, головокружение; очень редко – головная боль, сомноленция, энцефалопатия (синдром Рейе), гипотермия.
Со стороны глаз: редко – помутнение полей зрения; очень редко – нарушение зрения.
Со стороны слухового и вестибулярного аппарата: очень редко – головокружение.
Со стороны сердца и сердечно-сосудистой системы: нечасто – гипертензия; редко – тахикардия, геморрагии, колебания артериального давления, приливы.
Со стороны органов дыхания, грудной клетки, средостения: нечасто – отдышка; очень редко – бронхоспазм, приступы астмы.
Со стороны желудочно-кишечного тракта: часто – диарея, тошнота,
рвота, запор, метеоризм, гастрит; нечасто – желудочно-кишечное кровотечение, язва и перфорация язвы 12-перстной кишки или желудка; очень редко – абдоминальная боль, диспепсия, стоматит, мелена.
Со стороны гепатобилиарной системы: часто – повышение уровня ферментов печени; очень редко – гепатит (в т.ч. фульминантный, включая летальные исходы), холестатическая желтуха.
Со стороны кожи и подкожной клетчатки: нечасто – зуд, раздражение, повышенное потоотделение; редко – эритема, дерматит, крапивница, ангионевротический отек; очень редко – мультиформная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз.
Со стороны почек и мочевыводящих путей: нечасто – отеки; редко – дизурия, гематурия, задержка мочи; очень редко – почечная недостаточность, олигурия, интерстициальний нефрит.
При использовании нимесулида следует избегать его сочетания с нестероидными противовоспалительными средствами (НПВС), включая селективные ингибиторы циклооксигеназы. Следует воздерживаться от приема других сопутствующих анальгетиков.
Следует воздерживаться от приема других сопутствующих анальгетиков.
Нежелательные эффекты могут быть минимизированы при использовании самой низкой эффективной дозы в течение минимального времени, необходимого для устранения симптомов. Если состояние больного не улучшается, лечение необходимо прекратить.
Печеночные эффекты. В редких случаях могут возникать серьезные печеночные реакции, связанные с применением препарата, в том числе в очень редких случаях с летальным исходом. При появлении у больных, принимающих Нимесулид, симптомов, указывающих на повреждение печени (анорексия, тошнота, рвота, боль в животе, повышенная утомляемость, потемнение мочи) или повышения уровня печеночных трансаминаз, препарат следует отменить. Таким больным не рекомендуется принимать нимесулид в дальнейшем. В случае если у пациентов, принимающих препарат, началась лихорадка и/или гриппоподобные симптомы, лечение должно быть прекращено незамедлительно!
При непродолжительном приеме Нимесулида поражение печени обычно является обратимым.
Желудочно-кишечные нарушения. Нимесулид следует использовать с осторожностью у больных с хроническими гастроинтестинальными заболеваниями, в том числе с язвенной болезнью, желудочно-кишечными кровотечениями, язвенным колитом или болезнью Крона (в связи с риском обострения указанных заболеваний). Также его с осторожностью следует назначать пациентам, принимающим иные лекарства, которые могут увеличить риск изъязвления или кровотечения: оральные кортикостероиды, антикоагулянты (варфарин), селективные ингибиторы обратного захвата серотонина или антиагреганты (аспирин).
Желудочно-кишечное кровотечение или язва, перфорация желудка или двенадцатиперстной кишки могут развиться на фоне применения препарата и могут быть бессимптомными (в т.ч. болевыми).
Риск желудочно-кишечных кровотечений, язв или перфорации повышен при приеме высоких доз Нимесулида, у пациентов с язвой в анамнезе, у пожилых людей. Эти пациенты должны начинать лечение с самой низкой дозы. У данных пациентов, а также лиц, которые принимают Нимесулид совместно с кардиологическими дозами ацетилсалициловой кислоты, должна применяться комбинированная терапия совместно с гастропротекторами (ингибиторы протонного насоса или мизопростол).
Пациенты с желудочно-кишечными нарушениями в анамнезе и пожилые люди должны сообщать о любых необычных абдоминальных симптомах (в том числе кровотечениях), особенно на ранних этапах лечения. При возникновении язвенных поражений или геморрагических осложнений следует прекратить лечение Нимесулидом.
Пожилые люди. Пожилые люди имеют повышенную частоту побочных реакций на НПВС, высокий риск желудочно-кишечных кровотечений и перфораций, которые могут быть фатальными. Следует обеспечить тщательный контроль побочных эффектов у данной группы пациентов.
Сердечно-сосудистые и цереброваскулярные эффекты. Были описаны задержка жидкости и отеки в связи с применением НПВС. Тщательный контроль и консультации необходимы для пациентов с гипертонией и/или сердечной недостаточностью.
Клинические исследования и эпидемиологические данные показывают, что использование некоторых НПВС (особенно в высоких дозах и длительно) может быть связано с небольшим увеличением риска артериальных тромбоэмболических событий (например, инфаркта миокарда и инсульта). Имеется недостаточно данных, чтобы исключить такой риск при приеме Нимесулида.
Имеется недостаточно данных, чтобы исключить такой риск при приеме Нимесулида.
Пациентам с неконтролируемой артериальной гипертензией, застойной сердечной недостаточностью, ишемической болезнью сердца, заболеваниями периферических артерий и/или цереброваскулярными заболеваниями лекарственное средство назначается после оценки соотношения риск/польза. Аналогично следует поступать перед началом длительного лечения у пациентов с факторами риска сердечно-сосудистых заболеваний (гипертония, эпилепсия, сахарный диабет, курение).
Нимесулид может влиять на активность тромбоцитов, его следует использовать с осторожностью у больных с геморрагическим диатезом.
Нимесулид не является заменой ацетилсалициловой кислоты с целью профилактики сердечно-сосудистых заболеваний.
Нарушение функции почек. Нимесулид следует принимать с осторожностью у больных с почечной или сердечной недостаточностью, т.к. он может привести к повреждению почек. В таких случаях лечение должно быть прекращено.
Кожные эффекты. Тяжелые кожные реакции (в том числе потенциально летальные): дерматит, синдром Стивенса – Джонсона и токсический эпидермальный некролиз, в связи с приемом НПВС развиваются очень редко. Наиболее высока вероятность их развития на ранних стадиях терапии – в большинстве случаев в течение первого месяца лечения. Применение нимесулида должно быть прекращено при первом появлении кожной сыпи, поражениях слизистых оболочек или любом другом признаке непереносимости.
Как и другие НПВС, ингибирующие простагландинсинтетазу, нимесулид может привести к преждевременному закрытию боталлова протока, легочной гипертензии, олигурии, уменьшению количества околоплодных вод, повышению риска внутриутробного кровотечения, слабости родовой деятельности и развитию периферических отеков. Были отдельные случаи развития почечной недостаточности у новорожденных, родившихся у женщин, принимающих нимесулид на поздних сроках беременности. Поскольку информация о потенциальном риске не известна, не рекомендуется назначать нимесулид в течение первых двух триместров беременности.
Были отдельные случаи развития почечной недостаточности у новорожденных, родившихся у женщин, принимающих нимесулид на поздних сроках беременности. Поскольку информация о потенциальном риске не известна, не рекомендуется назначать нимесулид в течение первых двух триместров беременности.
Неизвестно, проникает ли нимесулид в грудное молоко при приеме женщиной, кормящей грудью. Прием нимесулида противопоказан в период лактации.
Имеются данные о том, что нимесулид может снижать биодоступность фуросемида, выступать конкурентом по связыванию белков плазмы с фенофибратом, салициловой кислотой, толбутамидом.
Нимесулид может замещать салициловую кислоту и фуросемид (но не варфарин) в плазменных белках.
Нимесулид не оказывает никакого влияния на препараты, воздействующие на концентрацию глюкозы крови и толерантность к глюкозе у больных сахарным диабетом, принимающих различные препараты, содержащие производные сульфонилмочевины.
Не рекомендуется прием нимесулида одновременно с мочегонными, оказывающими повреждающий эффект на почечную гемодинамику.
Физиологические концентрации ненасыщенных жирных кислот не влияют на связывание нимесулида с сывороточным альбумином.
В терапевтических концентрациях на связывание нимесулида не влияли варфарин, фуросемид, глибенкламид, дигитоксин.
В присутствии нимесулида могут значительно возрасти свободные фракции метотрексата.
Прием нимесулида в терапевтических дозах внутрь в течение короткого периода не изменяет сывороточный профиль дигоксина у больных со слабо выраженной сердечной недостаточностью.
Концентрация лития в плазме повышается при одновременном приеме препаратов лития и нимесулида. Нимесулид может усиливать действие циклоспорина на почки.
Нимесулид может усиливать действие циклоспорина на почки.
Использование с глюкокортикостероидами, ингибиторами обратного захвата серотонина увеличивает риск развития желудочно-кишечных кровотечений.
Симптомы: тошнота, рвота, сонливость, апатия, желудочно-кишечное кровотечение, повышение артериального давления, острая почечная недостаточность, угнетение дыхания.
Лечение: рекомендуется симптоматическое и поддерживающее лечение. Специфического антидота нимесулида нет. Больным, поступившим в стацио-нар с симптомами передозировки лекарственным средством (в течение 4 ч после его приема или после приема высокой дозы) рекомендуется промывание желудка, прием активированного угля (взрослым – 60–100 мг) и/или слабительного средства осмотического типа. Необходим регулярный контроль функции печени и почек. Данных о возможности выведения нимесулида с помощью гемодиализа нет. Форсированный диурез, гемодиализ неэффективны из-за высокой связи препарата с белками.
Необходим регулярный контроль функции печени и почек. Данных о возможности выведения нимесулида с помощью гемодиализа нет. Форсированный диурез, гемодиализ неэффективны из-за высокой связи препарата с белками.
Опыт применения нимесулида для купирования болевого синдрома при подагрическом артрите
Резюме. В последние годы неуклонно растет интерес к методам терапии подагры, что в основном связано с повышением распространенности данной патологии. Подагра — системное тофусное заболевание, развивающееся в связи с формированием воспаления в местах отложения кристаллов моноурата натрия у пациентов с гиперурикемией, обусловленной экзогенными или генетическими факторами. Одним из основных проявлений подагры является артрит, считающийся наиболее болезненным. Сегодня для купирования острого подагрического артрита широко применяют различные нестероидные противовоспалительные препараты.
Сегодня для купирования острого подагрического артрита широко применяют различные нестероидные противовоспалительные препараты.
Согласно данным исследований применение нестероидных противовоспалительных препаратов (НПВП) при приступе острого подагрического артрита в более чем 90% случаев приводит к полному купированию болевого синдрома в течение 5–8 дней. При этом, учитывая особенности профиля безопасности и данные об эффективности, применение селективных ингибиторов циклооксигеназы (ЦОГ)-2 может иметь некоторые преимущества по сравнению неселективными НПВП [1].
Следует подчеркнуть, что согласно рекомендациям Европейской антиревматической лиги терапия НПВП является I линией в лечении пациентов с подагрическим артритом. Кроме того, в рекомендациях отмечено, что применение селективных ЦОГ-2-ингибиторов может иметь значительные преимущества по сравнению с неселективными НПВП, особенно у пациентов с подагрой, где метаболические нарушения, поражение почек и желудочно-кишечного тракта широко распространены.
Одним из перспективных препаратов для купирования болевого синдрома при подагре является нимесулид. Применение его при подагре представляется патогенетически обоснованным, поскольку он ингибирует ЦОГ-2 нейтрофилов и макрофагов, которые играют ведущую роль в развитии микрокристаллического воспаления [2]. Кроме того, поскольку нимесулид селективно ингибирует ЦОГ-2, в отличие от неселективных НПВП, его применение обусловливает более низкую гастротоксичность [3].
Подбор НПВП для купирования острого приступа подагрического артрита является важной задачей, осуществление которой должно базироваться на данных об эффективности и профиле безопасности различных представителей данного класса препаратов, а также учитывать индивидуальные особенности течения заболевания и наличие сопутствующей патологии у каждого отдельного пациента. Кроме того, необходимо принимать во внимание различия фармакотерапевтических свойств разных форм выпуска одних и тех же НПВП.
Эффективность применения нимесулида для купирования болевого синдрома у пациентов с подагрой
Эффективность и профиль безопасности нимесулида при подагрическом воспалении на сегодня достаточно хорошо изучены. При этом значительное внимание было уделено изучению соответствующих фармакотерапевтических особенностей различных форм выпуска препарата, в частности таблетированной и гранулированной, а также сравнению эффективности препаратов нимесулида с диклофенаком.
При этом значительное внимание было уделено изучению соответствующих фармакотерапевтических особенностей различных форм выпуска препарата, в частности таблетированной и гранулированной, а также сравнению эффективности препаратов нимесулида с диклофенаком.
Проведено открытое контролируемое исследование, направленное на изучение эффективности и профиля безопасности гранулированной формы нимесулида при остром и хроническом подагрическом артрите, в котором приняли участие 56 пациентов с подагрическим артритом различной степени тяжести [4]. В ходе исследования длительность применения нимесулида определялась на основе изменений клинических проявлений заболевания.
Согласно результатам исследования отмечено быстрое наступления эффекта при применении нимесулида. Так, уже на 5-й день терапии показано уменьшение выраженности воспалительных явлений и болевого синдрома не менее чем в 2 раза. А к 14-му дню у всех пациентов с острым приступом подагрического артрита и, что примечательно, к 21-му дню у всех больных с хроническим артритом отмечено полное купирование болевого синдрома [5].
Сегодня доступны результаты рандомизированного контролируемого исследования, цель которого — сравнить скорость развития противовоспалительного и анальгезивного эффекта различных НПВП при подагре, а также сравнить различные формы выпуска нимесулида. В частности, в ходе исследования изучали показатели эффективности нимесулида и диклофенака натрия у пациентов с подагрическим артритом, а также различные формы выпуска нимесулида — гранулированная (Нимесил) и таблетированная [6]. В исследовании участвовали 90 пациентов с подагрическим артритом, которые были рандомизированы на три равные группы. Пациенты 1-й группы получали гранулированный нимесулид (Нимесил) в саше по 100 мг 2 раза в сутки, 2-й — таблетированный нимесулид также по 100 мг 2 раза в сутки, 3-й — диклофенак — по 75 мг 2 раза в сутки.
Результаты сравнения скорости наступления анальгезирующего эффекта по прошествии первых 3 ч после применения того или иного НПВП свидетельствовали о том, что в целом действие различных форм выпуска нимесулида наступало раньше, чем диклофенака. Кроме того, пациенты, принимавшие гранулированный нимесулид, отметили снижение выраженности болевого синдрома уже на 20-й минуте. На 40-й минуте большинство участников, а через 1 и 3 ч все пациенты, принимавшие гранулированный нимесулид, отмечали снижение выраженности боли. Во 2-й группе примерно 30% пациентов отметили снижение выраженности боли к концу 1-го часа и примерно 65% — через 3 ч. Для пациентов 3-й группы зафиксировано уменьшение выраженности боли только к 3-му часу. При этом достоверное снижение выраженности болевого синдрома по ВАШ к концу 1-го часа отмечено только для пациентов, применявших гранулированную форму нимесулида. Таким образом, в течение первых 3 ч после приема 1-й дозы наиболее значимая положительная динамика отмечалась у пациентов, принимавших гранулированную форму нимесулида (Нимесил).
Кроме того, пациенты, принимавшие гранулированный нимесулид, отметили снижение выраженности болевого синдрома уже на 20-й минуте. На 40-й минуте большинство участников, а через 1 и 3 ч все пациенты, принимавшие гранулированный нимесулид, отмечали снижение выраженности боли. Во 2-й группе примерно 30% пациентов отметили снижение выраженности боли к концу 1-го часа и примерно 65% — через 3 ч. Для пациентов 3-й группы зафиксировано уменьшение выраженности боли только к 3-му часу. При этом достоверное снижение выраженности болевого синдрома по ВАШ к концу 1-го часа отмечено только для пациентов, применявших гранулированную форму нимесулида. Таким образом, в течение первых 3 ч после приема 1-й дозы наиболее значимая положительная динамика отмечалась у пациентов, принимавших гранулированную форму нимесулида (Нимесил).
Но на этом исследование и наблюдение за состоянием здоровья пациентов не были завершены. Последующая оценка динамики болевого синдрома проводилась еще в течение 7 дней, результаты которой также свидетельствовали о значительных различиях в группах пациентов, принимавших различные формы нимесулида и диклофенак. В частности, отличия наблюдались при сравнении выраженности боли по ВАШ, индекса припухлости и суставного индекса. Таким образом, по прошествии 7 дней терапии приступ подагрического артрита был купирован у 24 (80%) пациентов, принимавших гранулированный нимесулид, у 11 (36%) пациентов, принимавших таблетированный нимесулид, и у 4 (13%) — принимавших диклофенак.
В частности, отличия наблюдались при сравнении выраженности боли по ВАШ, индекса припухлости и суставного индекса. Таким образом, по прошествии 7 дней терапии приступ подагрического артрита был купирован у 24 (80%) пациентов, принимавших гранулированный нимесулид, у 11 (36%) пациентов, принимавших таблетированный нимесулид, и у 4 (13%) — принимавших диклофенак.
Таким образом, в данном исследовании продемонстрирована более высокая эффективность применения у пациентов нимесулида по сравнению с диклофенаком натрия; а сравнение гранулированной формы нимесулида с таблетированной показало превосходство первой. Кроме того, следует отметить, что положительная динамика, характерная для гранулированной формы нимесулида, прослеживалась и у пациентов, страдающих от подагрического артрита, поразившего уже несколько суставов, и на фоне отсутствия эффекта других применяемых ранее НПВП. При этом только при применении гранулированной формы нимесулида анальгезирующий эффект отмечался у большинства больных уже в течение 1-го часа.
Особенности профиля безопасности применения нимесулида у больных подагрой
Подагра сопровождается широким спектром метаболических нарушений, среди которых на первом месте находятся артериальная гипертензия, поражение печени и почек различного генеза, сахарный диабет II типа. Более того, большинство больных подагрой — это люди старшей возрастной группы, что обусловливает необходимость учитывать возрастные изменения внутренних органов и полипрагмазию, приводящую к увеличению количества побочных реакций. Таким образом, пациенты с подагрическим артритом представляют собой специфическую группу, для которой характерен высокий риск наличия сопутствующей патологии, а также гепатотоксических реакций, в связи с чем экстраполяция данных о профиле безопасности нимесулида, полученная при других патологических процессах, несколько затруднена. Однако на сегодня наработан убедительный массив данных, позволяющих судить о профиле безопасности применения нимесулида именно у пациентов с подагрическим артритом.
Так, в исследовании был сравнен профиль безопасности различных форм выпуска нимесулида (гранулированной и таблетированной) и диклофенака. Переносимость обоих препаратов в целом была хорошей. У 1 пациента 1-й группы, принимавшей гранулированный нимесулид, отмечено развитие отека лица, 3 пациента 2-й группы, принимавшей таблетированный нимесулид, указали на наличие головной боли и головокружения. Один пациент из 3-й группы, принимавшей диклофенак, указал на боль в эпигастральной области и 4 — на головную боль. Отмены препаратов не потребовалось [6].
Результаты приведенного ниже исследования позволяют оценить функциональное состояние пациентов с подагрой, принимавших нимесулид в течение 2–3 нед [7]. В исследовании профиля безопасности нимесулида приняли участие 52 пациента с подагрой в возрасте 35–79 лет (в среднем — 52,4 года). Средняя продолжительность течения заболевания составила 6,7 года. Среди пациентов были как те, у кого был острый, так и хронический подагрический артрит. Степень выраженности суставного синдрома отличалась (моноартрит, олигоартрит, полиартрит). Нимесил применяли в стандартной дозе по 100 мг в саше 2 раза в сутки в течение 14 дней или 21 дня. Длительность курса лечения зависела от динамики клинических проявлений, но обязательно до полного купирования артрита.
Степень выраженности суставного синдрома отличалась (моноартрит, олигоартрит, полиартрит). Нимесил применяли в стандартной дозе по 100 мг в саше 2 раза в сутки в течение 14 дней или 21 дня. Длительность курса лечения зависела от динамики клинических проявлений, но обязательно до полного купирования артрита.
Риск развития гепатотоксических реакций
Следует отметить, что у примерно 70% пациентов с подагрическим артритом развивается метаболический синдром, что обусловливает нарушение функционирования печени. Также негативно влияют на работу печени погрешности диеты и употребление алкоголя, которые в некоторой степени характерны для больных подагрой. В связи с вышеизложенным не вызывают удивления данные, свидетельствующие о том, что исходный уровень аминотрансфераз, свидетельствующий о повреждении гепатоцитов, у пациентов (аланинаминотрансферазы (АлАТ) — у 25%, аспартатаминотрансферазы (АсАТ) — у 15% больных) с подагрическим артритом был повышен (АлАТ был повышен в 2–2,5 раза по сравнению с нормой). Повышение гамма-глутамилтранспептидазы (γ-ГТП) отмечали у 50% больных. При этом, согласно результатам исследования, применение нимесулида не привело к повышению указанных показателей, свидетельствующих о состоянии гепатоцитов. Исключение составлял лишь 1 больной, у которого отмечен исходно повышенный уровень АлАТ. Необходимо подчеркнуть, что у ряда пациентов выявляли снижение уровней АлАТ, АсАТ и γ-ГТП, что, по мнению авторов исследования, было связано с переходом на диетическое питание и отказом от приема алкоголя [7].
Повышение гамма-глутамилтранспептидазы (γ-ГТП) отмечали у 50% больных. При этом, согласно результатам исследования, применение нимесулида не привело к повышению указанных показателей, свидетельствующих о состоянии гепатоцитов. Исключение составлял лишь 1 больной, у которого отмечен исходно повышенный уровень АлАТ. Необходимо подчеркнуть, что у ряда пациентов выявляли снижение уровней АлАТ, АсАТ и γ-ГТП, что, по мнению авторов исследования, было связано с переходом на диетическое питание и отказом от приема алкоголя [7].
Функции почек
Для большинства пациентов с подагрой характерны нарушения в работе почек, например связанные с гиперурикемией. Развитие нарушений может быть обусловлено собственно образованием подагрических тофусов, возрастом (пациенты с подагрой в основном принадлежат к старшей возрастной группе), сосудистыми факторами риска, в частности гипертриглицеридемией и гипертензией. Влияние применения НПВП является важным фактором, требующим оценки при назначении того или иного препарата. Согласно результатам исследования, в ходе применения гранулированной формы нимесулида у пациентов с подагрическим артритом не выявлено значимых изменений уровня креатинина и мочевины в сыворотке крови и скорости клубочковой фильтрации [7].
Согласно результатам исследования, в ходе применения гранулированной формы нимесулида у пациентов с подагрическим артритом не выявлено значимых изменений уровня креатинина и мочевины в сыворотке крови и скорости клубочковой фильтрации [7].
Сердечно-сосудистая система
Большое внимание медицинской общественности привлекает проблема возможности негативного влияния НПВП на состояние сердечно-сосудистой системы, поэтому актуальными являются исследования, направленные на изучения профиля безопасности нимесулида у пациентов с подагрой, в частности эффекты, затрагивающие сердечно-сосудистую систему. Так, в исследовании проведена оценка влияния нимесулида на артериальное давление [7]. При применении ручного метода измерения артериального давления не отмечено существенных изменений данного показателя. Измерения, проведенные методом суточного мониторирования артериального давления, свидетельствовали о том, что у пациентов без артериальной гипертензии, получающих нимесулид, достоверно улучшился суточный профиль артериального давления. У пациентов с изначально повышенным артериальным давлением после 2 нед применения препарата показатели суточного мониторинга артериального давления не изменились, а некоторые — даже снизились, в частности нормализовался суточный ритм. По мнению исследователей, это могло быть связано со значительным уменьшением выраженности болевого синдрома [7].
У пациентов с изначально повышенным артериальным давлением после 2 нед применения препарата показатели суточного мониторинга артериального давления не изменились, а некоторые — даже снизились, в частности нормализовался суточный ритм. По мнению исследователей, это могло быть связано со значительным уменьшением выраженности болевого синдрома [7].
Удовлетворенность пациентов с подагрой применением нимесулида
Наряду с доказанностью эффективности применения препарата и достаточно изученным профилем безопасности большое значение при выборе НПВП для лечения у пациентов с подагрическим артритом приобретает и уровень приверженности больных лечению, который во многом зависит от их удовлетворенности результатами терапии.
Удовлетворенность пациентов результатами применения гранулированной формы выпуска препарата нимесулид (Нимесил) изучена при участии в ретроспективном исследовании [7]. С этой целью были отобраны медицинские данные 456 пациентов с подагрой, оставивших свои контакты. Таким образом в течение 3 мес были опрошены 55% пациентов. Согласно результатам опроса, примерно каждый 5-й больной в анамнезе применял анальгетики или мази, которые не входят в рекомендуемые препараты для купирования подагрического артрита. Кроме того, 59% пациентов принимали диклофенак в анамнезе, 7% — индометацин. Лишь 20% участников принимали нимесулид различных форм выпуска, из которых гранулированная форма занимала лишь 5%.
Таким образом в течение 3 мес были опрошены 55% пациентов. Согласно результатам опроса, примерно каждый 5-й больной в анамнезе применял анальгетики или мази, которые не входят в рекомендуемые препараты для купирования подагрического артрита. Кроме того, 59% пациентов принимали диклофенак в анамнезе, 7% — индометацин. Лишь 20% участников принимали нимесулид различных форм выпуска, из которых гранулированная форма занимала лишь 5%.
Всем пациентам для купирования болевого синдрома назначали нимесулид, преимущественно гранулированной формы выпуска. Отвечая на вопросы, 18% пациентов отметили, что не нуждались в приеме НПВП. Среди пациентов, принимавших в последствие НПВП, доля больных, принимавших диклофенак, уменьшилась до 9%, количество больных, принимавших нимесулид, суммарно выросло до 73%, при этом доля гранулированной формы составила 64%. В ходе опроса пациентам было предложено сравнить нимесулид с принимаемыми ранее препаратами. Так, 70% больных дали высокую оценку эффективности нимесулида по сравнению с другими препаратами, 10% — не отметили разницы, 2% — отметили низкую эффективность [7].
Выводы
Таким образом, нимесулид (особенно его гранулированная форма) может быть препаратом выбора для купирования болевого синдрома при подагрическом артрите. Исследования показали его эффективность, быстроту наступления эффекта и приемлемый профиль безопасности. Так, нимесулид как при кратковременном, так и при длительном применении характеризуется приемлемым профилем безопасности в контексте развития осложнений со стороны желудочно-кишечного тракта. Необходимо подчеркнуть эффективность и хорошую переносимость нимесулида при наличии сопутствующей патологии различных систем организма, характерной для пациентов с подагрой.
Список использованной литературы
1. Елисеев М.С., Барскова В.Г. (2007) Современные принципы диагностики и лечения подагры. РМЖ, 15: 26.
2. Барскова В.Г. (2008) Нимесулид в лечении подагрического артрита. Consilium Medicum, 10(2).
3. Барскова В.Г., Елисеев М. С., Насонова В.А. (2006) Нимесулид: механизмы действия и применение при подагре. Справоч. поликлин. врача, 8: 11–15.
С., Насонова В.А. (2006) Нимесулид: механизмы действия и применение при подагре. Справоч. поликлин. врача, 8: 11–15.
4. Барскова В.Г., Якунина И.А., Насонова В.А. (2003) Применение нимесила при подагрическом артрите. Тер. арх., 5: 60–64.
5. Барскова В.Г., Насонова В.А., Цапина Т.Н и др. (2004) Эффективность и безопасность применения нимесила при подагрическом артрите. Клин. мед., 82(12): 49–54.
6. Кудаева Ф.М., Елисеев М.С., Барскова В.Г. и др. (2007) Сравнение скорости наступления анальгетического и противовоспалительного эффектов различных форм нимесулида и диклофенака натрия при подагрическом артрите. Тер. архив, 5: 35–40.
7. Барскова В.Г., Гильмутдинова Е.В. (2007) Применение нимесулида при подагрическом артрите: эффективность, безопасность и приверженность больных к лечению. Справ. поликлин. врача, 7: 40–45.
Евгения Лукьянчук
Информация о лекарстве | Портал государственных услуг
Во избежание распространения коронавирусной инфекции Вы можете пройти бесплатное тестирование на коронавирусную инфекцию в поликлинике по месту прикрепления. Для этого необходимо:
Для этого необходимо:
- Используя портал государственных услуг Московской области: https://uslugi.mosreg.ru/zdrav/ зайти в свой личный кабинет (ввести номер полиса обязательного медицинского страхования и дату своего рождения) и записаться на прием к врачу, далее во вкладке «Клиническая лабораторная диагностика» выбрать удобную дату и время проведения теста.
- Если Вы не имеете доступа в Интернет, можно позвонить на Единый номер 8-800-550-50-30 и записаться по телефону.
- Если Вы не прикреплены к поликлинике, но у Вас есть полис обязательного медицинского страхования, оформленный в Московской области, воспользуйтесь нашим сервисом. Найдите на карте ближайший пункт сдачи анализов и запишитесь по телефону.
- Для Вас также доступны сети коммерческих медицинских центров и лабораторий, воспользуйтесь нашим сервисом.
 Найдите на карте ближайший пункт сдачи анализов и запишитесь по телефону.
Найдите на карте ближайший пункт сдачи анализов и запишитесь по телефону.
Тестирование проводится методом Полимеразной цепной реакции (ПЦР). Это высокоточный метод молекулярно-генетической диагностики, который позволяет выявить у человека различные инфекционные и заболевания, как в острой стадии, так и задолго до того, как заболевание может себя проявить.
Для исследования берется мазок из носа и ротоглотки.
Необходима простая подготовка для исследования:
- За два часа до теста рекомендуется не есть, не пить и воздержаться от курения.
- За 30 минут нельзя жевать жвачку и сосать конфеты, полоскать горло, пользоваться спреем или каплями для носа.
Для Вас доступны сети сертифицированных государственных и коммерческих медицинских организаций и лабораторий в которых Вы можете пройти тестирование на платной основе, воспользуйтесь нашим сервисом. Найдите на карте ближайший пункт и запишитесь по телефону.
Найдите на карте ближайший пункт и запишитесь по телефону.
Запись к врачам:
- возобновлена запись на прием к врачам терапевтам, педиатрам, хирургам, онкологам, акушерам-гинекологам, стоматологам, психиатрам-наркологам, психиатрам, фтизиатрам, дерматовенерологам;
- запись к узким специалистам: кардиолог, эндокринолог, невролог — по направлению от врача терапевта, педиатра и врача общей практики;
- возможна самостоятельная запись к узкому специалисту, если Вы состоите у него на диспансерном учете.
Временно приостановлены:
- предварительные, периодические профилактические медицинские осмотры;
- вакцинопрофилактика;
- плановая диспансеризация;
- госпитализация в стационары дневного пребывания.

ЕСЛИ у Вас поднялась температура, появились кашель и насморк, необходимо остаться дома и вызвать врача одним из следующих способов:
- Позвонить по номеру 8-800-550-50-30;
- Оформить вызов на портале госуслуг;
- Обратиться в скорую помощь по номеру 112.
инструкция по применению, классификация, статьи » Справочник ЛС
Классификация ВОЗ частоты развития побочных эффектов:
Очень часто ( ≥ 1/10), часто ( ≥ 1/100, < 1/10), нечасто ( ≥ 1/1000, < 1/100), редко ( ≥ 1/10000, < 1/1000), очень редко ( < 1/10000), включая отдельные сообщения.
Нарушения со стороны крови и лимфатической системы
Редко: анемия, эозинофилия, геморрагии;
Очень редко: тромбоцитопения, агранулоцитоз, панцитопения, пурпура тромбоцитопеническая, удлинение времени кровотечения.
Нарушения со стороны иммунной системы
Редко: реакции гиперчувствительности;
Очень редко: анафилактоидные реакции.
Нарушения со стороны кожи и подкожных тканей
Нечасто: кожный зуд, кожная сыпь, усиление потоотделения;
Редко: эритема, дерматит;
Очень редко: крапивница, ангионевротический отек, отек лица, многоформная экссудативная эритема, синдром Стивенса-Джонсона, токсический эпидермальный некролиз (синдром Лайелла).
Нарушения со стороны нервной системы
Нечасто: головокружение;
Очень редко: головная боль, сонливость, энцефалопатия (синдром Рейе).
Нарушения психики
Редко: ощущение страха, нервозность, ночные «кошмарные» сновидения.
Нарушения со стороны органов чувств
Редко: нечеткость зрения.
Нарушения со стороны сердечно-сосудистой системы
Нечасто: повышение артериального давления;
Редко: тахикардия, лабильность артериального давления, «приливы», ощущение сердцебиения.
Нарушения со стороны дыхательной системы:
Нечасто: одышка;
Очень редко: обострение бронхиальной астмы, бронхоспазм.
Нарушения со стороны желудочно-кишечного тракта
Часто: диарея, тошнота, рвота;
Нечасто: запор, метеоризм, гастрит;
Очень редко: боль в животе, диспепсия, стоматит, дегтеобразный стул, желудочно-кишечное кровотечение, язва и/или перфорация желудка или двенадцатиперстной кишки.
Нарушения со стороны печени и желчевыводящих путей
Часто: повышение активности «печеночных» ферментов;
Очень редко: гепатит, молниеносный гепатит, желтуха, холестаз.
Нарушения со стороны почек и мочевыводящих путей
Редко: дизурия, гематурия, задержка мочеиспускания;
Очень редко: почечная недостаточность, олигурия, интерстициальный нефрит.
Нарушения со стороны водно-электролитного обмена
Редко: гиперкалиемия.
Прочие
Нечасто: периферические отеки;
Редко: недомогание, астения;
Очень редко: гипотермия.
НАЙЗ 100МГ. №20 ТАБ.
Инструкция по применению
Форма выпуска и состав:
| Таблетки диспергируемые | 1 таб. |
| нимесулид | 50 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая, кальция фосфат, крахмал кукурузный, карбоксиметилкрахмал натрия, магния стеарат, тальк, кремния диоксид коллоидный, аспартам, ароматизатор ананасовый.
10 шт. — блистеры (1) — пачки картонные.
10 шт. — блистеры (2) — пачки картонные.
10 шт. — блистеры (10) — пачки картонные.
Таблетки почти белого цвета с желтоватым оттенком, круглые, двояковыпуклые, с гладкой поверхностью.
| 1 таб. | |
| нимесулид | 100 мг |
Вспомогательные вещества: целлюлоза микрокристаллическая, крахмал кукурузный, кальция гидроген фосфат, натрия крахмала гликолат, тальк очищенный, магния стеарат, кремний коллоидный безводный.
10 шт. — блистеры (1) — коробки картонные.
10 шт. — блистеры (2) — коробки картонные.
10 шт. — блистеры (10) — коробки картонные.
— блистеры (10) — коробки картонные.
Суспензия для приема внутрь желтого цвета, с приятным запахом и характерным вкусом, редиспергируется при встряхивании.
| 5 мл | |
| нимесулид | 50 мг |
Вспомогательные вещества: сахароза, сорбитол, метилпарабен, пропилпарабен, ксантана камедь, лимонная кислота, краситель хинолиновый желтый WS, ананасовый ароматизатор, полисорбат 80, глицерол, вода очищенная.
60 мл — флаконы темного стекла (1) в комплекте с дозировочным колпачком — пачки картонные.
Фармакологическое действие:
НПВС. Селективный ингибитор ЦОГ-2 — фермента, участвующего в синтезе простагландинов — медиаторов отека, воспаления и боли. Препарат оказывает противовоспалительное, анальгезирующее и жаропонижающее действие.
Обратимо ингибирует образование простагландина Е2, как в очаге воспаления, так и в восходящих путях ноцицептивной системы, включая пути проведения болевых импульсов в спинном мозге.
Снижает концентрацию короткоживущего простагландина Н2, из которого под действием простагландин-изомеразы образуется простагландин Е2. Уменьшение концентрации простагландина Е2 ведет к снижению степени активации простаноидных рецепторов ЕР-типа, что выражается в анальгезирующих и противовоспалительных эффектах.
В незначительной степени действует на ЦОГ-1, практически не препятствует образованию простагландина Е2 из арахидоновой кислоты в физиологических условиях, благодаря чему снижается количество побочных эффектов препарата.
Препарат подавляет агрегацию тромбоцитов путем ингибирования синтеза эндопероксидов и тромбоксана А2, ингибирует синтез фактора агрегации тромбоцитов. Подавляет высвобождение гистамина, а также уменьшает степень бронхоспазма, вызванного воздействием гистамина и ацетальдегида.
Препарат также ингибирует высвобождение фактора некроза опухолей альфа, обусловливающего образование цитокинов.
Показано, что нимесулид способен подавлять синтез интерлейкина-6 и урокиназы, тем самым препятствуя разрушению хрящевой ткани. Ингибирует синтез металлопротеаз (эластазы, коллагеназы), предотвращая разрушение протеогликанов и коллагена хрящевой ткани.
Обладает антиоксидантными свойствами, тормозит образование токсических продуктов распада кислорода за счет уменьшения активности миелопероксидазы. Взаимодействует с глюкокортикоидными рецепторами, активируя их путем фосфориляции, что также усиливает противовоспалительное действие препарата.
При местном применении вызывает ослабление или исчезновение болей в месте нанесения геля, в т.ч. болей в суставах в покое и при движении, уменьшает утреннюю скованность и припухлость суставов. Способствует увеличению объема движений.
Фармакокинетика:
Всасывание
После приема внутрь нимесулид хорошо абсорбируется из ЖКТ. Прием пищи снижает скорость абсорбции, не влияя на ее степень. Cmax нимесулида в плазме крови достигается через 1. 5-2.5 ч после приема и составляет 3.5-6.5 мг/л. Подвергается эффекту первого прохождения через печень.
5-2.5 ч после приема и составляет 3.5-6.5 мг/л. Подвергается эффекту первого прохождения через печень.
Распределение
Связывание с белками плазмы составляет 95%, с эритроцитами — 2%, с липопротеинами — 1%, с кислыми apha1-гликопротеидами — 1%. Доза препарата не влияет на степень связывания с белками крови.
Vd составляет 0.19-0.35 л/кг. Проникает в ткани женских половых органов, где после однократного приема концентрация нимесулида составляет около 40% от концентрации в плазме. Хорошо проникает в кислую среду очага воспаления (40%), синовиальную жидкость (43%). Легко проникает через гисто-гематические барьеры.
Метаболизм
Нимесулид активно метаболизируется в печени тканевыми монооксигеназами. Основной метаболит — 4-гидроксинимесулид (25%) обладает сходной фармакологической активностью.
Выведение
T1/2 — 1.56-4.95 ч, T1/2 4-гидроксинимесулида — 2.89-4.78 ч. Метаболит выводится почками (65%) и с желчью (35%).
Фармакокинетика в особых клинических случаях
У больных с почечной недостаточностью (КК от 80 до 30 мл/мин), а также у детей и лиц пожилого возраста фармакокинетический профиль нимесулида существенно не меняется.
Показания:
— ревматоидный артрит
— суставной синдром при ревматизме и обострении подагры
— псориатический артрит
— анкилозирующий спондилоартрит
— остеохондроз с корешковым синдромом
— радикулит
— ишиас
— люмбаго
— остеоартроз
— артриты различной этиологии
— артралгия
— миалгия ревматического и неревматического генеза
— воспаление связок, сухожилий, бурситы
— постравматическое воспаление мягких тканей и опорно-двигательного аппарата (повреждения и разрывы связок, ушибы)
— болевой синдром различного генеза (в т.ч. в послеоперационном периоде, при травмах, альгодисменорея, зубная боль, головная боль)
— лихорадка различного генеза (в т.ч. при инфекционно-воспалительных заболеваниях).
Режим дозирования:
Внутрь взрослым назначают по 100 мг 2 раза/сут. Максимальная суточная доза — 400 мг.
Препарат в форме суспензии предпочтительнее принимать до еды, но при ощущении дискомфорта в области желудка возможен прием в конце или после приема пищи.
Препарат в форме диспергируемых таблеток следует принимать в конце или после приема пищи. Перед приемом 1 таблетку растворяют в 5 мл (1 чайная ложка) воды.
Детям в возрасте старше 2 лет препарат назначают в форме суспензии, детям в возрасте старше 3 лет — в форме диспергируемых таблеток или суспензии, детям в возрасте старше 12 лет препарат можно назначать в форме таблеток (100 мг 2 раза/сут). Рекомендуемая доза — 3-5 мг/кг массы тела 2-3 раза/сут. Максимальная доза — 5 мг/кг/сут в 2-3 приема. Подросткам с массой тела более 40 кг препарат назначают по 100 мг 2 раза/сут.
Максимальная доза — 5 мг/кг массы тела/сут. Продолжительность применения препарата — 10 дней.
Продолжительность применения препарата — 10 дней.
Побочные действия:
Со стороны пищеварительной системы: изжога, тошнота, рвота, боли в области желудка, диарея, эрозивно-язвенные поражения ЖКТ, повышение активности печеночных трансаминаз, токсический гепатит.
Со стороны ЦНС: головная боль, головокружение.
Со стороны системы кроветворения: тромбоцитопения, лейкопения, анемия, агранулоцитоз.
Аллергические реакции: кожная сыпь, анафилактический шок, бронхоспазм.
Прочие: задержка жидкости, удлинение времени кровотечения, гематурия.
Местные реакции: при нанесении геля — зуд, крапивница, шелушение, преходящее изменение цвета кожи (не требует отмены препарата).
При нанесении геля на обширные участки кожи возможно развитие системных побочных реакций.
Противопоказания:
— эрозивно-язвенные поражения ЖКТ в фазе обострения
— кровотечения из ЖКТ
— аспириновая триада
— нарушения функции печени
— выраженная почечная недостаточность (ККt30 мл/мин)
— беременность
— лактация (грудное вскармливание)
— дерматозы, повреждения эпидермиса, инфекции кожи в области применения (для геля)
— детский возраст до 2 лет
— повышенная чувствительность к нимесулиду и другим компонентам препарата, ацетилсалициловой кислоте и другим НПВС.
С осторожностью следует назначать препарат при артериальной гипертензии, сердечной недостаточности, сахарном диабете типа 2 (инсулиннезависимом).
Беременность и лактация:
Найз противопоказан к применению при беременности.
При необходимости применения препарата в период лактации следует решить вопрос о прекращении грудного вскармливания.
Особые указания:
С осторожностью следует назначать Найз пациентам с нарушениями функции почек, нарушениями зрения.
При длительном применении необходимо контролировать функции печени и почек.
При применении препарата у пациентов пожилого возраста коррекции режима дозирования не требуется.
Влияние на способность к вождению автотранспорта и управлению механизмами
В связи с тем, что Найз при приеме внутрь может вызывать головокружение и сонливость, препарат следует с осторожностью назначать пациентам, занимающимся потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстрых психомоторных реакций.
Передозировка:
В настоящее время о случаях передозировки препарата Найз не сообщалось.
При случайной передозировке возможно развитие следующих симптомов: повышение АД, нарушение функции почек, судороги, раздражение ЖКТ, угнетение дыхания, печеночная недостаточность.
Лечение: промывание желудка, назначение активированного угля, проведение симптоматической терапии. Специфического антидота не существует. Форсированный диурез, гемодиализ малоэффективны.
Лекарственное взаимодействие:
Возможны проявления лекарственного взаимодействия (из-за конкурирования препаратов за связывание с белками) при одновременном приеме внутрь препарата Найз с дигоксином, фенитоином, препаратами лития, диуретиками, антигипертензивными препаратами, другими НПВС, антикоагулянтами, циклоспорином, метотрексатом, пероральными гипогликемическими средствами.
Условия и сроки хранения:
Список Б. Препарат в форме таблеток диспергируемых, суспензии следует хранить в сухом, защищенном от света месте при температуре не выше 25°C. Срок годности — 3 года.
Срок годности — 3 года.
Нимесулид — LiverTox — NCBI Bookshelf
ОБЗОР
Введение
Нимесулид — нестероидный противовоспалительный препарат (НПВП) с относительной специфичностью к ЦОГ-2, который недоступен в США, но широко используется в других странах для лечения острой боли. Нимесулид был связан с низкой скоростью кратковременного повышения уровня ферментов сыворотки во время терапии, но также и со многими случаями клинически очевидного острого повреждения печени, которое может быть тяжелым и может привести к острой печеночной недостаточности, необходимости экстренной трансплантации печени и смерти.
Общие сведения
Нимесулид (нимессулид) — уникальный НПВП, имеющий основную сульфонанилидную структуру. Как и другие НПВП, нимесулид подавляет фермент циклооксигеназу (ЦОГ), тем самым блокируя образование простагландинов, которые играют важную роль в болевых и воспалительных путях. Однако, в отличие от большинства обычных НПВП, нимесулид обладает относительной специфичностью в отношении активности ЦОГ-2, формы, которая наиболее тесно связана с болевыми путями, в отличие от ЦОГ-1, который оказывает большое влияние на защиту клеток слизистой оболочки желудка и функцию тромбоцитов. Нимесулид обладает обезболивающим, жаропонижающим и противовоспалительным действием, опосредованным действием ЦОГ-2, но имеет относительно слабое влияние на функцию тромбоцитов или потерю цитопротекции желудка, которая связана с активностью ЦОГ-1. Нимесулид имеет быстрое начало действия и обладает другими активностями, помимо эффектов циклооксигеназ, которые могут иметь важное значение для его противовоспалительного и обезболивающего действия. Нимесулид никогда не продавался в Соединенных Штатах, но широко использовался во многих странах мира с момента его появления в 1990-х годах.Текущие показания варьируются в зависимости от страны, но обычно ограничиваются острой болью от легкой до умеренной, для которой рекомендуемая доза для взрослых составляет 100 мг два раза в день в течение не более 15 дней. Хроническая терапия обычно не рекомендуется, а нимесулид считается противопоказанием детям. Нимесулид отпускается по рецепту в форме капсул или гранул для пероральной суспензии 100 мг и суппозиториев по 200 мг как в дженериках, так и в торговых формах (Сулид, Нимсайд и другие).
Нимесулид обладает обезболивающим, жаропонижающим и противовоспалительным действием, опосредованным действием ЦОГ-2, но имеет относительно слабое влияние на функцию тромбоцитов или потерю цитопротекции желудка, которая связана с активностью ЦОГ-1. Нимесулид имеет быстрое начало действия и обладает другими активностями, помимо эффектов циклооксигеназ, которые могут иметь важное значение для его противовоспалительного и обезболивающего действия. Нимесулид никогда не продавался в Соединенных Штатах, но широко использовался во многих странах мира с момента его появления в 1990-х годах.Текущие показания варьируются в зависимости от страны, но обычно ограничиваются острой болью от легкой до умеренной, для которой рекомендуемая доза для взрослых составляет 100 мг два раза в день в течение не более 15 дней. Хроническая терапия обычно не рекомендуется, а нимесулид считается противопоказанием детям. Нимесулид отпускается по рецепту в форме капсул или гранул для пероральной суспензии 100 мг и суппозиториев по 200 мг как в дженериках, так и в торговых формах (Сулид, Нимсайд и другие). Нимесулид обычно хорошо переносится, но побочные эффекты могут включать головную боль, головокружение, сонливость, желудочно-кишечные расстройства, тошноту, дискомфорт в животе, диарею, периферические отеки и реакции гиперчувствительности.
Нимесулид обычно хорошо переносится, но побочные эффекты могут включать головную боль, головокружение, сонливость, желудочно-кишечные расстройства, тошноту, дискомфорт в животе, диарею, периферические отеки и реакции гиперчувствительности.
Гепатотоксичность
Проспективные исследования показывают, что до 15% пациентов, принимающих НПВП, испытывают по крайней мере временное повышение уровня аминотрансферазы в сыворотке крови. Сообщалось о более низких показателях приема нимесулида. Это повышение обычно преходящее, легкое и бессимптомное, и может исчезнуть даже при продолжении приема препарата. Заметное повышение аминотрансферазы (более чем в 3 раза) встречается у <1% пациентов. Тем не менее, применение нимесулида неоднократно связывали со случаями клинически выраженного поражения печени с желтухой, причем в мировой литературе описано более 100 случаев.Время до начала заболевания колеблется от нескольких дней до 6 месяцев, обычно латентный период составляет 4 недели. Паттерн повышения уровня ферментов обычно гепатоцеллюлярный, хотя описаны и холестатические формы. Иммуноаллергические признаки обычно отсутствуют, а если они есть, то не выражены. Аутоиммунные особенности встречаются редко. Большинство случаев разрешаются через несколько дней после прекращения терапии. Однако описаны многочисленные случаи острой печеночной недостаточности со смертью или необходимостью экстренной трансплантации печени (Случай 1).Смертность от острого гепатита с желтухой, связанного с нимесулидом, составляет от 10% до 20%. Общая частота гепатотоксичности нимесулида неизвестна, но обычно упоминается в больших сериях случаев лекарственного поражения печени и острой печеночной недостаточности, и разумная оценка — один случай на 50 000 пользователей. Повреждение печени может быть менее распространенным, если продолжительность терапии ограничена 15 днями; Однако сообщалось о тяжелых случаях поражения печени нимесулидом после курсов лечения продолжительностью от 3 до 5 дней.
Иммуноаллергические признаки обычно отсутствуют, а если они есть, то не выражены. Аутоиммунные особенности встречаются редко. Большинство случаев разрешаются через несколько дней после прекращения терапии. Однако описаны многочисленные случаи острой печеночной недостаточности со смертью или необходимостью экстренной трансплантации печени (Случай 1).Смертность от острого гепатита с желтухой, связанного с нимесулидом, составляет от 10% до 20%. Общая частота гепатотоксичности нимесулида неизвестна, но обычно упоминается в больших сериях случаев лекарственного поражения печени и острой печеночной недостаточности, и разумная оценка — один случай на 50 000 пользователей. Повреждение печени может быть менее распространенным, если продолжительность терапии ограничена 15 днями; Однако сообщалось о тяжелых случаях поражения печени нимесулидом после курсов лечения продолжительностью от 3 до 5 дней.
Оценка вероятности: A (точно установленная причина клинически очевидного поражения печени).
Механизм травмы
Механизм гепатотоксичности нимесулида неизвестен, но, вероятно, это связано с идиосинкразической реакцией на промежуточное соединение его метаболизма. Нимесулид активно метаболизируется в печени.
Исход и лечение
Степень тяжести варьируется от бессимптомного повышения уровней сывороточных аминотрансфераз до симптоматического гепатита с желтухой или без нее.Сообщалось о нескольких случаях фульминантного гепатита, связанного с нимесулидом, а общий уровень смертности среди больных желтухой составляет от 10% до 20%. Сообщалось о рецидивах после повторного введения нимесулида, и их следует избегать. Нет доказательств перекрестной чувствительности к поражению печени между нимесулидом и другими традиционными НПВП, такими как ибупрофен, напроксен или диклофенак. Из-за сульфонанилидной структуры нимесулида следует с осторожностью применять сульфонамиды или другие препараты с сульфонамидной структурой (целекоксиб, зонисамид) после клинически очевидного поражения печени от нимесулида.
Класс лекарств: нестероидные противовоспалительные препараты
СЛУЧАЙ ИЗЛУЧЕНИЯ
Случай 1. Острая печеночная недостаточность, связанная с применением нимесулида.
[Изменено из: McCormick PA, Kennedy F, Curry M, et al. Ланцет 1999; ингибирование ЦОГ-2 и фульминантная печеночная недостаточность; 353 (9146): 40-1. PubMed Citation.]
58-летняя женщина почувствовала недомогание примерно через 10 дней после начала приема нимесулида по поводу хронической боли в спине. У нее было обнаружено небольшое повышение уровня ферментов сыворотки (таблица).Нимесулид был продолжен, но у нее появились дополнительные симптомы, включая тошноту, и прием был прекращен. Две недели спустя она отметила темную мочу и желтуху, и вскоре после этого она была госпитализирована из-за ухудшения симптомов. В анамнезе не было заболеваний печени, злоупотребления алкоголем или факторов риска вирусного гепатита. В прошлом она принимала нимесулид в течение коротких периодов времени. Другие ее лекарства включали противозачаточные таблетки, которые она принимала в течение 6 лет, и сертралин, который она принимала в течение 11 месяцев.При поступлении она сильно заболела желтухой и спутанностью сознания. Лабораторные результаты показали общий билирубин 16,9 мг / дл, АЛТ 1046 Ед / л, AST 386 Ед / л, щелочную фосфатазу 114 Ед / л, GGT 112 Ед / л, альбумин 2,8 г / дл и МНО больше 12. Тесты на гепатиты A, B, C, EBV и CMV были отрицательными. У нее были низкие титры АНА (1:25). УЗИ брюшной полости показало нормальную печень, селезенку, желчевыводящие пути и небольшой асцит. Состояние ее быстро ухудшилось, и ей потребовалась вспомогательная вентиляция легких. У нее развилась прогрессирующая печеночная недостаточность, и в течение 3 дней после госпитализации она перенесла экстренную трансплантацию печени, но у нее была первичная нефункция трансплантата, полиорганная недостаточность, и она умерла в течение дня после операции.На вскрытии обнаружен массивный некроз печени.
Другие ее лекарства включали противозачаточные таблетки, которые она принимала в течение 6 лет, и сертралин, который она принимала в течение 11 месяцев.При поступлении она сильно заболела желтухой и спутанностью сознания. Лабораторные результаты показали общий билирубин 16,9 мг / дл, АЛТ 1046 Ед / л, AST 386 Ед / л, щелочную фосфатазу 114 Ед / л, GGT 112 Ед / л, альбумин 2,8 г / дл и МНО больше 12. Тесты на гепатиты A, B, C, EBV и CMV были отрицательными. У нее были низкие титры АНА (1:25). УЗИ брюшной полости показало нормальную печень, селезенку, желчевыводящие пути и небольшой асцит. Состояние ее быстро ухудшилось, и ей потребовалась вспомогательная вентиляция легких. У нее развилась прогрессирующая печеночная недостаточность, и в течение 3 дней после госпитализации она перенесла экстренную трансплантацию печени, но у нее была первичная нефункция трансплантата, полиорганная недостаточность, и она умерла в течение дня после операции.На вскрытии обнаружен массивный некроз печени.
Ключевые моменты
Вид в собственном окне
| Лекарство: | Нимесулид (100 мг два раза в день) |
| Образец: | Гепатоцеллюлярный (R = ~ 62) |
| Степень серьезности: | 5 + (желтуха, печеночная недостаточность, трансплантация печени, смерть) |
| Латентный период: | 10 дней до появления симптомов, 50 дней до желтухи |
| Восстановление: | Нет |
| Другие лекарства: | Оральные контрацептивы, сертралин |
Лабораторные значения
Просмотр в собственном окне
| Время после запуска | Время после остановки | ALT (U / L) | Alk P (U / L) | Билирубин (мг / dL) | Другое |
|---|---|---|---|---|---|
| T2_1_1_1_1″ rowspan=»1″ colspan=»1″> Pre | 0 | 23 | 51 | Обычный | |
| 10 дней 900 44 | 0 | 187 | 50 | Неспецифические симптомы | |
| 32 дня | T2_1_1_1_2″ rowspan=»1″ colspan=»1″> 0 | 504 | 54 | 0.9 | Тошнота |
| 50 дней | 2 недели | 2857 | 114 | 7,0 | Поступление, спутанность сознания |
| 53 дня | T2_1_1_1_3 hd_h_Nimesulide.T2_1_1_1_4 hd_h_Nimesulide.T2_1_1_1_5 hd_h_Nimesulide.T2_1_1_1_6″ colspan=»4″ rowspan=»1″> Трансплантация печени, первичное нарушение функции, смерть | ||||
| <40 | <100 | <1,2 |
Исследование высвобождения нимесулида из твердых фармацевтических составов в растворах Tween 80
Curr Health Sci J.Январь-март 2010 г .; 36 (1): 42–49.
Опубликовано в Интернете 24 марта 2010 г.
Стефана-Оана Пуркару
1 Фармацевтический факультет Крайовского университета медицины и фармации
Михаэла Ионеску
2 Армейский центр медицинских исследований, Бухарест
Ране 9000ti4
2 Армейский центр медицинских исследований, Бухарест
Валентина Анюта
3 Biopharmacy & Pharmacol Res SA, Бухарест
I.
 Mircioiu
Mircioiu
4 Фармацевтический факультет, Университет медицины и фармации им. Кэрол Давила, Бухарест
Ионела Белу
1 Фармацевтический факультет Медицинского и фармацевтического университета Крайова
1 Фармацевтический факультет Университета медицины и фармации Крайовы
2 Армейский центр медицинских исследований, Бухарест
3 Biopharmacy & Pharmacol Res SA, Бухарест
4 Фармацевтический факультет, Университет медицины и фармации «Кэрол Давила», Бухарест
Автор для корреспонденции: профессор Константин Мирчиу, фармацевт, доктор философии
Кафедра биофармацевтики Фармацевтический факультет, Университет медицины и фармации «Кэрол Давила», ул. Траян Вуя, 6, 020956 Бухарест, Румыния, Телефон: +40 21 318 07 50, [email protected]
Поступила в феврале 2009 г. 8; Принято 20 февраля 2010 г.
Авторские права © 2010, Издательство Медицинского университета Craiova Эта статья цитируется в других статьях в PMC.
Abstract
Нимесулид — слабокислый нестероидный противовоспалительный препарат (НПВП). Как и многие нестероидные противовоспалительные препараты, нимесулид очень плохо растворим в воде (≈ 0,01 мг / мл). Плохая растворимость и смачиваемость нимесулида в воде вызывает трудности с фармацевтическими препаратами для пероральной или парентеральной доставки, что может привести к переменная биодоступность. В соответствии с Системой биофармацевтической классификации (BCS) нимесулид считается лекарственным средством BCS 2 (плохо растворимым и высокопроницаемым).Солюбилизация в растворах поверхностно-активных веществ выше критической концентрации мицелл (ККМ) предлагает один подход к составлению труднорастворимых лекарств. Слабокислые и основные лекарственные средства могут быть переведены в раствор за счет солюбилизирующего действия поверхностно-активных веществ. В этом исследовании для увеличения растворимости нимесулида использовались различные концентрации Твина 80 в сочетании с буфером (pH 7,4). Результаты показывают, что зависимость высвобожденного количества от концентрации Твина не является линейной, очень низкая концентрация Твина показывает снижение «растворимости», вероятно, связанное с критической концентрацией мицелл на границе раздела раствора нимесулида.«Аналитический» артефакт, связанный со снижением поглощения нимесулида ультрафиолетом из-за осаждения нимесулида, возможно образование коллоидного раствора, и это явление еще предстоит исследовать. Трудно объяснить, что для почти полной солюбилизации необходимо значительное количество твина, которое должно быть больше, чем у других малорастворимых лекарств.
Результаты показывают, что зависимость высвобожденного количества от концентрации Твина не является линейной, очень низкая концентрация Твина показывает снижение «растворимости», вероятно, связанное с критической концентрацией мицелл на границе раздела раствора нимесулида.«Аналитический» артефакт, связанный со снижением поглощения нимесулида ультрафиолетом из-за осаждения нимесулида, возможно образование коллоидного раствора, и это явление еще предстоит исследовать. Трудно объяснить, что для почти полной солюбилизации необходимо значительное количество твина, которое должно быть больше, чем у других малорастворимых лекарств.
Ключевые слова: Нимесулид, солюбилизация, Твин 80, критическая концентрация мицелл (CMC)
Введение
Пероральная лекарственная форма представляет собой наиболее распространенный путь введения лекарственного средства в организм человека, поскольку он приводит к лучшему соблюдению пациентом режима очень универсален для условий дозирования [1,2]. Однако, к сожалению, эта стратегия терпит неудачу при работе с лекарствами с низкой биодоступностью, такими как препараты, принадлежащие к широко используемому классу противовоспалительных средств [3]. Хотя биодоступность, определяемая как скорость и степень, в которой активное лекарственное средство абсорбируется из фармацевтической формы и становится доступным в месте действия лекарственного средства [4], зависит от нескольких факторов, обычно от растворимости лекарственного средства в водной среде и от лекарственного средства. проницаемость через липофильные мембраны играет роль ключевых параметров [2].Фактически, только солюбилизированные молекулы могут абсорбироваться клеточными мембранами, чтобы впоследствии достичь места действия лекарства (например, сосудистой системы).
Однако, к сожалению, эта стратегия терпит неудачу при работе с лекарствами с низкой биодоступностью, такими как препараты, принадлежащие к широко используемому классу противовоспалительных средств [3]. Хотя биодоступность, определяемая как скорость и степень, в которой активное лекарственное средство абсорбируется из фармацевтической формы и становится доступным в месте действия лекарственного средства [4], зависит от нескольких факторов, обычно от растворимости лекарственного средства в водной среде и от лекарственного средства. проницаемость через липофильные мембраны играет роль ключевых параметров [2].Фактически, только солюбилизированные молекулы могут абсорбироваться клеточными мембранами, чтобы впоследствии достичь места действия лекарства (например, сосудистой системы).
В соответствии с высокими или низкими значениями, принимаемыми этими параметрами, лекарства можно разделить на четыре различных класса [5], и лекарство может быть определено как биодоступное, если оно принадлежит к первому классу (высокая растворимость и проницаемость). Для улучшения биодоступности плохо растворимых в воде, но проницаемых лекарственных средств обычно используется множество различных методов (второй класс [5]).
Для улучшения биодоступности плохо растворимых в воде, но проницаемых лекарственных средств обычно используется множество различных методов (второй класс [5]).
Биодоступность лекарства при пероральном приеме также сильно зависит от кишечной проницаемости. Таким образом, исследования проницаемости лекарств являются результатом первостепенной важности для разработки этих стратегий, направленных на улучшение абсорбции лекарств, и возникает необходимость понимания основных механизмов, управляющих переносом лекарств через эпителий кишечника [6]. Было продемонстрировано [7], что проникновение лекарственного средства через слизистую оболочку кишечника in vivo в основном происходит в соответствии с пассивным диффузионным механизмом, этап определения скорости которого представлен пересечением клеточной мембраны, в то время как небольшой эффект будет оказывать застойный водный слой, возникающий при стенка кишечника [7].Хотя обычно утверждается, что липофильные препараты проходят трансцеллюлярный путь при пересечении их кишечной мембраны, в то время как гидрофильные лекарственные средства проходят парацеллюлярный путь (они будут диффундировать через воду, заполняющую межклеточные пустоты), сегодня считается, что трансцеллюлярный путь является наиболее эффективным. основной транспортный механизм, как у крыс, так и у человека, независимо от физико-химических свойств препарата [8] [9].
основной транспортный механизм, как у крыс, так и у человека, независимо от физико-химических свойств препарата [8] [9].
Нимесулид, химически 4’-нитро-2’-феноксиметансульфонанилид, является слабокислым (pKa 6.5) нестероидный противовоспалительный препарат (НПВП). Он отличается от других нестероидных противовоспалительных препаратов тем, что его химическая структура содержит сульфонанилидный фрагмент в качестве кислотной группы, а не карбоксильной группы (рис.).
Нимесулид проявляет высокую противовоспалительную, жаропонижающую и анальгезирующую активность в дополнение к низкой токсичности, умеренной частоте желудочных побочных эффектов и высокому терапевтическому индексу [10]. Нимесулид является относительно слабым ингибитором синтеза простагландинов in vivo и, по-видимому, проявляет свой эффект посредством различных механизмов, включая улавливание свободных радикалов, влияние на высвобождение гистамина, путь нейтрофильной миелопероксидазы, активность брадикинина, высвобождение фактора некроза опухоли-a, деградацию хряща и т. Д. синтез металлопротеазы, ингибирование фосфодиэстеразы типа IV, агрегация тромбоцитов и синтез фактора активации тромбоцитов.Он также демонстрирует значительную селективность в отношении циклооксигеназы-2 (ЦОГ-2) по сравнению с ингибированием ЦОГ-1, что может объяснить меньшую частоту желудочных побочных эффектов. Однако недавние результаты показали, что нимесулид имеет более высокий риск гепатотоксичности по сравнению с другими имеющимися на рынке НПВП [11,12]. Как и многие нестероидные противовоспалительные препараты, нимесулид очень плохо растворим в воде (≈ 0,01 мг / мл) [13]. Плохая растворимость в воде и смачиваемость нимесулида вызывает трудности в фармацевтических препаратах для пероральной или парентеральной доставки, что может привести к изменчивой биодоступности [14].
Д. синтез металлопротеазы, ингибирование фосфодиэстеразы типа IV, агрегация тромбоцитов и синтез фактора активации тромбоцитов.Он также демонстрирует значительную селективность в отношении циклооксигеназы-2 (ЦОГ-2) по сравнению с ингибированием ЦОГ-1, что может объяснить меньшую частоту желудочных побочных эффектов. Однако недавние результаты показали, что нимесулид имеет более высокий риск гепатотоксичности по сравнению с другими имеющимися на рынке НПВП [11,12]. Как и многие нестероидные противовоспалительные препараты, нимесулид очень плохо растворим в воде (≈ 0,01 мг / мл) [13]. Плохая растворимость в воде и смачиваемость нимесулида вызывает трудности в фармацевтических препаратах для пероральной или парентеральной доставки, что может привести к изменчивой биодоступности [14].
На основании системы биофармацевтической классификации (BCS) нимесулид считается лекарственным средством BCS 2 (плохо растворимым и высокопроницаемым) [15], поэтому растворение является ограничивающим этапом для его абсорбции [16].
Солюбилизация в растворах поверхностно-активных веществ выше критической концентрации мицелл (ККМ) предлагает один из подходов к составлению малорастворимых лекарств [17]. Слабокислые и основные лекарственные средства могут быть переведены в раствор за счет солюбилизирующего действия поверхностно-активных веществ [18].
В этом исследовании различные концентрации неионного поверхностно-активного вещества Polysorbate 80 (Tween 80, CMC 0.012 мМ) использовали в сочетании с буфером (pH 7,4) для увеличения растворимости нимесулида.
Материалы и метод
Методы растворения
Профили растворения изучали с использованием аппарата 2 USP в 900 мл среды для растворения: фосфатные буферы USP с pH 7,4 с 2,5%, 1%, 0,5%, 0,1%, 0,05% и 0,01% Tween 80, ацетатный буфер USP с pH 4,5. Скорость перемешивания составляла 100 об / мин при постоянной температуре бани 37 ± 0,5 0 ° C. Образцы объемом 4 миллилитра отбирали через 5, 10, 15, 20, 30, 45 и 60 минут и дополняли 4 мл свежей среды растворения. Аналитический метод анализа был спектрофотометрическим, определения проводили при 274 нм.
Аналитический метод анализа был спектрофотометрическим, определения проводили при 274 нм.
Калибровочная кривая (четыре стандарта) построена в фосфатном буфере pH 7,4 с 2,5% твина 80. Во всех других средах нимесулид не растворился. Все показания были сняты с одинаковой калибровкой.
Для каждого растворения готовили три литра буфера с определенным процентным содержанием Твина 80, после чего в каждый сосуд вносили 900 мл; оставшаяся часть 300 мл раствора была использована для холостого опыта и стандартов.
Результаты и обсуждение
Релиз в 2.5% Tween 80
Релиз был очень быстрым, без «задержки во времени». Однако выпуск не был завершен, за 60 минут выпущенное количество составило менее 92%. Значение не похоже на значение насыщения, более полное высвобождение возможно через час (рис.).
Профиль высвобождения в 2,5% Tween 80.
Высвобождение в 1% Tween 80
Высвобождение происходит мгновенно, и концентрация постоянна в интервале 10–60 минут, без каких-либо доказательств того, что впоследствии она может увеличиться. По-видимому, высвобождение ограничено растворимостью, которая, по-видимому, составляет
По-видимому, высвобождение ограничено растворимостью, которая, по-видимому, составляет
78–79% в 1% Tween 80 (рис.).
Профиль выпуска в 1% Tween 80.
Выпуск в 0,5% Tween 80
Выпуск осуществляется немедленно. Кажется, что значение 77% — это значение насыщения. Кажется, это немного меньше, чем значение насыщенности в 1% Tween 80 (рис.).
Профиль выпуска в 0,5% Tween 80.
Релиз в 0,10% Tween 80
Выпущен немедленно. Начальное значение 52% больше похоже на ошибку при обнаружении номера 1 в сосуде номер 2.Значение 49% отображается как значение насыщенности (рис.).
Профиль выпуска в 0,10% Tween 80.
Выпуск в 0,50% Tween 80
Выпущен немедленно. Скачок с 15 до 20 минут менее объясним. Значение насыщенности кажется 57% (рис.).
Профиль высвобождения 0,05% Твина 80.
Высвобождение 0,01% Твина 80
Кривая выглядит как кривая насыщения, вероятно, значение 51–52% (рис.).
Профиль выпуска в 0.01% Tween 80.
Сравнение профилей растворения
Представление всех кривых растворения подтверждает характер «кривой насыщения» для всех концентраций ниже 2,5%. В этих условиях исследование представляет собой оценку зависимости «растворимости» нимесулида от концентрации твина (рис.).
Профиль высвобождения при различных концентрациях Твина 80.
Представление «растворимости», связанной с концентрацией твинов, демонстрирует, по крайней мере, странное поведение.Растворимость, по-видимому, снижается от концентрации 0,05% до 0,1%, а затем увеличивается с увеличением концентрации Твина (рис.). Это могло быть аналитическим «неверным толкованием». Стандартные кривые на самом деле были прямыми линиями с очень хорошим коэффициентом корреляции во всех случаях. Однако при небольшой концентрации Твина растворы на самом деле были опалесцирующими, и могла быть систематическая ошибка в оценке («систематическая ошибка») всего набора данных. К сожалению, точных оценок концентраций в опалесцентных растворах нет. В диапазон используемых концентраций твина включена его критическая мицеллярная концентрация (КМЦ). Мы не знаем, какое значение имеет КМЦ в фосфатном буфере и в присутствии нимесулида.
В диапазон используемых концентраций твина включена его критическая мицеллярная концентрация (КМЦ). Мы не знаем, какое значение имеет КМЦ в фосфатном буфере и в присутствии нимесулида.
Представление времени высвобождения в зависимости от концентрации твина.
По «фольклорным» отчетам компаний, где все предельно ясно, даже идеальный [19] КМЦ составляет 0,012 мМ. Однако эффективные, более систематические экспериментальные измерения показали, что значение зависит от концентрации электролита (например, KCl), присутствующего в растворе [20], уменьшаясь с 0.От 005% (мас. / Об.) До 0,003% по мере увеличения концентрации KCl. 0,005% мас. / Об. (Или ~ 0,01% об. / Об.) — это другие зарегистрированные значения, коррелирующие с указанными выше, но в других экспериментальных условиях [21].
Поскольку растворы, использованные в эксперименте, были приготовлены путем измерения объема Твина, а не путем взвешивания, КМЦ в любом случае должен быть не слишком далеко от значения 0,01%. Следовательно, прерывание или даже инверсия эффекта может быть критическим поведением в отношении CMC.
Следовательно, прерывание или даже инверсия эффекта может быть критическим поведением в отношении CMC.
Фактически, поверхностно-активное вещество накапливается на границе раздела частицы нимесулида — раствор, и на этой границе все явления и все концентрации значительно отличаются от таковых в объеме раствора.Любой воображаемый механизм, касающийся явлений на границе раздела, где также появляются электрические структуры, остается непроверяемым предположением.
В конце концов, мы должны оставить это «ненормальное» поведение как «нормальное» в окрестности cmc.
Модель выпуска
Единственным случаем, когда выпуск действительно выглядел как «кривая выпуска», был выпуск в 2,5% Tween. Представление выпущенного количества как функции квадратного корня из времени было сделано для проверки возможного выброса в соответствии с законом Хигучи.Если бы это было так, экспериментальные точки должны были бы располагаться на линии, но это не так (рис.).
Выпуск как функция sqrt (t).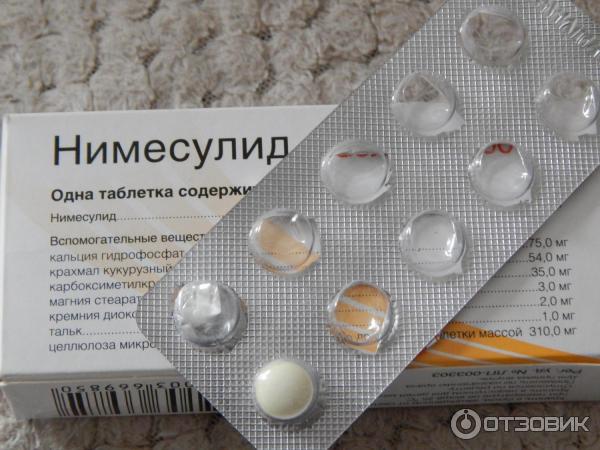
Для случая 2,5% мы пошли дальше и представили ln (1-Rexp / 100) в зависимости от времени («линеаризованный» закон Ноайеса-Уитни). Так и не получено линейной зависимости (рис.).
Представление ln (1-Rexp / 100) в зависимости от времени.
Однако кривая кажется кривой выпуска. Чтобы сопоставить данные, мы выбрали эмпирический закон Вейбулла):
Представление ln (-ln (1-R / 100)) в зависимости от ln t действительно привело к линии, как это видно на рисунке ниже..
Представление ln (-ln (1-R / 100)) в зависимости от ln t.
Выводы
1. Высвобождение нимесулида из таблеток при pH 7,4 представляет собой немедленное высвобождение, причем высвобождаемое количество, очевидно, ограничивается растворимостью, пределом, который зависит от концентрации Твина.
2. Зависимость высвобожденного количества от концентрации Твина не является линейной, очень низкая концентрация Твина показывает также снижение «растворимости», вероятно, связанное с критической концентрацией мицелл на границе раздела раствора нимесулида. «Аналитический» артефакт, связанный со снижением поглощения нимесулида ультрафиолетом из-за осаждения нимесулида, возможно образование коллоидного раствора, и это явление еще предстоит исследовать.
«Аналитический» артефакт, связанный со снижением поглощения нимесулида ультрафиолетом из-за осаждения нимесулида, возможно образование коллоидного раствора, и это явление еще предстоит исследовать.
3. Трудно объяснить, почему для почти полной солюбилизации необходимо значительно более высокое количество Твина, чем для других малорастворимых лекарств.
4. Модель, за которой следует кинетическое высвобождение, — это модель Вейбулла, но первоначальное высвобождение можно также смоделировать с помощью закона квадратного корня Хигучи.
Список литературы
1. Уотербемд ван де Х. Кишечная проницаемость: предсказание из теории. В: Дрессма Дж. Б., Леннернес Х., редакторы. Всасывание пероральных препаратов, прогноз и оценка. Нью-Йорк: Марсель Деккер; 2000. С. 31–50. [Google Scholar] 2. Ю. Л., Гатлин Л., Амидон Г. Л. Прогнозирование всасывания пероральных препаратов. В: Амидон Г.Л., Ли П.И., Топп Э.М., редакторы. Транспортные процессы в фармацевтических системах. Нью-Йорк: Марсель Деккер; 2000. С. 377–409. [Google Scholar] 3. Грасси М., Кочани Н., Магаротто Л. Моделирование разделения труднорастворимых лекарств в двухфазной жидкой системе. Int J Pharm. 2002. 239 (1-2): 157–169. [PubMed] [Google Scholar] 5. Амидон Г.Л., Леннернес Х., Шах В.П., Крисон Дж.Р. Теоретическая основа классификации биофармацевтических препаратов: корреляция растворения лекарственного препарата in vitro и биодоступности in vivo. Pharm Res. 1995. 12 (3): 413–420. [PubMed] [Google Scholar] 6. Грасси М., Каделли Г. Теоретические соображения по определению кишечной проницаемости in vivo с помощью однопроходных и рециркуляционных методов.Int J Pharm. 2001. 229 (1–2): 95–105. [PubMed] [Google Scholar] 7. Фагерхольм У., Леннернес Х. Экспериментальная оценка эффективной толщины неперемешиваемого слоя воды в тощей кишке человека и ее значение для всасывания пероральных лекарств. Eur J Pharm Sci. 1995. 3 (5): 247–253. [Google Scholar] 8. Фагерхольм У., Йоханссон М., Леннернес Х. Сравнение коэффициентов проницаемости тощей кишки крысы и человека.
С. 377–409. [Google Scholar] 3. Грасси М., Кочани Н., Магаротто Л. Моделирование разделения труднорастворимых лекарств в двухфазной жидкой системе. Int J Pharm. 2002. 239 (1-2): 157–169. [PubMed] [Google Scholar] 5. Амидон Г.Л., Леннернес Х., Шах В.П., Крисон Дж.Р. Теоретическая основа классификации биофармацевтических препаратов: корреляция растворения лекарственного препарата in vitro и биодоступности in vivo. Pharm Res. 1995. 12 (3): 413–420. [PubMed] [Google Scholar] 6. Грасси М., Каделли Г. Теоретические соображения по определению кишечной проницаемости in vivo с помощью однопроходных и рециркуляционных методов.Int J Pharm. 2001. 229 (1–2): 95–105. [PubMed] [Google Scholar] 7. Фагерхольм У., Леннернес Х. Экспериментальная оценка эффективной толщины неперемешиваемого слоя воды в тощей кишке человека и ее значение для всасывания пероральных лекарств. Eur J Pharm Sci. 1995. 3 (5): 247–253. [Google Scholar] 8. Фагерхольм У., Йоханссон М., Леннернес Х. Сравнение коэффициентов проницаемости тощей кишки крысы и человека. Pharm Res. 1996. 13 (9): 1336–1342. [PubMed] [Google Scholar] 9. Мериани Ф., Кочани Н., Сиротти К., Войнович Д., Грасси М. Абсорбция нимесулида in vitro из различных препаратов. J Pharm Sci. 2004. 93 (3): 540–552. [PubMed] [Google Scholar] 10. Дэвис Н., Брогден Р. Нимесулид: обновление его фармакодинамических и фармакокинетических свойств и терапевтической эффективности. Наркотики. 1994. 48 (3): 431–454. [PubMed] [Google Scholar] 11. Macia M.A., Carvajal A., Del Pozo J.G., Vera E., Del Pino A. Гепатотоксичность, связанная с нимесулидом: данные Испанской системы фармаконадзора. Clin Pharmacol Ther. 2004. 72 (5): 596–597.[PubMed] [Google Scholar] 12. Родриго Л., Де Франсиско Р., Перес-Париенте Дж. М., Кадахия В., Тохо Р., Родригес М., Лусена М. И., Андраде Р. Дж. Вызванная нимесулидом тяжелая гемолитическая анемия и острая печеночная недостаточность, приводящие к трансплантации печени. Сканд Дж Гастроэнтерол. 2002. 37 (11): 1341–1343. [PubMed] [Google Scholar] 13. Piel G., Pirotte B., Delneuville I.
Pharm Res. 1996. 13 (9): 1336–1342. [PubMed] [Google Scholar] 9. Мериани Ф., Кочани Н., Сиротти К., Войнович Д., Грасси М. Абсорбция нимесулида in vitro из различных препаратов. J Pharm Sci. 2004. 93 (3): 540–552. [PubMed] [Google Scholar] 10. Дэвис Н., Брогден Р. Нимесулид: обновление его фармакодинамических и фармакокинетических свойств и терапевтической эффективности. Наркотики. 1994. 48 (3): 431–454. [PubMed] [Google Scholar] 11. Macia M.A., Carvajal A., Del Pozo J.G., Vera E., Del Pino A. Гепатотоксичность, связанная с нимесулидом: данные Испанской системы фармаконадзора. Clin Pharmacol Ther. 2004. 72 (5): 596–597.[PubMed] [Google Scholar] 12. Родриго Л., Де Франсиско Р., Перес-Париенте Дж. М., Кадахия В., Тохо Р., Родригес М., Лусена М. И., Андраде Р. Дж. Вызванная нимесулидом тяжелая гемолитическая анемия и острая печеночная недостаточность, приводящие к трансплантации печени. Сканд Дж Гастроэнтерол. 2002. 37 (11): 1341–1343. [PubMed] [Google Scholar] 13. Piel G., Pirotte B., Delneuville I. , Neven P., Llabres G., Delarge J., Delattre L. Исследование влияния циклодекстринов и L-лизина на растворимость нимесулида в воде: выделение и характеристика нимесулида Комплексы -L-лизин-циклодекстрин.J Pharm Sci. 1997. 86 (4): 475–480. [PubMed] [Google Scholar] 14. Наллури Бучи Н., Чоудар К.П.Р., Мурти К.В.Р., Хейман А.Р., Бекет Г. Физико-химические характеристики и свойства растворения бинарных систем нимесулид-циклодекстрин. AAPS PharmSciTech. 2003. 4 (1): 6–17. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Абделькадер Х., Абдалла О.Ю., Салем Х.С. Сравнение влияния трометамина и поливинилпирролидона на свойства растворения и обезболивающее действие нимесулида. AAPS Pharm Sci Tech.2007; 8 (3): E110 – E117. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Carrasco-Portugal M.C., Flores-Murrieta F.J. Сравнение состава суспензии по фармакокинетике нимесулида у крыс. Proc West Pharmacol Soc. 2008. 51: 58–59. [PubMed] [Google Scholar] 17. Аттвуд Д., Флоренс А. Нью-Йорк: Чепмен и Холл; 1983.
, Neven P., Llabres G., Delarge J., Delattre L. Исследование влияния циклодекстринов и L-лизина на растворимость нимесулида в воде: выделение и характеристика нимесулида Комплексы -L-лизин-циклодекстрин.J Pharm Sci. 1997. 86 (4): 475–480. [PubMed] [Google Scholar] 14. Наллури Бучи Н., Чоудар К.П.Р., Мурти К.В.Р., Хейман А.Р., Бекет Г. Физико-химические характеристики и свойства растворения бинарных систем нимесулид-циклодекстрин. AAPS PharmSciTech. 2003. 4 (1): 6–17. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Абделькадер Х., Абдалла О.Ю., Салем Х.С. Сравнение влияния трометамина и поливинилпирролидона на свойства растворения и обезболивающее действие нимесулида. AAPS Pharm Sci Tech.2007; 8 (3): E110 – E117. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Carrasco-Portugal M.C., Flores-Murrieta F.J. Сравнение состава суспензии по фармакокинетике нимесулида у крыс. Proc West Pharmacol Soc. 2008. 51: 58–59. [PubMed] [Google Scholar] 17. Аттвуд Д., Флоренс А. Нью-Йорк: Чепмен и Холл; 1983.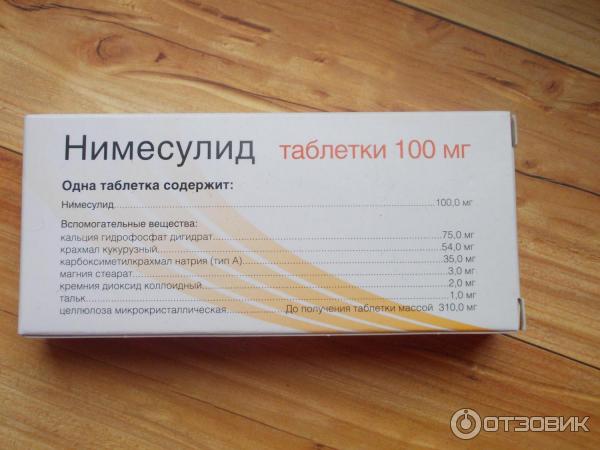 [Google Scholar] 18. Мартин А., Бустаманте П., Чун А.Х.С. Явления растворимости и распределения. В: Мартин А., Бустаманте П., Чун А.Х.С., редакторы. Физическая фармация и фармацевтические науки.4. Филадельфия: Леа и Фебигер; 1993. С. 212–250. [Google Scholar] 20. Малик У.У., Джамб О.П. Критическая концентрация мицелл некоторых полиоксиэтилированных неионных поверхностно-активных веществ и влияние добавок. Colloid Polymer Sci. 1970. 242 (1-2): 1209–1211. [Google Scholar] 21. Чжан Х., Яо М., Моррисон Р.А., Чонг С. Обычно используемое поверхностно-активное вещество, Твин 80, улучшает абсорбцию субстрата Р-гликопротеина, дигоксина, у крыс. Arch Pharm Res. 2003. 26 (9): 768–772. [PubMed] [Google Scholar]
[Google Scholar] 18. Мартин А., Бустаманте П., Чун А.Х.С. Явления растворимости и распределения. В: Мартин А., Бустаманте П., Чун А.Х.С., редакторы. Физическая фармация и фармацевтические науки.4. Филадельфия: Леа и Фебигер; 1993. С. 212–250. [Google Scholar] 20. Малик У.У., Джамб О.П. Критическая концентрация мицелл некоторых полиоксиэтилированных неионных поверхностно-активных веществ и влияние добавок. Colloid Polymer Sci. 1970. 242 (1-2): 1209–1211. [Google Scholar] 21. Чжан Х., Яо М., Моррисон Р.А., Чонг С. Обычно используемое поверхностно-активное вещество, Твин 80, улучшает абсорбцию субстрата Р-гликопротеина, дигоксина, у крыс. Arch Pharm Res. 2003. 26 (9): 768–772. [PubMed] [Google Scholar]
(PDF) Матричные гранулы с замедленным высвобождением нимесулида, полученные путем экструзии / сферонизации
1862
IBRAHIM M.А., ХАССАН М.А., Аль-ЭНАЗИ Н.А., МАХМУД Х.А. & EL-BADRY M.
ues и реологические характеристики с использованием реометра крутящего момента
(MTR), чтобы адаптировать и предварительно
определять гранулы 4-6. Использование реометра крутящего момента смесителя
Использование реометра крутящего момента смесителя
в качестве предварительного аналитического инструмента и инструмента для определения формул может значительно сократить количество
партий рецептур и проявлений. Также было показано, что оборудование
MTR является отличным инструментом для оценки систем
с влажным гранулированием и в качестве инструмента для масштабирования гранулированных материалов с высоким сдвигом
7.Несколько авторов сравнили
реологических свойств различных микрокристаллов —
таллиновых целлюлозных систем 8,9. Ибрагим 10 показал
, что свойства, такие как размер гранул, форма
и поверхности, а также скорости высвобождения лекарственного средства и кинетика
матричных гранул мефенаминовой кислоты
могут быть успешно коррелированы с характеристиками массы во влажном состоянии
с использованием миксера. реометрия.
Нимесулид (4-нитро-2-феноксиметан-сульф-
фонанилид) является нестероидным противовоспалительным препаратом
(НПВП) с анальгетическими и жаропонижающими свойствами
и относительно селективным к ЦОГ-2. Он
Он
одобрен для лечения острой боли,
симптоматического лечения остеоартрита и первичной дисменореи у подростков и взрослых
старше 12 лет 11. Нимесулид имеет несколько факторов факторного действия
и
характеризуется быстрым началом действия 12.
Короткий биологический период полувыведения от 1,80 до 4,73 ч
после пероральной дозы нимесулида требует частого приема препарата
для поддержания требуемых концентраций устойчивого состояния
13 .В дополнение к
режимы дозирования обычных пероральных лекарственных форм
требуют введения лекарственного средства
три или четыре раза в день для поддержания адекватной терапевтической эффективности
, что может привести к проблемам со стороны пациентов
. Более того, обычные лекарственные формы
не защищают пациентов от утренней скованности суставов, которая обычно встречается при ревматоидных заболеваниях 14.
. Высвобождающие лекарственные формы
нимесулида могут иметь преимущество в снижении побочного эффекта
и колебаний уровня в плазме, пролон-
действия лекарственного средства и улучшении биодоступности
, а также соблюдении пациентом режима лечения.
Целью данного исследования является производство и оценка
матричных гранул с замедленным высвобождением, загруженных
нимесулидом, с использованием методов экструзии-сферонизации
. Параметры состава, влияющие на свойства гранул и высвобождение лекарственного средства in vitro
ro, также будут исследованы. Крутящий момент смесителя
Реометр
(MTR) будет использоваться для характеристики
реологических свойств влажной массы, используемой в составе гранул
.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Нимесулид был приобретен у Triveni
Chemicals, Vapi, (Индия), микрокристаллическая целлюлоза
потер (Avicel® PH-101). Лактоза была закуплена
у ServaFeinbiochemica, (Гейдельберг, Германия
многие). Этилцеллюлоза (ЕС) была подарена Color-
con, (Великобритания). Полиэтиленгликоль;
ПЭГ2000 были приобретены у Fluka chemical
(Бух, Швейцария). Kollicoat IR (KL) был получен от BASF (Людвигсхафен, Германия). Все
Все
других материалов и растворителей имеют аналитическую чистоту
и использовались без дополнительной очистки
.
Исследования мокрого массирования (смеситель torquerheome-
try)
Реометр крутящего момента смесителя, использованный в исследовании, отправленном до
, состоит из стальной емкости из нержавеющей стали
емкостью 135 мл, оснащенной двумя лопастями для перемешивания
со скоростью вращения в диапазоне от 20-150
об / мин (MTR-3, Caleva, Дорсет, Великобритания).
В зависимости от насыпной плотности образца 15-
30 г сухого порошкового материала достаточно, чтобы покрыть
лопастей смесителя.
Крутящий момент измеряется непосредственно на чаше смесителя
с помощью моментного рычага, соединенного
от основного корпуса смесителя с калиброванным датчиком нагрузки
. Для всех исследований использовался следующий комплект оборудования —
штук: скорость мешалки
50 об / мин. Сбор и анализ данных
Сбор и анализ данных
выполнялись на персональном компьютере с использованием системы сбора данных
и программного пакета
, поставляемого производителем оборудования.Порошки
смешивали в смесителе Turbula (тип S27, Erwe-
ka, Аппаратебау, Германия), и образец
этой сухой смеси массой 15 г использовали в исследованиях мокрого массирования
. Было добавлено пять мл гранулирующей жидкости
несколькими добавками к 7 влажным массам из
валов. Каждый интервал влажного массирования состоял из периода перемешивания 1
мин и периода регистрации данных 20 с (столбец
) с MTR, работающим со скоростью 50
об / мин.Средний крутящий момент контролировали в процессе гранулирования
.
Производство гранул
Состав гранул различной формулы —
единиц представлены в таблице 1. Авицел, полимеры
и нимесулид были смешаны в смесителе Turbula
при определенной массе, и порошковая смесь была
смачиваемой. связующим (вода). Затем был получен результат —
связующим (вода). Затем был получен результат —
влажная масса была экструдирована со скоростью 90 об / мин
с размером пор 1 мм Ø (Mini Screw
Экструдер
, модель MSE1014, Caleva, Dorset, Unit-
Характеристика нимесулида и разработка таблеток немедленного высвобождения
1.Введение
Нимесулид представляет собой нестероидный сульфонамид и относится к классу противовоспалительных препаратов (НПВП), которые демонстрируют селективность в отношении ЦОГ-2 (циклооксигеназа-2) и, следовательно, обладают противовоспалительным, обезболивающим и жаропонижающим действием 1, 2 . При введении в рекомендованной дозировке проявляет низкую частоту побочных эффектов и лучше переносится, чем другие НПВП, такие как диклофенак, кетопрофен, напроксен и пироксикам 1 .
Нимесулид представляет собой производное сульфонанилида с температурой плавления около 143 ° C 2,3 .Согласно литературным данным, он является слабокислым (pK a приблизительно до 6,5), что объясняется наличием сульфонамидной группы 1,2 . Практически нерастворим в воде (около 10 мкг / мл) и растворим в метаноле и этаноле при комнатной температуре 4 . Согласно системе классификации биофармацевтики (BCS) нимесулид считается лекарственным средством класса 2, характеризующимся низкой растворимостью и высокой проницаемостью. Таким образом, его растворение может представлять собой ограничивающую стадию в процессе абсорбции лекарственного средства 3 .
Практически нерастворим в воде (около 10 мкг / мл) и растворим в метаноле и этаноле при комнатной температуре 4 . Согласно системе классификации биофармацевтики (BCS) нимесулид считается лекарственным средством класса 2, характеризующимся низкой растворимостью и высокой проницаемостью. Таким образом, его растворение может представлять собой ограничивающую стадию в процессе абсорбции лекарственного средства 3 .
Согласно одному исследованию, опубликованному в литературе, кристаллизация нимесулида в различных органических растворителях влияет на некоторые физико-химические свойства, такие как температура плавления, растворимость и профиль растворения, что указывает на существование полиморфов 5 . Другие исследования описывают существование двух полиморфов нимесулида: формы I (обычно используемой в фармацевтической промышленности) и формы II 6,7 .
В некоторых исследованиях обсуждается характеристика нимесулида и показано, что методы ДСК и рентгеновской дифракции являются многообещающими для идентификации полиморфов нимесулида 7 . Кроме того, в литературе есть несколько исследований с использованием спектроскопии в инфракрасной форме, дополняющих другие аналитические методы 7-10 .
Кроме того, в литературе есть несколько исследований с использованием спектроскопии в инфракрасной форме, дополняющих другие аналитические методы 7-10 .
Что касается биофармацевтической оценки, в ходе исследования были получены различные значения внутренней скорости растворения полиморфов I и II нимесулида. Однако анализ графика в этом исследовании показывает отсутствие линейности, влияющей на результаты, полученные в IDR 7 . Других исследований с использованием внутреннего растворения этого препарата не было обнаружено, как и исследований с использованием теста на смачиваемость.Наряду с такими испытаниями растворение порошка использовалось в биофармацевтической оценке 11,12 , потому что есть некоторые важные факторы, которые могут повлиять на результаты анализа, например, смачиваемость, кристалличность, размер частиц и площадь поверхности 13 .
В исследованиях состава оценивали профиль растворения таблеток нимесулида и обнаружили, что высвобождение лекарственного средства не достигается даже при тестировании присутствия поверхностно-активного вещества в различных концентрациях в среде растворения 14,15 .![]()
Было показано, что уменьшение размера частиц лекарства до микрочастиц значительно увеличивает растворение и биодоступность лекарств. Это достигается за счет увеличения контактной поверхности, что положительно сказывается на скорости растворения и, возможно, абсорбции 16 . Одним из методов уменьшения размера частиц является микронизация 17 , однако, хотя есть преимущества в отношении оптимизации растворения лекарств с низкой растворимостью, микронизацию следует тщательно рассмотреть, поскольку это может привести к проблемам с низкой плотностью и неадекватной текучести.Соответственно, что касается текучести, в литературе сообщается о предыдущем исследовании по оценке текучести, в котором было продемонстрировано, что нимесулид не имеет хороших свойств текучести 9 .
Целью данного исследования было определение характеристик образцов нимесулида от различных производителей и разработка таблеток с немедленным высвобождением для регистрации генерического продукта. Также была предпринята попытка установить некоторую корреляцию между характеристиками сырья и конечными свойствами таблеток, чтобы установить другие спецификации для контроля качества.
Также была предпринята попытка установить некоторую корреляцию между характеристиками сырья и конечными свойствами таблеток, чтобы установить другие спецификации для контроля качества.
2. Материалы
и методы
2.1. Материалы
Образцы
нимесулида от трех разных производителей были закодированы как NM1 (образец немикронизированный),
NM2 и NM3 (микронизированные). Вспомогательные вещества целлюлоза микрокристаллическая 101
(Mingtai), моногидрат лактозы 80 (DFE Pharma), лаурилсульфат натрия
(Ядерный), докузат натрия (Shin-Etsu Chemical), натрийгликолят крахмала
(Ecadil), низкозамещенная гидроксипропилцеллюлоза (Shin-Etsu Chemical),
поливинилпирролидон К-30 (Boai Niki) и стеарат магния (Magnesia),
ранее протестированы и одобрены в соответствии с USP 18 .Стандарт
образец нимесулида был предоставлен Национальным институтом контроля качества в г.
Здоровье, чистота 99,80% и Нисулид ® , Лаборатория Аче, как
справочное лекарство.
2. 2.
2.
Оценка активного фармацевтического ингредиента в соответствии с фармакопеей
критерии
Образцы NM1, NM2 и
NM3, были проанализированы в соответствии с методологиями, описанными в бразильском
Фармакопея 4 . Тесты включали идентификацию с использованием
метод инфракрасной спектроскопии (спектрометр инфракрасный модель Nicolet 6700
FT-IR, Thermo Scientific), тяжелые металлы, потери при сушке, сульфатная зола и
дозирование.Этот последний следовал рекомендациям, установленным в методе B
Бразильской фармакопеи, которая использует спектрофотометрическое поглощение в
ультрафиолетового (LAMBDA 25, PerkinElmer) и измерения оптической плотности
при 392 нм.
2.3.
Дифференциальная сканирующая калориметрия (ДСК)
Анализ DSC был
выполняется с дифференциалом
прибор исследовательский калориметр модель 60, Шимадзу. В
образцы отвешивали (около 3 мг) и помещали в алюминиевые тигли с
крышка закрыта.Кривые ДСК были получены при скоростях нагрева 5, 10, 20 и
40 ° C / мин при температуре от 25 до 200 ° C, расход не менее 50 мл -1
газообразного аргона. Анализы проводили в трех экземплярах. Были разные скорости нагрева.
Анализы проводили в трех экземплярах. Были разные скорости нагрева.
использовал.
2.4. преобразование Фурье
Инфракрасная спектроскопия
Спектры FTIR были
запись с использованием Thermo Scientific, модель Nicolet 6700 FT-IR, в диапазоне от
4000-400 см -1 при разрешении 4 см -1 .ИК
образцы были проанализированы напрямую без пробоподготовки
2,5. Рентгеновский
Порошковая дифракция
Модели XRPD
запись образцов производилась на рентгеновском дифрактометре D8 (Bruker), оснащенном
Детектор Lynxeye XE с Cu в качестве анода трубки (Kα-излучение с λ = 1,5418). Дифракция
Образцы записывались при следующих условиях: напряжение 40 кВ, 40 мА и
фиксированная расходимость щели с использованием конфигурации диапазона 2θ от 4 до 50 °, с размером шага 0.02 ° и а
время шага 0,1 с. Идентификация кристаллической структуры проводилась.
используя базу данных Cambridge Structural Database (CSD) 19 и
Расчетная рентгенограмма была подготовлена с использованием программы Mercury 3. 7 20 .
7 20 .
2.6.
Определение гранулометрического состава с помощью лазерной дифракции
Размер частиц
распределение было получено методом лазерной дифракции на приборе Malvern
оборудование, модель 2000E Mastersizer, использующее жидкий режим, диапазон измерения
из 0.1-500 мкм и затемнение между
17 и 23%. Суспензию 500 мг нимесулида готовили на водной
раствор, содержащий 0,5% полисорбат 80, всего около 30 мл. Это было
необходимо использовать ультразвук (USC 2800A, Unique) со скоростью 10.
2.7.
Сканирующая электронная микроскопия (СЭМ)
Для изучения морфологии образцов НМ, СЭМ выполняли на микроскопе Quanta 400 (FEI) при напряжении 10 кВ с использованием увеличения 500 и 16000x. Небольшие количества образца приклеивались к металлическому стержню с помощью двусторонней клейкой углеродной ленты, на которую затем наносили вакуумное покрытие (0.6 мбар) тонким слоем золота в установке для нанесения покрытий распылением BAL-TEC SCD 005 при комнатной температуре.
2,8. Смачиваемость
Анализ был
проводится с помощью тензиометра Krüss, DSA 100 при комнатной температуре покоящейся каплей
метод. Примерно 300 мг были спрессованы в виде дисков с давлением 800 фунтов на квадратный дюйм.
в течение 1 мин с помощью гидравлического пресса. Жидкая капля (вода, насыщенная
нимесулид) наносили на поверхность образца, и изображения
захватили сразу.В
прибор рассчитал угол смачивания путем подбора математического выражения к
форма капли.
2.9. Пудра
роспуск
Растворение порошка
проводился с диссолютором Distek, модель 6100, и условия были такими, как
следующее: 900 мл буферного раствора фосфата калия, доведенного до pH 7,4, с
2,0% полисорбат 80 (мас. / Мас.) При 37 ± 0,5 ° C и перемешивание с помощью аппарата II (лопастной).
при скорости вращения 75 об / мин. Примерно 100.Было добавлено 0 мг нимесулида.
непосредственно в сосуды, и аликвоты по 10 мл собирали через 5, 10, 15,
20, 30, 45, 60 и 90 мин, без замены среды. Аликвоты были отфильтрованы
Аликвоты были отфильтрованы
через политетрафторэтиленовый фильтр 45 мкм, разбавленный и оптическую плотность, измеренную в
спектрофотометр (LAMBDA 25, PerkinElmer) на длине волны 392 нм. Испытания
были выполнены в трех экземплярах. Сравнение профилей растворения
дисперсия производилась путем расчета разностного фактора (F1), подобие
фактор (F2) и эффективность растворения (DE).Значения DE были представлены
к статистическому анализу дисперсии (односторонний дисперсионный анализ) с последующим тестом Тьюки и
считалось значимым p <0,05.
2.10.
Определение сыпучести
Оценка
Сыпучесть оценивалась по насыпной и насыпной плотности, индексу Карра, Хауснеру.
отношение, угол естественного откоса и определение расхода через отверстие. Плотности
были определены в соответствии с методом I Фармакопеи США 18 с использованием оборудования Tap
Тестер плотности (Nova Ética).Эти значения использовались для расчета индекса Карра.
и коэффициент Хауснера. Для определения угла естественного откоса и расхода через
с отверстием использовалось оборудование для тестирования гранулята GTB (Erweka) с различными
диаметр отверстий и скорость вращения для определения оптимальных условий испытаний и различения
профили сыпучести образцов.
2.11.
Дизайн рецептуры
Были приготовлены партии галеновой кислоты в количестве примерно от 600 до 800 г. Влажное гранулирование проводили в грануляторе с высоким сдвигом объемом 4 л (TMG 1/6, Glatt) для исходной порошковой смеси и смачивания раствором связующего.После гранулирования влажную массу пропускали через сетку 4 мм с помощью осциллирующего гранулятора (K-70, Lawes). Сушку гранулята проводили в псевдоожиженном слое (Midi Glatt, Glatt) при температуре 45 ° C в контролируемом потоке. Конечная точка была определена путем сушки остаточной влажности с использованием инфракрасных весов (IV2500, Gehaka) и был установлен в диапазоне от 2 до 3%. После сушки гранулят нормализовали с размером ячеек 1,5 мм в осциллирующем грануляторе. Затем этот гранулят переносили в V-образный смеситель объемом 2 л (66/10, Lawes) для смешивания наполнителей, которые были добавлены во внегранулярную фазу.Наконец, сжатие производилось на вращающемся компрессоре (2000 10PSC, Lawes), снабженном пуансонами с плоским 10 мм. Контроль процесса осуществлялся путем проверки веса, твердости, хрупкости и дезинтеграции таблеток. Для таких определений использовалось следующее оборудование: полуаналитические весы емкостью 200 г (Sartorius), портативный твердомер (TBh200, Erweka), тестер хрупкости (TA10, Erweka) и дезинтегратор (301-1, Nova Ética).
Контроль процесса осуществлялся путем проверки веса, твердости, хрупкости и дезинтеграции таблеток. Для таких определений использовалось следующее оборудование: полуаналитические весы емкостью 200 г (Sartorius), портативный твердомер (TBh200, Erweka), тестер хрупкости (TA10, Erweka) и дезинтегратор (301-1, Nova Ética).
2.12. Оценка
галеновых партий
Таблетки анализировали по средней массе, твердости, хрупкости и дезинтеграции, как описано в Бразильской фармакопее 4 , и сравнительный профиль растворения проводили с эталонным лекарственным средством Nisulid ® .
2.13. Дозирование
Анализ был
выполняется в соответствии с Бразильской фармакопеей 4 , которая
определяет содержание нимесулида в таблетках по абсорбции ультрафиолета
спектрофотометрия на длине волны 392 нм. Анализ проводился в
повторить трижды со стандартным раствором и раствором образца.
2.14.
Профиль растворения
Первоначально профили растворения были выполнены в условиях, рекомендованных Бразильской фармакопеей 4 , при этом контрольный продукт и партии галеновых кислот, которые показали результаты физических испытаний (твердость, распад и хрупкость), были наиболее многообещающими. Аналитические условия были следующими: 900 мл калий-фосфатного буфера, pH 7,4, содержащего 2,0% (об. / Об.) Полисорбата 80, и перемешивание лопастью при скорости вращения 75 об / мин. Аликвоты по 10 мл удаляли через 5, 10, 15, 20, 30 и 45 минут без замены среды, поддерживая условия погружения на протяжении всего теста. Количество растворенного лекарственного средства определяли путем считывания на спектрофотометре (UV-1800, Shimadzu) в ультрафиолетовой области при длине волны 392 нм. Затем для проведения дополнительных исследований профилей растворения был выбран один из галеновых составов, который показал тот же тип растворения, что и контрольный продукт.Для этого использовалась среда растворения калий-фосфатного буфера, pH 7,4, содержащая полисорбат 80 в концентрациях 1,0% и 0,5%. Остальные аналитические условия были сохранены. Профили растворения сравнивали с использованием эффективности растворения (DE), и их значения подвергали статистическому дисперсионному анализу (однофакторный дисперсионный анализ) с последующим тестом Тьюки и считали значимым p <0,05.
Аналитические условия были следующими: 900 мл калий-фосфатного буфера, pH 7,4, содержащего 2,0% (об. / Об.) Полисорбата 80, и перемешивание лопастью при скорости вращения 75 об / мин. Аликвоты по 10 мл удаляли через 5, 10, 15, 20, 30 и 45 минут без замены среды, поддерживая условия погружения на протяжении всего теста. Количество растворенного лекарственного средства определяли путем считывания на спектрофотометре (UV-1800, Shimadzu) в ультрафиолетовой области при длине волны 392 нм. Затем для проведения дополнительных исследований профилей растворения был выбран один из галеновых составов, который показал тот же тип растворения, что и контрольный продукт.Для этого использовалась среда растворения калий-фосфатного буфера, pH 7,4, содержащая полисорбат 80 в концентрациях 1,0% и 0,5%. Остальные аналитические условия были сохранены. Профили растворения сравнивали с использованием эффективности растворения (DE), и их значения подвергали статистическому дисперсионному анализу (однофакторный дисперсионный анализ) с последующим тестом Тьюки и считали значимым p <0,05.
3. Результаты
3.1.
Оценка активного фармацевтического ингредиента в соответствии с критериями фармакопеи
Результаты тяжелой
металлов, потери при сушке, сульфатной золы и дозирования соответствуют спецификациям
Бразильская фармакопея 4 и представлены в таблице 1.
Таблица 1.
Результаты тяжелых металлов, потери при сушке,
сульфатная зола, дозирование, угол смачивания образцов NM1, NM2 и NM3.
3.2. Дифференциальная сканирующая калориметрия (ДСК)
Кривые ДСК
полученные для образцов NM1, NM2 и NM3, измеренные при скорости нагрева 5 ° C / мин, показали единственный острый эндотермический пик при
приблизительно 149 ° C в соответствии с измерениями температуры плавления (Рис.
1). Такие же результаты были получены на кривых ДСК для образца NM1 при других условиях.
условия как 10, 20 и 40 ° C мин. -1 .Кроме того, NM2 и NM3 показали идентичные результаты. Для NM1, NM2 и NM3
образцов, базовая линия кривых ДСК была аналогичной и показывает, что термический
емкость не была изменена процессом микронизации.
Рис. 1.
Кривые ДСК снизу вверх NM1, NM2 и NM3
образцы при скорости нагрева 5 ° С / мин.
3.3. Инфракрасная спектроскопия
ИК-Фурье спектры
все образцы были эквивалентными (данные не показаны). ИК-спектр показал n NH
на 3278 см -1 , полоса на 1149 см -1 закреплена за
симметричная деформация группы SO 2 , n NO2
частоты растяжения при 1330 см -1 и 1588 см -1 и
полоса на 1246 см -1 присвоена номеру COC .За исключением n NH и n NO2 (на 1588 см -1 ), это показало слабое
пики интенсивности, все остальные функциональные группы нимесулида продемонстрировали
пики средней интенсивности.
3.4. Рентгеновская дифракция
На дифрактограммах образцов NM1, NM2 и NM3 (рис. 2) представлены характерные пики примерно при 2θ = 17,07, 18,14, 19,35 и 21,60 °. Данные сравнения образцов ясно показали, что процесс микронизации не изменил структуру НМ. Результаты сравнивали с данными полиморфов I и II NM, рассчитанными на основе CSD, и также показаны на рисунке 2.
Результаты сравнивали с данными полиморфов I и II NM, рассчитанными на основе CSD, и также показаны на рисунке 2.
Рис. 2.
Дифрактограммы образцов.
NM1, NM2 и NM3 и рассчитанные паттерны полиморфов I и II
нимесулид получен из CDCC (Кембриджский центр структурных данных).
3.5. Размер частицы
Распределение методом лазерной дифракции
Средний размер
частиц, значения частиц меньше 10% (d10), 50% (d50) и 90% (d90), а результаты индексов дисперсности (диапазона) были получены с
образцы от разных производителей нимесулида.Образец NM3 показал
наименьший размер частиц (d10 = 1,28; d50 = 6,57 и d90 = 20,61), за которым следует образец NM2 (d10 = 2,09; d50 = 8,46 и
d90 = 20,89) и, наконец,
немикронизированный образец (NM1) показал наибольший размер частиц (d10 = 10,34; d50 = 33,85 и
d90 = 76,52). Сравнение
Показатели дисперсности указывают на то, что образец NM3 имеет большую неоднородность
гранулометрического состава (DI = 2,94), затем образец NM2 (DI = 2,22)
и, наконец, образец NM1 (DI = 1. 96). Графики гранулометрического состава представлены
96). Графики гранулометрического состава представлены
показано на рисунке 3.
Рис. 3.
Измерения размера частиц, полученные с помощью ЛАЗЕРА.
дифракция снизу вверх образцов NM1, NM2 и NM3.
3,6. Сканирование
электронная микроскопия (СЭМ)
Изображения
исследуемых образцов, полученных с помощью SEM при увеличении 500x для NM1 и 16,000x
для образцов NM2 и NM3 показаны на рисунке 4. Образец NM1 представил
самый высокий размер частиц от 25 до 25.2 и 103,5 мкм, что ожидалось ранее, потому что IFA немикронизирован, в то время как
микронизированные образцы NM2 и NM3 показали частицы в диапазоне от 364,8 нм до 3,5
мкм (рис. 4 Б, В). Процесс микронизации привел к
образование агрегатов.
3,7. Смачиваемость
В таблице 1 представлены результаты для всех образцов, причем при использовании метода лежащей капли и воды в качестве смачивающего агента все они были около 80 °.
3.8. Пудра
роспуск
Сравнение
Профили дисперсии растворения образцов NM1, NM2 и NM3 показаны на рисунке.
5 и значения F1, F2 и DE были установлены.Значения F1 и F2 (15,26
и 46,23 соответственно) подтверждают, что образцы NM1 и NM3 показали
наибольшие различия между профилями. Результат F1 для микронизированных
образцы (NM2 и NM3) также показали высокое значение (12,36) и значительную
пограничный результат для параметра F2 (50,55). Менее ожидаемые, F1 и F2
значения, которые показали наибольшее сходство, были когда профили растворения
NM1 (немикронизированный) и NM2 (микронизированный) сравнивали (3.33; 69.29). DE
значения были статистически проанализированы с помощью ANOVA, и значимые различия были
обнаружено (p <0,05). Однако при использовании теста Тьюки было обнаружено, что
не было значительных различий между значениями ДЭ NM1 и NM2.
профили (ДЭ = 71 ± 2 и 74 ± 5 соответственно),
тогда как между профилями NM1 и
NM3, NM2 и NM3 (DE = 83 ± 1).
Рис. 4.
Сканирующая электронная микроскопия
пробы NM1, NM2 и NM3 сверху вниз, с измерениями с увеличением
500, 20 кВ для NM1 и 16. 000 X для NM2 и NM3.
000 X для NM2 и NM3.
Рисунок 5.
Профили растворения порошка NM1, NM2 и
Образцы NM3 в 900 мл калия фосфатного масла, pH 7,4, содержащего 2,0%
полисорбат 80 (об / об), используя лопастной аппарат при 75 об / мин.
3.9. Определение сыпучести
3.9.1. Массовый и
плотность утряски, индекс сжимаемости и коэффициент Хауснера
Полученные значения
при испытаниях насыпной плотности и плотности после выпуска, а также показателей текучести образцов нимесулида
найдены для индекса сжимаемости и коэффициента Хауснера.
в соответствии с рекомендациями USP 18 и показаны в таблице 2.Плотности, полученные для образца NM1, хоть и немного больше, но все же
представляют собой более низкие значения плотности. Меньшие значения плотностей NM2 и
Образцы NM3 соответствуют их более мелким частицам.
Таблица 2.
Данные получены из
кривые ДСК Tonset, Tpeak и энтальпия (∆H) для образцов NM1, NM2 и NM3
при разных скоростях нагрева.
3.9.2.
Определение угла естественного откоса и потока через отверстие
Угол естественного откоса
не удалось определить из-за плохой сыпучести образцов.Графики, полученные при протекании через отверстие, выглядят следующим образом:
показано на Рисунке 6, а результаты представлены в Таблице 2.
Рисунок 6.
Графики низкого проходного отверстия NM1, NM2
и образцы NM3.
3.10. Разработка
и оценка таблеток нимесулида, полученных галеновыми партиями
Конструкция
партии галеновых составов проводили с эксципиентами, обычно используемыми в
фармацевтической промышленности, помимо вспомогательных веществ, представленных в справочнике
рецептура продукта.Вспомогательные вещества: моногидрат лактозы микрокристаллический.
целлюлоза, гидроксипропилцеллюлоза, крахмалгликолат натрия, докузат натрия,
гидрогенизированное растительное масло и стеарат магния присутствуют в
состав Нисулида ® . В галеновых партиях использовалось то же самое
вспомогательные вещества, кроме гидрогенизированного растительного масла и составов с
поливинилпирролидон К-30 и прежелатинизированный крахмал в качестве связующего вместо
гидроксипропилцеллюлоза и лаурилсульфат натрия в качестве поверхностно-активного вещества вместо
докузата натрия. Использованные только галеновые партии (Таблица 3)
Использованные только галеновые партии (Таблица 3)
микронизированные образцы, NM2 и NM3, благодаря лучшим результатам в порошке
растворения, чем немикронизированный API (рис. 5).
3.10.1. Физический
Параметры таблеток и дозирования
Результаты по весу, твердости, рыхлости и дозировке были удовлетворительными. Тест на дезинтеграцию показал некоторые неудовлетворительные результаты, представленные партией L5 с относительно высоким временем дезинтеграции (L5 = 9 ’30 дюймов), особенно по сравнению с эталонным продуктом (1′ 15 дюймов), кроме L6, который не соответствовал спецификации (L6 = более 30 футов).Поэтому было решено не выполнять профили растворения этих партий.
Таблица 3.
Измерения текучести NM1, NM2 и
Образцы NM3 (n = 3).
3.10.2.
Профиль растворения
3.10.2.1.
Профили растворения, проведенные в соответствии с критериями бразильского
Фармакопея
Первоначально
Профили растворения были выполнены для галеновых партий L1, L2, L3, L4, L7
и эталонный продукт с использованием условий, рекомендованных бразильским
Фармакопеи 4 и показаны на рисунке 7. В этих тестах
В этих тестах
эталонный продукт показал значения растворения более 85% за 15 минут,
в то время как только партии L2 и L3 показали очень быстрый профиль растворения, то же самое
поведение эталонного продукта. Статистический анализ показал, что DE
значения профилей растворения L2 и L3 (ДЭ = 84,95 и 84,02 соответственно)
достоверно не различаются (p> 0,05). Однако было решено
выберите партию L2 для оценки влияния поверхностно-активного вещества на
среда растворения, рекомендованная Бразильской фармакопеей (полисорбат
80 2.0%) в разных концентрациях.
Рисунок 7.
Перекрытие L1, L2, L3, L4, L7 растворения
профилей и эталонного продукта (R) с использованием фармакопейных параметров (BF
5, 2010).
3.10.2.2.
Профиль растворения в калий-фосфатном буфере pH 7,4, содержащем различные
концентрации полисорбата 80
Кривые
профили растворения, содержащие различные концентрации полисорбата 80
полученные с таблетками партии L2 и Нисулидом ® проиллюстрированы на
Рисунок 8. Представленные результаты показывают снижение высвобождения лекарства по мере того, как
Представленные результаты показывают снижение высвобождения лекарства по мере того, как
снижена концентрация полисорбата 80. Всего оценено сурфактант
концентрации, тестируемый продукт и эталонный продукт оставались значениями
выше 85% в течение 15 минут, сохраняя классификацию очень быстрого растворения
и делая ненужным определение F2. Эффективность растворения
был рассчитан для сравнения профилей растворения. Произошло снижение DE
когда концентрация поверхностно-активного вещества постепенно удалялась из
среда растворения.Это произошло как для партии L2 (DE = 84,95; 82,21, так и
80. 41, соответственно с 2,0% полисорбатом, 1,0% и 0,5%), как для ссылки
продукта (ДЭ = 90,83; 90,53 и 87,05 в тех же условиях). Статистическая
анализ ANOVA показал, что профили растворения статистически
различны (p <0,05), и тест Тьюки показал, что в каждом состоянии
оценивается (полисорбат 80 2,0%, 1,0% и 0,5%) профиль растворения L2
партия статистически отличалась от эталонного продукта.Лаурил натрия
сульфат, присутствующий в составе, повысит процент этого
ПАВ в среде растворения не более 0,1%.
Рисунок 8.
Перекрытие профилей растворения партии L2.
и эталонный продукт (R) в калий-фосфатном буфере, pH 7,4, содержащий
различные концентрации поисорбата 80 (2,0%, 1,0% и 0,5%).
4. Обсуждение
Фармакопейные тесты, связанные с определением тяжелых металлов, потерями при сушке, сульфатной золой и дозированием, проведенные с образцами NM1, NM2 и NM3, были утверждены спецификациями Бразильской Фармакопеи 2010 (Таблица 1).Различия между дозированием партий галена (приблизительно 95%) и эталонного продукта (100,16%) связаны с ручным переносом высокого усилия сдвига для колеблющегося гранулятора и, следовательно, с псевдоожиженным слоем, процедурами, которые в промышленном масштабе происходят в автоматический способ.
Кривые ДСК для NM1, NM2 и NM3 показали единственное эндотермическое событие, близкое к 149 ° C (Рисунок 1). Оценка начала Т , пика Т и значений ∆H, полученных при разной скорости нагревания, показала несколько более низкие значения для микронизированных образцов (NM2 и NM3, около 110-120 Дж / г). Это явление широко описано в литературе, касающейся DSC 21 .
Это явление широко описано в литературе, касающейся DSC 21 .
В предыдущих исследованиях сообщалось о температуре плавления формы I НМ в диапазоне от 148,9 до 151,0 ° C и энтальпии (∆H) 102,97 Дж / г и 127,4 Дж / г -1 9,22,23 . В этих исследованиях использовались различные условия анализа друг друга и из этой работы, особенно в отношении продувочного газа, скорости нагрева и типов тиглей. Таким образом, хотя результаты очень близки к литературным данным, такие различия ограничивают более надежную корреляцию.
Исследование показало, что форма I НМ является наиболее термодинамически стабильной и имеет температуру перехода в диапазоне 144–147 ° C (∆H = 107,63 Дж / г) 7 . В противном случае полиморф II имеет эндотермическое событие при 140 ° C и претерпевает переход в полиморф I (точка плавления при 144 ° C и ∆H = 105,97 Дж / г) 6,7 . Кривые ДСК (рис. 1) всех образцов НМ показали аналогичное термическое поведение с полиморфом I.
Нет существенных различий между спектрами FTIR образцов NM1, NM2 и NM3, которые можно было бы использовать для различения полиморфов I и II.Были идентифицированы только характерные полосы нимесулида, поэтому, хотя этот метод часто используется для различения полиморфов, в этом случае он был безрезультатным 7,10 .
Порошковая дифракция рентгеновских лучей — это стандартный метод различения различных полиморфов. В случае нимесулида наблюдаются заметные различия в положении пика формы I (2θ = 17,15, 18,13, 19,34 и 21,66 °) и формы II (2θ = 18,91, 22,15 и 26,14 °) 6 . Кроме того, на дифрактограммах CSD наблюдаются пики при 2θ = 17.38, 18,38, 19,62 и 22,00 ° для формы I и 2θ = 19,10, 22,44 и 25,84 ° для формы II. Диаграммы XRPD проанализированных образцов нимесулида соответствуют форме I, хотя NM1 (немикронизированный образец) показал различия в интенсивности пиков (рис. 2). Кроме того, в литературе упоминается наличие предпочтительной ориентации при дифракции рентгеновских лучей образцов нимесулида, приводящей к пикам разной интенсивности, но всегда в одном и том же положении, что характеризует одно и то же кристаллическое расположение.
Обзор графиков распределения частиц по размерам (рис. 3) позволяет наблюдать присутствие более чем одной совокупности частиц с размерами частиц, что в первую очередь подтверждается микронизированными образцами (NM2 и NM3) ниже 1 мкМ, что представляет собой бимодальную кривую распределения. Часто микронизация вызывает трудности в получении хорошего диспергирования, связанного с когезионными межчастичными свойствами и электростатическими силами, создаваемыми частицами, которые подвергаются этому процессу. Немикронизированный образец NM1 имеет размер частиц менее 5 мкм, но менее значим по сравнению с размером частиц менее 1 мкм, обнаруженным в микронизированных образцах.
Во время разработки твердой лекарственной формы знание размера и распределения частиц по размеру может быть использовано для выбора процесса путем прямого прессования или влажного гранулирования. Результаты, полученные при лазерной дифракции, были использованы вместе с результатами оценки сыпучести, чтобы дополнить выбор способа производства таблеток нимесулида.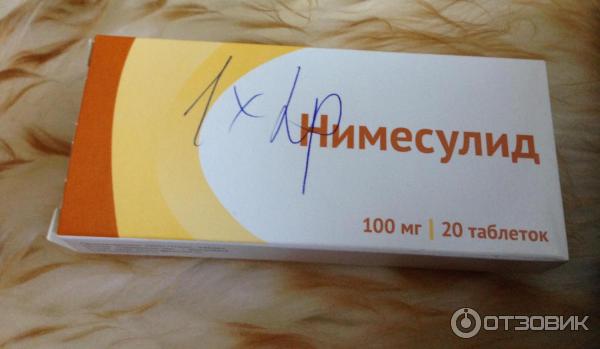
Данные, полученные с помощью SEM, подтвердили результаты распределения частиц по размерам с помощью лазерной дифракции, в которых образец NM1 также показал гораздо более высокие размеры частиц по сравнению с образцами NM2 и NM3 (Рисунок 4).Кроме того, присутствие совокупности частиц с размерами, близкими к 1 мкМ в образцах NM2 и NM3 и 5 мкм в образце NM1, наблюдаемое в распределении частиц по размерам с помощью лазерной дифракции, также наблюдалось в SEM. Изображение NM1, хотя и демонстрирует определенную изменчивость их морфологии, показывает удлиненные частицы. Изображения микронизированных образцов NM2 и NM3 показали наибольшее сходство в отношении размеров частиц, а также можно было наблюдать образование агрегатов (рис. 4B и C).
Результаты испытания на смачиваемость были близки к 80 ° (таблица 1), и, в соответствии с литературными данными, значения, близкие к 90 °, предсказывают плохую смачиваемость 24 . Хотя в литературе не представлены исследования с применением теста на смачиваемость нимесулидом, были проведены некоторые работы с другими препаратами, в которых результаты углов смачивания коррелировали с растворимостью в воде 25,26,27 .
Когда целью является разработка состава в виде таблеток, низкая растворимость лекарственного средства является аспектом, который отрицательно сказывается на его биодоступности.Тесты на растворимость порошка служили важным инструментом, дополняющим биофармацевтическую оценку образцов нимесулида. В литературе описаны некоторые исследования с использованием тестов на растворение порошка с образцами нимесулида, и результаты имеют определенную близость к результатам, полученным в этом исследовании 22,28 . Однако в упомянутых исследованиях использовались различные аналитические условия, особенно в отношении среды растворения и ротационного устройства, что ставит под угрозу результаты корреляции.
В отличие от результатов лазерной дифракции, которые показали очень небольшую разницу между NM2 и NM3, в растворении порошка эти образцы не продемонстрировали аналогичного поведения, что может быть подтверждено превосходными характеристиками NM3 по сравнению с NM2 (Рисунок 5). Немикронизированный образец (NM1) показал больший размер частиц по сравнению с микронизированными образцами, и, однако, при растворении порошка NM1 показал значения, близкие к NM2. Таким образом, следует учитывать другие факторы, влияющие на результаты растворения порошка, как наличие электростатического заряда и тенденцию к агломерации, которые могут повлиять на характеристики образца NM2.
Немикронизированный образец (NM1) показал больший размер частиц по сравнению с микронизированными образцами, и, однако, при растворении порошка NM1 показал значения, близкие к NM2. Таким образом, следует учитывать другие факторы, влияющие на результаты растворения порошка, как наличие электростатического заряда и тенденцию к агломерации, которые могут повлиять на характеристики образца NM2.
Также не удалось установить прямую связь результатов, полученных по смачиваемости, с результатами растворения порошка, потому что, как упоминалось выше, значения углов смачивания, обеспечиваемые образцами нимесулида, были очень близкими (Таблица 1).
Оценка текучести объединила результаты различных методов, чтобы сделать более полное понимание свойств текучести исследуемых образцов. Плотность, полученная для NM1, низкая (таблица 2), показала значения немного выше, чем у других образцов. В литературе приведены результаты по объемной плотности и плотности после утряски для образцов нимесулида, близкие к результатам немикронизированного NM1. Однако для плотности утряски в указанном исследовании использовался другой метод, что поставило под сомнение корреляцию с результатами, представленными здесь 13 .Более низкие значения плотности NM2 и NM3 можно объяснить эффектом процесса микронизации, который приводит к порошкам, имеющим большую адгезию между частицами и, следовательно, большую склонность к агломерации. В результате получается плохо текучий материал с низкой кажущейся плотностью.
Однако для плотности утряски в указанном исследовании использовался другой метод, что поставило под сомнение корреляцию с результатами, представленными здесь 13 .Более низкие значения плотности NM2 и NM3 можно объяснить эффектом процесса микронизации, который приводит к порошкам, имеющим большую адгезию между частицами и, следовательно, большую склонность к агломерации. В результате получается плохо текучий материал с низкой кажущейся плотностью.
Определение индекса сжимаемости и коэффициента Хауснера показало, что все образцы не обладали хорошими свойствами текучести (таблица 2). Учитывая, что более высокие значения индекса сжимаемости и коэффициента Хауснера указывают на более сильные межчастичные взаимодействия и нежелательные характеристики потока 29 , можно ожидать, что микронизированные образцы NM2 и NM3 будут демонстрировать худшие результаты текучести.Однако они показали лучшую текучесть, чем у образца NM1 (немикронизированного).
Одно из возможных объяснений расхождений между результатами, полученными при различных оценках текучести, заключается в качественной шкале классификации свойств текучести, принятой официальными сборниками, например, Фармакопеей США. Таким образом, параметры CI и HR имеют низкую дискриминационную способность, особенно для образцов с плохим потоком.
Таким образом, параметры CI и HR имеют низкую дискриминационную способность, особенно для образцов с плохим потоком.
Испытания на угол естественного откоса и на проходное отверстие проводились на одном и том же оборудовании.Испытания с образцами NM1, NM2 и NM3 проводились с использованием следующих отверстий воронки 10, 15 и 25 мм. Однако никакого потока обнаружено не было. Затем было использовано отверстие 15 мм и протестированы четыре (4) скорости, доступные на машине (1, 2, 3 и 4). Образец NM1 показал текучесть со скоростью 1 (один), но для образцов NM2 и NM3 необходимо было использовать скорость 4, максимально разрешенную оборудованием. Различные экспериментальные условия так или иначе вызывают обсуждение результатов. Тем не менее, можно сделать некоторые соображения относительно свойств текучести исследуемых образцов.
Результаты подтвердили оценку плохого потока для этого API, ранее предоставленную другими тестами. Кроме того, также можно проверить, что воспроизводимость результатов тестов, выполненных в трех повторностях, не наблюдалась.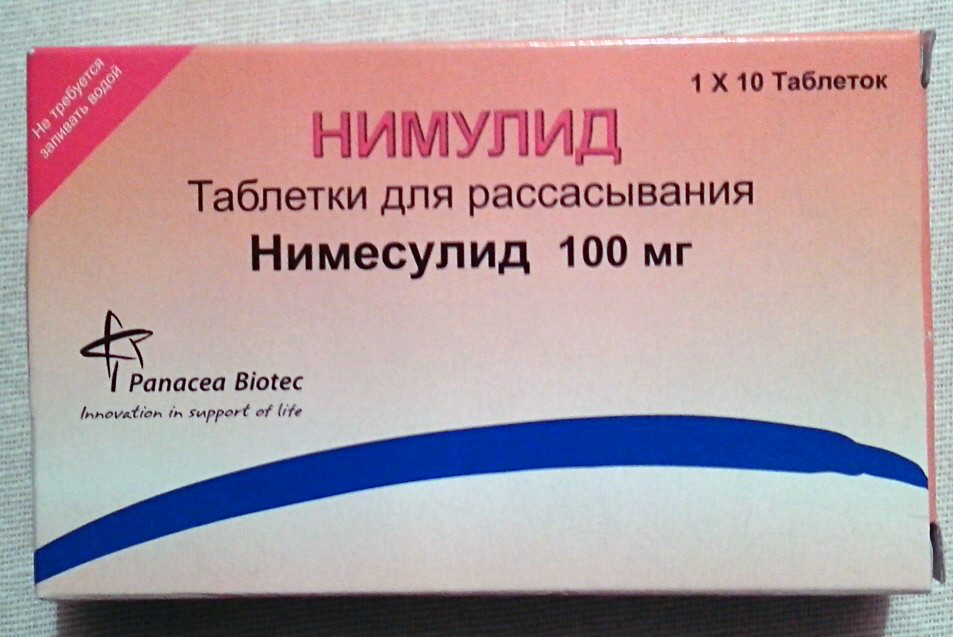 NM1, немикронизированный, показал превосходные свойства текучести по сравнению с другими образцами. Также возможно назначить худший поток для образца NM3, который также показал менее однородное поведение (Рисунок 6).
NM1, немикронизированный, показал превосходные свойства текучести по сравнению с другими образцами. Также возможно назначить худший поток для образца NM3, который также показал менее однородное поведение (Рисунок 6).
В целом, все образцы показали неустойчивое поведение потока, что указывает на то, что нестабильный процесс образования и разрушения дуги доминирует над процессом потока.Об этом процессе также свидетельствует стандарт в «ступенях», где скорость потока порошка периодически увеличивается, вероятно, из-за разрушения образовавшегося аргона.
Известно, что процесс микронизации способствует увеличению электростатического заряда. Таким образом, образцы NM2 и NM3 обладают двумя важными свойствами, которые способствуют плохой текучести: частицы низкой плотности и, предположительно, высокий электростатический заряд. К сожалению, для этой работы не удалось оценить электростатическую плотность.
Результаты, полученные в ходе испытаний по оценке расхода, позволяют идентифицировать расхождение между определениями CI и HR и расхода через отверстие.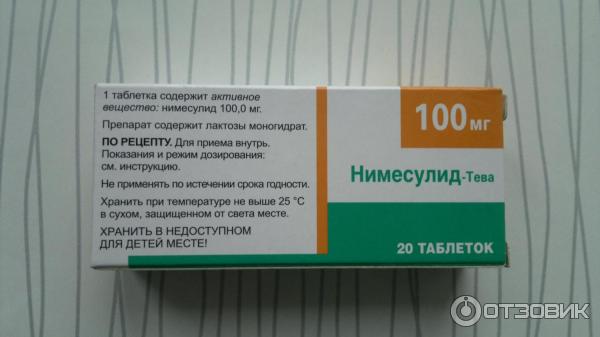 Поток через отверстие давал более реалистичные результаты, численно демонстрируя характеристику плохого потока для нимесулида. Как упоминалось выше, значения HR и CI не могут быть дискриминационными и могут привести к получению нереальных результатов для порошков, которые особенно характеризуются плохой текучестью. Кроме того, образцы NM1, NM2 и NM3 имеют размеры частиц, которые считаются небольшими (<80 мкМ), помимо низких значений плотности, которые являются факторами, связанными с высокой когезией его частиц.Таким образом, понятно, что методы оценки потока могут иметь противоречивые результаты.
Поток через отверстие давал более реалистичные результаты, численно демонстрируя характеристику плохого потока для нимесулида. Как упоминалось выше, значения HR и CI не могут быть дискриминационными и могут привести к получению нереальных результатов для порошков, которые особенно характеризуются плохой текучестью. Кроме того, образцы NM1, NM2 и NM3 имеют размеры частиц, которые считаются небольшими (<80 мкМ), помимо низких значений плотности, которые являются факторами, связанными с высокой когезией его частиц.Таким образом, понятно, что методы оценки потока могут иметь противоречивые результаты.
На основании результатов, представленных в оценках сыпучести, гранулометрического состава и SEM, и с учетом цели разработки твердой лекарственной формы, процесс прямого прессования становится менее подходящим, чем влажное гранулирование, из-за высокой вероятности проблем, связанных с поток в бункере и недостаточное заполнение фильеры, что способствует, как следствие, неравномерности массы и содержимого.
Средние значения веса, найденные для партий галеновых кислот, близки к среднему весу, отображаемому для эталонного продукта (около 400 мг), и все результаты были удовлетворительными. Результаты твердости таблеток, полученные для галеновых партий, показали корреляцию с показателями хрупкости, в которых партии L2, L3, L5, L6 и L7 показали самые низкие значения твердости (около 5,0 кгс) и более высокие значения хрупкости (около 0,42%). и таблетки, полученные с партиями галеновых кислот L1 и L4, продемонстрировали более высокую прочность на разрыв (твердость около 7.0 кгс) и истирание (процент рыхлости около 0,35%).
Партии
L2 и L3 имеют одинаковый состав и один и тот же процесс, только изменив производителя API (Таблица 3). Различия в результатах по размеру частиц и твердости не были значительными, что исключает прямую корреляцию между этими испытаниями.
Партия L4 имеет те же качественные и количественные вспомогательные вещества, которые могут влиять на сжимаемость из партий L2 и L3, но показали более высокую твердость (среднее значение = 7. 1 кгс). Разница заключалась в процессе гранулирования (таблица 3), включая более длительное время для добавления гранулирующего раствора и более длительную смесь для партии L4. Возможно, эти изменения процесса позволяют адекватно смачивать порошки, что приводит к более прочным гранулам и, следовательно, к более длительному времени дезинтеграции и более медленному растворению по сравнению со значениями, показанными для партий L2 и L3.
1 кгс). Разница заключалась в процессе гранулирования (таблица 3), включая более длительное время для добавления гранулирующего раствора и более длительную смесь для партии L4. Возможно, эти изменения процесса позволяют адекватно смачивать порошки, что приводит к более прочным гранулам и, следовательно, к более длительному времени дезинтеграции и более медленному растворению по сравнению со значениями, показанными для партий L2 и L3.
Что касается теста на дезинтеграцию, партия L1 имеет тот же качественный состав, что и L2 и L3, но поверхностно-активное вещество (лаурилсульфат натрия) использовалось по-разному.L1 показал самые высокие значения твердости (7,5 кгс). Эти различия оказали отрицательное влияние на дезинтеграцию таблеток, полученных с этой партией (L1 = 6 футов 40 дюймов), время дезинтеграции которых было в два раза больше, чем у партий L2 и L3 (L2 = 3 фута 18 дюймов и L3 = 3 фута 10 дюймов) ). В партии L4 использовалось другое поверхностно-активное вещество (докузат натрия), и время его распада (4 ’10 дюймов) было выше, чем в партиях L2 и L3.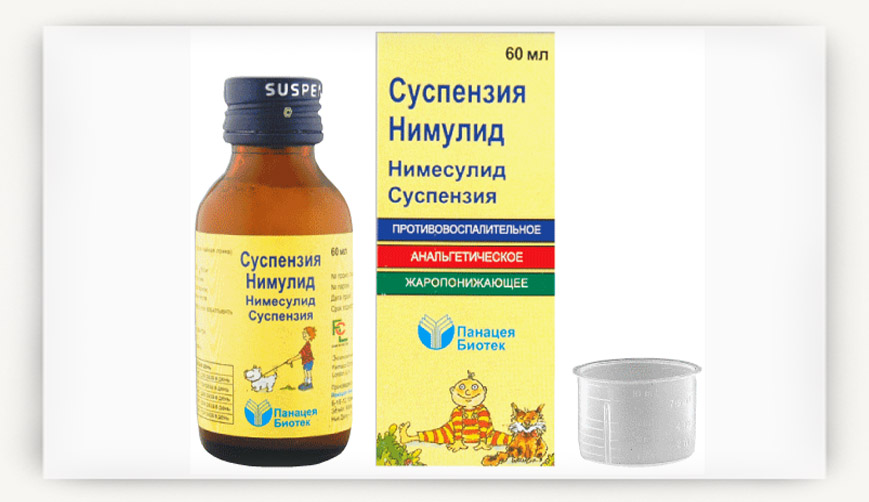 Композиции L5 и L6 качественно наиболее близки к эталонному продукту, но показали более длительное время распада, и L6 в этом анализе не был одобрен (L5 = 9 ’30 дюймов и L6 = более 30’).Очевидно, это не может приписывать сходство или различие, не зная о процентном содержании каждого агента в рецептуре эталонного продукта. В партии галеновой кислоты L7 использовалось другое связующее и поверхностно-активное вещество, и она имела самое короткое время распада (1 ’23 дюйма). Что касается Nisulid®, таблетка имеет выпуклый формат, что способствует поддержанию устойчивости к истиранию, наблюдаемой по низкой рыхлости (0,27%), хотя ее твердость ниже (4,9 кгс) по сравнению с партией галеновой кислоты. Время распада эталонного продукта составляло 1 ’15”.
Композиции L5 и L6 качественно наиболее близки к эталонному продукту, но показали более длительное время распада, и L6 в этом анализе не был одобрен (L5 = 9 ’30 дюймов и L6 = более 30’).Очевидно, это не может приписывать сходство или различие, не зная о процентном содержании каждого агента в рецептуре эталонного продукта. В партии галеновой кислоты L7 использовалось другое связующее и поверхностно-активное вещество, и она имела самое короткое время распада (1 ’23 дюйма). Что касается Nisulid®, таблетка имеет выпуклый формат, что способствует поддержанию устойчивости к истиранию, наблюдаемой по низкой рыхлости (0,27%), хотя ее твердость ниже (4,9 кгс) по сравнению с партией галеновой кислоты. Время распада эталонного продукта составляло 1 ’15”.
Соответственно, можно сделать вывод, что стадия добавления поверхностно-активного вещества в состав, а также твердость таблетки напрямую изменяют время распадаемости и, следовательно, могут использоваться в качестве вспомогательных инструментов для различения составов нимесулида.
При анализе дозировки все партии галеновых кислот показали результаты, близкие к 95% от указанного значения, а для таблеток Nisulid ® было получено 100,2%. Все результаты соответствуют спецификации, установленной в Бразильской фармакопее.
Профили растворения, достигнутые в условиях фармакопеи, продемонстрировали, что составы серий L2 и L3 и контрольный продукт показали очень быстрое растворение с результатами, когда количество растворенного лекарственного средства превышало 85% за 15 минут, и, таким образом, значение F2 теряет свое различительное значение. .
Принимая во внимание, что партии L2 и L3 представляют собой составы, которые различаются только производителем API, интересно сопоставить результаты, полученные в профиле растворения, и данные, полученные при характеристике API, в частности, в оценке размера частиц, смачиваемости и растворения порошка.Результаты анализа размера частиц с помощью лазерной дифракции и смачиваемости были довольно близкими. Однако при растворении порошка NM3 показал растворение примерно на 10% выше, чем NM2, и, кроме того, такие профили показали статистически значимые различия (p <0,05). Хотя биофармацевтические свойства NM3 были выше, чем наблюдаемые с NM2, рецептурный продукт L2 и L3 показал результаты, близкие к растворению, и статистический анализ значений ED показал сходство между этими профилями (p> 0.05).
Однако при растворении порошка NM3 показал растворение примерно на 10% выше, чем NM2, и, кроме того, такие профили показали статистически значимые различия (p <0,05). Хотя биофармацевтические свойства NM3 были выше, чем наблюдаемые с NM2, рецептурный продукт L2 и L3 показал результаты, близкие к растворению, и статистический анализ значений ED показал сходство между этими профилями (p> 0.05).
Были рассчитаны значения эффективности растворения, и партия L2 дала наивысший результат (DE = 84,95), хотя и довольно близко к значению, представленному L3 (DE = 84,02). L4 и L7 показали следующие значения (L4 = 80,92 и L7 = 79,67), а партия L1 показала самое низкое значение DE (76,61). Значения DE были подвергнуты статистическому анализу с помощью дисперсионного анализа и теста Тьюки, и было обнаружено, что все составы партий галеновых соединений и Нисулид ® значительно различаются (p <0,05), а партии L2 и L3 не представляют значительных различий между значениями DE (р> 0. 05). Партия L4 показала профиль растворения, аналогичный профилям L2 и L3, но с более низкими средними значениями растворения, и, особенно через 15 минут, не было достигнуто 85% (хотя оно было близким), что приводит к классификации как быстро растворяющееся. рецептура, отличная от той, что представлена Nisulid ® и партиями L2 и L3. Как и в случае с L4, L7 не достиг 85% высвобождения лекарственного средства в течение 15 минут, несмотря на очень близкое поведение (фиг. 7), и он также классифицируется как быстро растворяющийся состав.
05). Партия L4 показала профиль растворения, аналогичный профилям L2 и L3, но с более низкими средними значениями растворения, и, особенно через 15 минут, не было достигнуто 85% (хотя оно было близким), что приводит к классификации как быстро растворяющееся. рецептура, отличная от той, что представлена Nisulid ® и партиями L2 и L3. Как и в случае с L4, L7 не достиг 85% высвобождения лекарственного средства в течение 15 минут, несмотря на очень близкое поведение (фиг. 7), и он также классифицируется как быстро растворяющийся состав.
Интересная особенность профиля растворения L7 заключается в результате, полученном при первом отборе пробы, который почти на 10% превосходит результат, полученный с L3. Одним из возможных объяснений является двойная природа прежелатинизированного крахмала, который действует не только как связующее, но и как разрыхлитель, что может максимизировать высвобождение API в это начальное время. Результат анализа дезинтеграции (83 с) подтверждает эту гипотезу, учитывая наименьшее показанное время.
Хотя статистический анализ показал, что значения DE для партий L2, L3 и L4 существенно не различаются (p> 0,05), было решено выбрать партию L2 для дополнительных испытаний. Даже если L2 показал наибольшее растворение значений, существует значительная разница между L2 и эталонным продуктом в первые времена отбора проб (t = 5 мин и t = 10 мин).
Что касается биоэквивалентности, в литературе сообщается, что нимесулид быстро всасывается при пероральном приеме. 2 .В бразильском исследовании оценивалась биоэквивалентность таблеток нимесулида и Нисулида ® , и были обнаружены значения C max , эквивалентные 5,30 и 4,52 нг / мл -1 и Tmax 2,23 и 3,32 часа, соответственно, для эталона и теста. товары 30 .
Анализируя такие данные из литературы и на основе оценок растворения, разработанных для моделирования физиологических условий и предоставленных инструментов для оценки биодоступности in vitro, оценка C max и T max не будет представлять проблем биоэквивалентности. Это связано с тем, что через 45 мин (меньшее время для достижения C max , чем указано в литературе) партия L2 и эталонный продукт уже достигают того же процента растворения; таким образом, ожидается одинаковое высвобождение лекарственного средства (тестируемого и эталонного) in vivo.
Это связано с тем, что через 45 мин (меньшее время для достижения C max , чем указано в литературе) партия L2 и эталонный продукт уже достигают того же процента растворения; таким образом, ожидается одинаковое высвобождение лекарственного средства (тестируемого и эталонного) in vivo.
Параметр AUC требует более тщательного анализа. В другом исследовании упоминалось исследование биоэквивалентности нимесулида, которое показало неодобренные результаты, ранее одобренные в отношении фармацевтической эквивалентности, что усиливает осторожность в отношении интерпретации результатов профилей растворения этого лекарственного средства 31 .Принимая во внимание, что нимесулид является лекарством класса II в BCS, растворение которого является ограничивающим этапом для абсорбции, становится обязательным тщательный дизайн теста на растворение.
Таким образом, даже если среда предварительно конизируется Бразильской Фармакопеей и содержит 2,0% полисорбата 80 4 , считалось важным оценить поведение партии L2 с использованием того же калиевого фосфатного буфера, установленного для Бразильской Фармакопеи, но содержащего разные концентрации поверхностно-активного вещества.
Представленные результаты показывают снижение количества высвобождаемого лекарственного средства по мере снижения концентрации полисорбата 80. Тем не менее, во всех оцененных концентрациях поверхностно-активного вещества значения теста и эталонного продукта оставались выше 85% в течение 15 минут, поддерживая классификацию очень быстрого растворения и делая ненужным расчет F2. Однако эффективность растворения была рассчитана как инструмент для сравнения профилей растворения. Опять же, наблюдалось уменьшение полученных значений DE по мере постепенного снижения концентрации поверхностно-активного вещества в среде растворения.Это произошло как для партии L2, так и для эталонного продукта. Статистический анализ с помощью дисперсионного анализа показал, что профили растворения статистически различаются (p <0,05), а тест Тьюки показал, что в каждом оцениваемом состоянии (2,0%, 1,0% и 0,5% полисорбат 80) профиль растворения партии L2 статистически отличается от профиля растворения. эталонный продукт.
В литературе сообщается об исследовании, оценивающем профиль растворения таблеток нимесулида в среде фосфатного буфера pH 7.4, содержащий полисорбат 80 в различных концентрациях. Наибольшее значение высвобождения было в присутствии 2,5% поверхностно-активного вещества, при котором растворение составляло около 90% за 60 мин. 21 . Другое исследование, оценивающее растворение коммерческих таблеток нимесулида в натрий-фосфатном буфере pH 7,4 с добавлением 1,0% полисорбата 80, не показало значений выше 90% за 60 мин. 15 .
Поскольку оба исследования не предоставляют информации о составе тестируемого продукта, различия результатов, обнаруженные по сравнению с показанными здесь, могут быть связаны с возможными различиями в составах, учитывая, что вспомогательные вещества могут действовать в прямом режиме в процессе растворения.В дополнение к важному вкладу наполнителей в скорость и степень растворения, такие аспекты, как, например, размер частиц API, являются поразительными особенностями растворения твердых лекарственных форм. Эти физико-химические свойства не были доступны в указанной работе, что ограничивает дальнейшее обсуждение.
Эти физико-химические свойства не были доступны в указанной работе, что ограничивает дальнейшее обсуждение.
Тесты на растворение in vitro используются для контроля качества лекарственных средств и разработки новых рецептур. В зависимости от класса лекарственного средства, такого как нимесулид (класс II в BCS), результаты исследования растворения могут быть тесно связаны с показателями in vivo.Для этих лекарств постоянно возникают трудности с выбором среды растворения, которая должна воспроизводить физиологические условия, чтобы гарантировать корреляцию in vitro-in vivo и различать различные составы 28 .
5. Выводы
Дифференциальная сканирующая калориметрия и дифракция рентгеновских лучей показали, что все испытанные образцы (NM1, NM2 и NM3) имели полиморф I. Определение размера частиц показало хорошую корреляцию с результатами измерения плотности и потока через отверстие, в котором микронизированные образцы показали худшие характеристики потока. по сравнению с немикронизированным образцом. Сканирующая электронная микроскопия подтвердила результаты определения размеров и распределения частиц по размерам, полученные с помощью лазерной дифракции.
Сканирующая электронная микроскопия подтвердила результаты определения размеров и распределения частиц по размерам, полученные с помощью лазерной дифракции.
Хотя результаты смачиваемости были очень близкими, растворение порошка выявило небольшие различия между образцами, демонстрируя, что растворение образца NM3 (микронизированного) превосходило другие. Микронизированные образцы показали более высокий IDR, чем немикронизированные (NM1), и в этом случае могут быть задействованы такие свойства поверхности, как шероховатость и микроструктурные факторы.
Хотя результаты показали снижение высвобождения лекарственного средства по мере снижения концентрации поверхностно-активного вещества в среде растворения обоих продуктов (тестируемого и эталонного), была сохранена их классификация как состав с очень быстрым растворением. Партия L2 была выбрана для дальнейшей работы по регистрации продукта.
6. Список литературы
[1] Рейнсфорд, К. Д., Текущее состояние терапевтического использования и действия предпочтительного НПВП циклооксигеназы-2, нимесулида, Inflammopharmacology 14 (3-4) (2006) 120-37. https://doi.org/10.1007/s10787-006-1505-9.
https://doi.org/10.1007/s10787-006-1505-9.
[2] Сингла А. К., Чавла М., Сингх А. Обзор Нимесулида: некоторые фармацевтические и фармакологические аспекты — обновленная информация, J. Pharm. Pharmacol. 52 (5) (2000) 467-486. https://doi.org/10.1211/0022357001774255.
[3] Мирчиу, И., Анюта, В., Мирон, Д., Кожокару, В., Орбестяну, А.М., Мирчиу, К., Растворение in vitro малорастворимых лекарств в присутствии поверхностно-активных веществ — in vivo фармакокинетические корреляции. II. Нимесулид, Farmacia 61 (1) (2013) 88-102.http://www.revistafarmacia.ro/201301/issue12013art09.html.
[4] Farmacopeia Brasileira, 5-е изд. Бразилиа: Национальная агония санитарии; 2010.
[5] Ди Мартино, П., Цензи, Р., Бартелеми, К., Гобетто, Р., Джойрис, Э., Масич, А., Оду, П., Мартелли, С., Характеристика и поведение уплотнения Кристаллические формы нимесулида, Int. J. Pharm. 342 (1-2) (2007) 137-44. https://doi.org/10.1016/j.ijpharm.2007.05.009.
[6] Бергезе П., Бонтемпи Э. , Коломбо И., Гервасони Д., Деперо Л. Е. Исследование микроструктуры композитов нимесулид-кросповидон с помощью дифракции рентгеновских лучей и термического анализа, Compos. Sci. Technol. 63 (8) (2003) 1197-1201. https://doi.org/10.1016/S0266-3538(03)00078-2.
, Коломбо И., Гервасони Д., Деперо Л. Е. Исследование микроструктуры композитов нимесулид-кросповидон с помощью дифракции рентгеновских лучей и термического анализа, Compos. Sci. Technol. 63 (8) (2003) 1197-1201. https://doi.org/10.1016/S0266-3538(03)00078-2.
[7] Санфуи, П., Сарма, Б., Нангиа, А., Фазовое превращение в конформационных полиморфах нимесулида, J. Pharm. Sci. 100 (6) (2011) 2287-2299. https://doi.org/10.1002/jps.22464.
[8] Абделькадер, Х., Абдаллах, О. Ю., Салем, Х. С., Сравнение влияния трометамина и поливинилпирролидона на свойства растворения и анальгетический эффект нимесулида, AAPS PharmSciTech 8 (3) (2007) E110 – E117.https://doi.org/10.1208/pt0803065.
[9] Данту, А.С., Дурай, Р.В., Хари, Б.Н.В., Эффект измельчения при ударе и истирании на нимесулид для повышения растворимости, Int. J. App. Pharm. 5 (2) (2003) 1-7.
[10] Paiva, REF, Abbehausen, C., Gomes, AF, Gozzo, FC, Lustri, WR, Formiga, ALB, Corbi, PP, Synthesis, спектроскопические характеристики, исследования DFT и антибактериальные тесты нового серебра (I) комплекс с противовоспалительным нимесулидом, Polyhedron 36 (1) (2012) 112-119. https://doi.org/10.1016/j.poly.2012.02.002.
https://doi.org/10.1016/j.poly.2012.02.002.
[11] Агравал, С., Ашокрадж, Ю., Бхаратам, П. В., Пиллай, О., Панчагнула, Р., Твердотельная характеристика образцов рифампицина и его биофармацевтическая значимость, Eur. J. Pharm. Sci. 22 (2-3) (2004) 127-144. https://doi.org/10.1016/j.ejps.2004.02.011.
[12] Онорио, Т.С., Пинто, ЕС, Роча, HV, Эстевес, В.С., душ Сантуш, Т.С., Кастро, ХК, Родригес, К.Р., де Соуза, В.П., Кабрал, Л.М., Корреляция эфавиренца in vitro – in vivo таблетки с использованием GastroPlus®, AAPS PharmSciTech.14 (3) (2014) 1244–1254. https://doi.org/10.1208/s12249-013-0016-4.
[13] Дебна, С., Сурьянараян, Р., Влияние фазовых превращений, вызванных обработкой, на растворение таблеток теофиллина, AAPS PharmSciTech. 5 (1) (2004) 1-11. https://doi.org/10.1208/pt050108.
[14] Пуркару, С.О., Ионеску, М., Ранети, С., Анута, В., Мирчиу, И., Белу, И., Исследование высвобождения нимесулида из твердых фармацевтических составов в растворах твин-80, Curr. Health Sci. J. 36 (1) (2010) 42-49.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3945268/.
[15] Руэлла, А. Л. М., Араужу, М. Б., Перейра, Г., Desenvolvimento de um teste de dissolução para comprimidos de nimesulida em meio que Assegure condições раковина, лат. Являюсь. J. Pharm. 28 (5) (2009) 661-667. http://www.latamjpharm.org/trabajos/28/5/LAJOP_28_5_1_3_5K6E9AQ727.pdf.
[16] Хетал, Т., Биндеш, П., Снеха, Т., Обзор методов повышения пероральной биодоступности лекарственных средств, Int. J. Pharm. Sci. Rev. Res. 4 (3) (2010) 203-223.https://pdfs.semanticscholar.org/0dd6/cc180bdabeab5bc627dcbbff2567735f494f.pdf.
[17] Джоши, Дж. Т., Обзор методов микронизации, J. Pharm. Sci. Technol. 3 (7) (2011) 651-681. http://www.onlinepharmacytech.info/docs/vol3issue8/JPST11-03-08-02.pdf.
[18] Фармакопея США. 36-я редакция: национальный формуляр. Вашингтон, округ Колумбия: Роквилл: Фармакопейная конвенция США, 2013 г. 31-е изд., 2013 г. ISBN: 9781936424122 1936424126.
[19] Аллен, Ф.Х., Кембриджская база данных структур: четверть миллиона кристаллических структур и рост, Acta Cryst. В (58) (2002) 380-388. https://doi.org/10.1107/S0108768102003890.
[20] Макрэ, К.Ф., Бруно, И.Дж., Чисхолм, Дж. А., Эджингтон, П.Р., МакКейб, П., Пидкок, Э., Родригес-Монж, Л., Тейлор, Р., ван де Стрик, Дж., Вуд , PA, Mercury CSD 2.0 — новые возможности для визуализации и исследования кристаллических структур, J. Appl. Cryst. 41 (2008) 466-470. https://doi.org/10.1107/S0021889807067908.
[21] Нг, В. К., Квек, Дж. В., Юэн, А., Тан, К. Л., Тан, Р., Влияние измельчения на термограмму ДСК адипиновой кислоты наполнителя, AAPS PharmSciTech 11 (1) (2010) 159-167. https://doi.org/10.1208/s12249-009-9372-5.
[22] Moneghini, M., Kikic, I., Perissutti, B., Franceschinis, E., Cortesi, A., Характеристика систем нимесулид – бетациклодекстрины, полученных пропиткой жидкостью в сверхкритическом состоянии, Eur. J. Pharm. Биофарм. 58 (2004) 637-644. https://doi.org/10.1016/j.ejpb.2004.04.004.
[23] Пайва, REF, Аббехаузен, К., Бергамини, Ф., Томпсон, А., Антонини, А.Д., Ланселотти, М., Корби, П.П., Исследование включения комплекса Ag (I) -нимесулид в β -циклодекстрин: исследования в растворе и в твердом состоянии, J. Inc. Phenom. Макроцикл. Chem. 79 (1-2) (2014) 225-235. https://doi.org/10.1007/s10847-013-0348-4.
[24] Balasuwatthi, P., Dechabumphen, N., Saiwan, C., Scamehorn, J. F., Краевой угол смачивания растворов поверхностно-активных веществ на осажденных поверхностях поверхностно-активных веществ.II. Влияние структуры поверхностно-активного вещества, присутствия ненасыщенного поверхностно-активного вещества, pH и соотношения противоион / поверхностно-активное вещество, J. Surf. Deterg. 7 (1) (2004) 31-40. https://doi.org/10.1007/s11743-004-0285-y.
[25] Пури, В., Дантулури, А. К., Кумар, М., Карар, Н., Бансал, А. К., Смачиваемость и химия поверхности кристаллических и аморфных форм плохо растворимого в воде лекарственного средства, Eur. J. Pharm. Sci. 40 (2-12) (2010) 84-93. https://doi.org/10.1016/j.ejps.2010.03.003.
[26] Шете, Г., Пури, В., Кумар, Л., Бансал, А. К., Характеристика твердого состояния коммерческих образцов кристаллического и аморфного аторвастатина кальция, AAPS PharmSciTech 11 (2) (2010) 598-609. https://doi.org/10.1208/s12249-010-9419-7.
[27] Видаль, Н. Л. Г., Кастро, С. Г., Бруни, С. Ф. С., Аллеманди, Д. А., Пальма, С. Д., Твердые дисперсии альбендазола: влияние состава среды растворения на высвобождение лекарственного средства in vitro, Дис. Technol. (2014) 42-47. https://doi.org/10.14227/DT210214P42.
[28] Парк С.Х., Чой Х. К., Влияние поверхностно-активных веществ на профили растворения слаборастворимых в воде кислотных лекарственных средств, Int. J. Pharm. 32 (1-2) (2006) 35-41. https://doi.org/10.1016/j.ijpharm.2006.05.004.
[29] Шах, Р. Б., Таваккул, М. А., Хан, М. А., Сравнительная оценка текучести фармацевтических порошков и гранул, AAPS PharmSciTech 9 (1) (2008) 250-258. https://doi.org/10.1208/s12249-008-9046-8.
[30] Ригато, Х. М., Борхес, Б. К., Свердлов, К. Э., Морено, Р. А., Орпинели, Э., Borges, N.C., Биодоступность двух пероральных суспензий и двух пероральных таблеток нимесулида 100 мг у здоровых взрослых бразильских субъектов, Int. J. Clin. Pharm. Ther. 48 (3) (2010) 233-242. https://europepmc.org/abstract/med/20197019.
[31] Постали, М., Estudo de bioequivalência — предложение um modelo animal em ratos para avaliação preditiva da biodisponibilidade de formulações Consundo nimesulida em humanos. [диссертация]. Толедо (Южная Каролина): Федеральный университет Санта-Катарины; 2011 г.
Заметки автора
Фонд Освальдо Круза (Fiocruz), Технологический институт по наркотикам, 4365 Brasil Av., Manguinhos, Рио-де-Жанейро, Бразилия
Автор для переписки: Хельвесио Винисиус Антунес Роча, адрес электронной почты: [email protected]
Освальдо Крус
Фонд (Fiocruz), Технологический институт лекарств, 4365 Brasil Av., Manguinhos,
Рио-де-Жанейро, Бразилия
Освальдо Крус
Фонд (Fiocruz), Технологический институт лекарств, 4365 Brasil Av., Мангуиньос,
Рио-де-Жанейро, Бразилия
Освальдо Крус
Фонд (Fiocruz), Технологический институт лекарств, 4365 Brasil Av., Manguinhos,
Рио-де-Жанейро, Бразилия
Нимесулид должен быть отменен во всем мире из-за серьезного повреждения печени
Нимесулид должен быть отменен во всем мире из-за серьезного повреждения печени
Нимесулид подвергает пациентов смертельному поражению печени. Когда требуется нестероидный противовоспалительный препарат, лучше использовать препарат с благоприятным соотношением пользы и вреда, такой как ибупрофен.Власти ЕС не в состоянии защитить потребителей.
Международное общество бюллетеней по лекарственным средствам (ISDB) считает недопустимым, что нимесулиду было разрешено оставаться на европейских и некоторых других рынках мира. Этот нестероидный противовоспалительный препарат (НПВП) не предлагает терапевтических преимуществ или лучшей желудочно-кишечной безопасности по сравнению с другими НПВП, тогда как он подвергает пациентов более высокому риску смертельных заболеваний печени.
Нимесулид никогда не одобрялся для использования в таких странах, как США, Великобритания, Канада, Австралия, Новая Зеландия, Япония и другие страны из-за опасений по поводу его профиля безопасности.
В 2002 году Финляндия и Испания отозвали нимесулид с рынка после сообщений о серьезном повреждении печени. В то время во Франции также были зарегистрированы случаи, в том числе 2 смертельных случая. Ирландия и Сингапур решили вывести нимесулид с рынка в 2007 году.
Европейское агентство по лекарственным средствам подтвердило риски для печени, связанные с нимесулидом в 2007 году, но лишь ограничило продолжительность лечения, в результате чего пациенты подвергаются неоправданному смертельному риску. Эти нерешительные меры тем более неприемлемы, поскольку многие другие доступные НПВП столь же эффективны и менее опасны.
Как большинство докладчиков стран-членов ЕС, проводивших повторную оценку нимесулида, пришли к выводу, что продукт должен оставаться на рынке? Почему между странами-членами ЕС такая непоследовательность?
Комитет по лекарственным средствам для человека (CHMP) оценил вред, причиненный нимесулидом, в полной секретности, и для органов здравоохранения ЕС совершенно неприемлемо решение ограничивать только продолжительность использования без объяснения причин этого решения.
Нежелание Комиссии ЕС отозвать нимесулид приводит к тому, что гражданам ЕС неоправданно причиняется предотвратимый вред.
Нимесулид должен быть запрещен в Европейском Союзе и во всем мире.
The International Society of Drug Bulletins
| ISDB — это всемирная сеть бюллетеней и журналов по лекарствам и терапевтическим средствам, которые финансово и интеллектуально независимы от фармацевтической промышленности. Дополнительная информация: www.isdbweb.org |
| Следующие члены внесли свой вклад в этот пресс-релиз: | |
| AIS-Никарагуа (Никарагуа) Эндрю Херксхаймер (бывший президент ISDB) arznei-telegramm (Германия) Bilten O lijekovima & Pharmaca (Хорватия) BODHI (Индия) Boletin Farmacos (Аргентина) Bulletin Médicament et de Pharmacovigilance (Франция) Bulletins d’Informations de Pharmacologie (Франция) Butlleti Groc (Испания) DER ARZNEIMITTELBRIEF (Германия) Dialogo sui farmaci (Италия) Информационный бюллетень DIC (Индия) (Центр лекарственной информации Национального университета) Колумбия) Farmakon / Slovensko Farmacevtsko Društvo (Словения) Farmakoterapeutické Informace (Чешская Республика) Geneesmiddelenbulletin (Нидерланды) | Gute Pillen Schlechte Pillen (Германия) Informazioni sui farmaci (Италия) Kusuri-no-Check (Япония) La Lettre du GRAS (Бельгия) La revue Prescrire (Франция) MEDEX, DrugInfo (Молдова) PHARMA Drug Bulletin ( Израиль) Pharma-Brief (Германия) Pharmaflash (Швейцария) Pharmakon (Испания) Pharma-kritik (Швейцария) Бельгийский центр фармакотерапевтической информации (BCFI) (Бельгия) The Informed Prescriber (Япония) Worst Pills, Новости Best Pills / худшие таблетки.org (США) Healthy Skepticism Inc (Австралия) Información Farmacoterapéutica de la Comarca / Boletín INFAC (Испания) |
нимесулид — Drugs.com
Исходный документ заархивирован. Мы не можем подтвердить полноту, точность и актуальность содержания.
В некоторых странах это лекарство может быть одобрено только для ветеринарного применения.
Scheme
Rec.INN
ATC (Анатомо-терапевтическая химическая классификация)
M01AX17
Регистрационный номер CAS (Chemical Abstracts Service)
0051803-78-2
Химическая формула
C13-h22 -S
Молекулярный вес
308
Терапевтические категории
Анальгетик, жаропонижающее и противовоспалительное средство
Нестероидный противовоспалительный препарат, НПВП
Химическое название
Метансульфонамид, N- (4-нитро -феноксифенил) —
Иностранные названия
- Нимесулид (латиница)
- Нимесулид (немецкий)
- Нимесулид (французский)
- Нимесулида (испанский)
AN 912ANJIT
Торговые марки
- Абилид-П [+ парацетамол]
ABL Lifecare, Индия - Abinim-P [+ Paracetamol]
Alpic Biotech, Индия - Abinim-T [+ Тизанидин]
Alpic Biotech, Индия - Abiser-N [+ серрапептаза]
ABL Lifecare, Индия - Ab-Nip [+ парацетамол]
Am.Biocare, Индия - Acinimide-MD
Acinom Healthcare, Индия - Acinimide-MR [+ тизанидин]
Acinom Healthcare, Индия - Acinimide-P [+ Paracetamol]
Acinom Healthcare, Индия - Acinimide-S [+ серрапептаза]
Acinom Healthcare, Индия - Acinimide-SPAS [+ дицикловерин]
Acinom Healthcare, Индия - Actasulid
Здравлье, Босния и Герцеговина; Здравлье, Македония; Здравлье, Сербия - Actinim
Active HC, Индия - Аденим
Swiss Biotech, Индия - Аденим Плюс [+ Парацетамол]
Swiss Biotech, India - Аденим-MR [+ парацетамол, + хлорзоксазон]
Swiss Biotech, India - Adnim-P [+ парацетамол]
Adventure, Индия - Aglonim
Aglowmed, Индия - Агудол
Ласка, Парагвай - Ainex
Schering-Plough, Венесуэла - Aldee-P [+ парацетамол]
Aust Ind, India - Альгифено
Chefar, Эквадор - Альгимесил
Франсия Фармацевтика, Италия - Algolider
Siar Pharma, Италия - Алиде
Алтарь, Индия - Alide-MD
Алтарь, Индия - Алиде-П [+ парацетамол]
Алтарь, Индия - Алиним плюс [+ парацетамол]
Ultra Drugs, Индия - AllDone
Чайкафарма, Болгария - Ambatcol
Gruinfacol, Колумбия - Амеолин
Софарма, Болгария - Амоксициллин [+ Амоксициллин, + Клавулановая кислота]
Римса, Мексика - Amsolide
Amson, Пакистан - Anafortan-N [+ Paracetamol]
Khandelwal, Индия - Ana-MD
Анабиоз, Индия - Anjielishu
Topsun Pharmaceutical, Китай - Анталор
DNP, Италия - Apolide
APOTEX, Мексика - Aponil
Medochemie, Кипр; Medochemie, Литва; Medochemie, Латвия; Медохеми, Македония; Медохемие, Румыния - Areuma
Ecobi, Италия - Arflex Retard
Diffucap-Chemo, Бразилия - Arslide
RY International, Пакистан - Арсулид-D [+ дицикловерин]
Стеркем, Индия - Artilide
Global, Пакистан - Аулин
Анджелини, Португалия; Angelini Pharma Österreich, Словакия; Angelini Pharma Polska, Польша; Хельсинн, Болгария; Хельсинн, Чешская Республика; Рош, Италия; Шеринг-Плау, Эквадор; Шеринг-Плау, Венесуэла; Angelini Pharma Österreich, Румыния; Берингер Ингельхайм, Болгария; Космо, Болгария; Мифарм, Болгария; Патеон, Болгария - Aulin 100
Vifor, Швейцария - AulinDol
Angelini Pharma Polska, Польша - Avinim-MR [+ хлорзоксазон]
Avalanche, Индия - Bangni
Lingtai Pharmaceutical, Китай - Bestogesic Plus [+ Парацетамол]
Bestochem, Индия - Биолин
Pharma, Болгария - Биоксидол
Фарматен, Греция - Блунид
Блум, Пакистан - Cargespril
Gelcaps, Мексика - Карнил Плюс [+ Парацетамол]
Азин, Индия - Cimelide
Cimed Industria de Medicamentos, Бразилия - Citanz [+ Tizanidine]
Ranbaxy, Индия - Cofev [+ парацетамол]
Alna, Индия - Комспа [+ дицикловерин]
Комед, Индия - Cox-2
Global, Пакистан - Coxobid
Paramount, Пакистан - Coxtral
Зентива, Литва - Coxulid
Bilim, Турция - Cyclozed-N [+ дицикловерин]
Zota, Индия - Циклозобид [+ дицикловерин]
AHPL, Индия - Defam
Andrómaco, Мексика - Degorflan
Degort’s, Мексика - Delfos
AGIPS, Италия - Deltaflen
Delta, Бразилия - Denim
Maneesh Healthcare, Индия - Denim-P [+ Paracetamol]
Maneesh Healthcare, Индия - Dexlin
Arlex, Мексика - Димесул
Сарда Фармацевтика, Италия - Doloc
Instituto Sanitas, Чили - Dolonime
Laboratorios Chalver, Эквадор - Долоспан [+ дицикловерин]
Emcure, Индия - Dolostop
Intermed, Греция - Dolvex
Рокнарф, Эквадор - Купола
Т.Se. Pharm, Италия - Donulide
Rega Farma, Португалия - Дран Плюс [+ Дротаверин]
Jpee, Индия - Drexel
Elmor, Венесуэла - Easylide
Regardia, Индия - Edase-N [+ серрапептаза]
Solitaire, Индия - Эфридол
Актиофарма, Литва; Эскулап, Италия; Fine Foods & Pharmaceuticals, Македония - Эльдекс
Вартракс, Эквадор - Elinap
CDL Pharmaceutical, Кипр - Emdon
MacroPhar, Таиланд - Emeron
Replek Farm, Джорджия - Эмулид
Вем-Илач, Турция - Эмулид Плюс [+ лидокаин]
Вем-Илач, Турция - Enetra
Medochemie, Болгария - Enim
Английский, Пакистан - Erreflog
ADH.Pharm., Греция; Errekappa Euroterapici, Италия - Eskaflam
GlaxoSmithKline, Мексика - Fansulide
Sofar, Италия - Фасулид
Бункер, Бразилия - Феноксил
Биомеп, Мексика - Flamide
Rayere, Мексика - Flamozin
Loeffler, Мексика - Flogilid
Neo Química, Бразилия - Flogostop
CHR. К. Юнимед, Кипр; D.A.S.T Biotech, Греция - Флоговитал Н.Ф.
Баго, Парагвай - Flolid
CT, Италия - Frenag
Helba, Турция - Frendcogen
Friends, Пакистан - Fu Mei Shu
Wan Bei Pharmaceutical, Китай - Fuzo
Generica, Турция - Fuzo Plus [+ Lidocaine]
Generica, Турция - Genlide
Кадила, Индия - Genlide Plus [+ парацетамол]
Cadila, Индия - Geoslide
Geofman, Пакистан - Гесним-П [+ парацетамол]
Аарпик, Индия - Gravx
Раази, Пакистан - Hua Shuang Jie
Quidong Gaitianli Pharm, Китай - Huang Xing Yun Shu
YunFeng Pharm Шанхай, Китай - Inflalid
Difare, Эквадор; Легран / Тарья, Бразилия - Ингрел
Натуралия, Греция - Isodol
Magis, Италия - Картал
Феникс Э.P, Греция - Kind Plus [+ Парацетамол]
Solitaire, Индия - Kind-MD
Solitaire, Индия - Lalide
Medochemie, Греция - Lanimex
Базель, Эквадор - Ledoren
Boniscontro & Gazzone, Италия; Санитал, Пакистан; Шарпер, Пакистан - Lemesil
Anfarm Hellas, Румыния - Lemide
Laema Chemi Pharma, Пакистан - Ли Мэй Сун
Sibao Pharmaceutical, Китай - Li Nuo Ke
Shengquan Pharmaceutical, Китай - Ли Шу Тонг
Chengshi Pharmaceutical, Китай - Lide
Danas, Пакистан - Лусемин
Бест, Мексика - Magenol
Аверси, Грузия - Maoxing
Ruige Pharmaceutical, Китай; Zhonggui Pharmaceutical, Китай - Medani
Hispanoameric, Мексика - Medicox
Swiss & North, Эквадор - Melicat
Coup, Греция - Melide
Ferroza, Пакистан - Месулан
Рефарм, Египет - Mesulid
Angelini, Чешская Республика; Атко, Пакистан; Берингер Ингельхайм, Греция; Берингер Ингельхайм, Латвия; Дутрик, Парагвай; ВНП, Египет; Хельсинн, Италия; Хельсинн, Литва; Хельсинн Бирекс, Тайвань; Helsinn Healthcare, Гонконг; Новамед, Колумбия; Рош, Мексика - Mesulid 100
Рафа, Израиль - Месулид 100 мг
Angelini Pharma, Венгрия - Mesulid 3%
Boehringer Ingelheim, Греция - Месулид 50 мг / г
Angelini Pharma, Венгрия - Mexlide
Labovida, Эквадор - Min-a-pon
Heremco MEPE, Греция - Минесулин
Польфа Пабянице, Польша - Modact-ir
Platinum, Пакистан - Motival
Münir Sahin, Турция - Myxina
Norma Hellas, Греция - Нам
Линкольн, Индия - Nam-P [+ парацетамол]
Линкольн, Индия - Namplus [+ хлорзоксазон]
Линкольн, Индия - Намсафе [+ метионин]
Линкольн, Индия - Наофид
Велка, Греция - Narcogen
Химонт, Пакистан - Neet
Madhav BioTech, Индия - Neet Plus [+ парацетамол]
Madhav BioTech, Индия - Neet-S [+ серрапептаза]
Мадхав Биотех, Индия - Neolide
Beste Pharma, Пакистан - Неосили
Неофарми, Грузия - Neosulida
Neo Química, Бразилия - Nerelid
New Research, Италия - Невис-П [+ парацетамол]
Орион, Индия - Niap [+ Парацетамол]
Dr.Редди, Индия - Ниберан
Балу, Греция - Нибид
Орион, Бангладеш - Nidol
Eurodrug, Гонконг; Eurodrug, Пакистан; Eurodrug, Таиланд; Polipharm, Грузия - Нидол 100 мг
Евролекарство, Венгрия - Nidolid
Eurodrug, Филиппины - Нидолин
Eurodrug, Мексика - Нидолон
Eurodrug, Колумбия - Nilden
IQFA, Мексика - Нил
Интра, Индия - Nilid
Aspen Labs, Мексика - Nilide
Cadila HC, Индия - Нильсид
Фараония, Египет - Нильсид 5%
Фараония, Египет - Нилуп
Люпин, Индия - Нилуп-П [+ парацетамол]
Люпин, Индия - Nimalox
Sigma, Египет - Нимед
Берингер Ингельхайм, Болгария; Чиноин, Болгария; Хельсинн, Болгария; Хельсинн, Чешская Республика; Хельсинн, Словакия; Helsinn Bitex Pharm / Schering-Plough, Индонезия; Helsinn Producso Farmacêuticos, SA, Португалия; Lotus Pharmaceuticals, Тайвань; Медиком, Болгария; Мифарм, Болгария; Патеон, Болгария - Нимедол
Ромфарм, Грузия; С.C. Slavia Pharma, Грузия - Нимефаст
Рубикон, Грузия - Нимексил
Терра, Турция - Нимелид
Дева, Турция; Компания Rompharm, Румыния; SM Pharma, Венесуэла - Нимелид 100 мг
PannonPharma, Венгрия - Нимелид
Genepharm, Греция - Нимелит
Витамедик, Бразилия - Нимепаст
Laboratorios Pasteur, Чили - Нимепис
Пиза, Мексика - Ним
Sanovel, Турция - Нимесель
Waves-Biotech, Индия - Нимесель-П [+ парацетамол]
Waves-Biotech, Индия - Нимесил
Адеофарма, Литва; Берлин Хеми, Босния и Герцеговина; Fine Foods & Pharmaceutical, Болгария; Fine Foods & Pharmaceutical, Джорджия; Гуидотти, Литва; Laboratori Guidotti, Чешская Республика; Laboratori Guidotti, Польша; Laboratori Guidotti, Словакия; Laboratori Guidotti S.p.A., Латвия; Лабораториос Менарини, Болгария; Менарини, Грузия; Tojaris projektai, Литва - Нимесилам
EMS, Бразилия - Нимесубал
Балдаччи, Бразилия - Нимесул
Медихром, Греция; Кимика Жанвье, Парагвай - Nimesulene
Laboratori Guidotti, Италия - Нимесулид Арена
Арена, Румыния - Nimesulid MCC
Magistra, Румыния - Нимесулид Славия
Славия Фарм, Румыния - Nimesulida Almus
Almus, Португалия - Nimesulida Alter
Alter, Португалия - Нимесулида Амса
Амса, Мексика - Nimesulida Andromaco
Laboratorios Andromaco, Чили - Nimesulida Apotex
APOTEX, Мексика - Нимесулида Балдаччи
Балдаччи, Португалия - Nimesulida Basi
Basi, Португалия - Nimesulida Biosintetica
Biosintética, Brazil - Nimesulida Bluepharma
Bluepharma, Португалия - Nimesulida Ciclum
Ciclum, Португалия - Nimesulida Cimed
Cimed Industria de Medicamentos, Бразилия - Nimesulida Cinfa
Cinfa, Португалия - Nimesulida EMS
EMS, Бразилия - Nimesulida Eurofarma
Eurofarma, Brazil - Nimesulida Farmoz
Farmoz, Португалия - Nimesulida Gen.Гермед
Genéric.Germed, Бразилия - Nimesulida Gen.Legrand
Genéric.Legrand, Brazil - Nimesulida Genamérica
Genamerica, Эквадор - Nimesulida Generis
Generis, Portugal - Нимесулида Гермед
Гермед, Португалия - Nimesulida GP
GP, Португалия - Нимесулида Джабасулиде
Джаба, Португалия - Nimesulida L.CH
Laboratorio Chile, Чили - Нимесулида Ла Санте
Ла Санте, Колумбия; Ла-Санте, Эквадор - Nimesulida Labesfal
Generis, Португалия - Нимесулида МК
МК, Колумбия; MK, Эквадор - Nimesulida Multilab
Multilab, Бразилия - Nimesulida Neo Quimica
Neo Química, Бразилия - Nimesulida Neuride
Tecnimede, Португалия - Нимесулида Нифа
Нифа, Эквадор - Nimesulida Nova Quimica
Nova Química Farmacêutica, Бразилия - Нимесулида Опко
Опко Чили, Чили - Нимесулида Пастер
Laboratorios Pasteur, Чили - Нимесулида Пентафарма
Пентафарма, Португалия - Nimesulida Pharmakern
Pharmakern, Португалия - Нимесулида Ратиофарм
Ратиофарм, Португалия - Нимесулида Рокнарф
Рокнарф, Эквадор - Нимесулида Сандоз
Сандос, Португалия - Нимесулид
FarmaSyn, Греция - нимесулид Actavis
Actavis Италия, Италия - Нимесулид Альмус
Альмус, Италия - Нимесулид Альтер
Альтер, Италия - Нимесулид Ангенерико
Ангенерико, Италия - Нимесулид BIG
Фармаген, Италия - Нимесулид Биотех RX
Биотех, Венесуэла - Нимесулид Калокс
Калокс, Венесуэла - нимесулид DOC
DOC Generici, Италия - Нимесулид Дором
Дором, Италия - Нимесулид Dr Reddy’s
Dr Reddy’s, Италия - нимесулид EG
EG, Италия - Nimesulide Elter
Elter — Medicamentos Genéricos, Венесуэла - Нимесулид Г.C.
Calidad, Венесуэла - нимесулид гексал
гексал, Италия - Nimesulide Ingen Pharma
SIA Ingen Pharma, Литва - Нимесулид Мифарм
Мифарм, Италия - Нимесулид Mylan Generics
Mylan, Италия - Нимесулид Pensa
Pensa Pharma, Италия - Нимесулид Плива
Гермед Фарма, Италия - нимесулид Ranbaxy
Ranbaxy Italia, Италия - нимесулид ратиофарм
ратиофарм Италия, Италия - нимесулид Sandoz
Sandoz, Италия - Нимесулид SM Pharma
SM Pharma, Венесуэла - Nimesulide Spefar
Spefar, Венесуэла - нимесулид TAD
Ауробиндо, Италия - Нимесулид Тева
Тева Италия, Италия - Нимесулид Union Health
Union Health, Италия - Nimesulide Valmor
Valmor Gencer, Венесуэла - Nimesulide-Humanity
Windlas, Джорджия - Нимесулид-Нано
GMP, Грузия - Нимесуликс
Теуто Бразилейро, Бразилия - Nimesuvar
Infinity, Венесуэла - Нимесил
Синтон Чили, Чили - Ниметаксин
Софарма Здровит, Польша - Nimex
ABL, Эквадор; Эскаеф, Бангладеш - Nim-H
Hudson, Бангладеш - Nimica
IPCA, Индия - Nimica Plus [+ парацетамол]
IPCA, Индия - Nimidis
Biovitamins, Индия - Нимидис-П [+ парацетамол]
Биовитамины, Индия - Nimip-Spas [+ Дицикловерин]
Pax Healthcare, Индия - Нимиз
Зота, Индия - Нимиз-Плюс [+ Парацетамол]
Зота, Индия - Nimley-MD
Зодли, Индия - Нимм
Кодал Синто, Кипр; Кодал-Синто, Гонконг - Нимокаин [+ лидокаин]
Pharmactive, Турция - Nimras-MD
Rass, Индия - Нимс
Кабер, Италия; Unimed & Unihealth, Бангладеш - Nimtech Plus [+ парацетамол]
Macleods, Индия - Нимуфлекс-П [+ парацетамол]
AHPL, Индия - Nimulex-FD
Pharmed, Индия - Нимулид
Панацея, Индия; Панацея, Сербия; Panacea Biotec, Босния и Герцеговина; Panacea Biotec, Таиланд - Nimulid-MD
Panacea, India; Панацея, Сербия; Panacea Biotec, Босния и Герцеговина - Нимулид-MR [+ Тизанидин]
Панацея, Индия - Нимуспас [+ дицикловерин]
Стедман, Индия - Nimustar
Invision, Индия - Нимустар-П [+ парацетамол]
Invision, Индия - Нимустар-S [+ серрапептаза]
Invision, Индия - Nimvar-MD
Zota, Индия - Nimvar-MR [+ Tizanidine]
Zota, Индия - Nimven-MD
Vensat, Индия - Nimvista
Cadila, Индия - Nimvista Plus [+ Парацетамол]
Кадила, Индия - Нимз
Элтис, Индия - Nincolide
Synpac-Kingdom, Тайвань - Ni-P [+ парацетамол]
Sanify, Индия - Нисалген
UCI-Farma, Бразилия - Найз
Лаборатория доктора Редди, Мьянма; ДокторРедди, Индия; Доктора Редди, Перу; Dr. Reddy’s, Российская Федерация - Nise-MD
Доктор Редди, Индия - Nise-MR [+ Тизанидин]
Доктор Редди, Индия - Нисофлан
GeoLab, Бразилия - Нисуфар
Элофар, Бразилия - Nisuldex
Swiss & North, Эквадор - Нисулид
Аче, Бразилия - Нисулид
Фармтехнология, Грузия - Nisural
Laboratorio Chile, Чили - Ниян
Шоу Чан, Тайвань - Nizer
USV, Индия - Низи [+ Тизанидин]
FDC, Индия - Nizuil
Multilab, Бразилия - Низурин
Коллинз, Мексика - Nodo 100
Готье, Уругвай - Normosilen
Leti, Венесуэла - Novolid
Micro B & B, Индия - Новолид-MR [+ Тизанидин]
Micro B & B, Индия - Novolid-S [+ серрапептаза]
Micro B & B, Индия - Nuo Zheng
Xinzhongzheng Pharma, Китай - Нупар [+ Парацетамол]
Савой, Индия - Нюмер
Алкалоид, Македония - Optaflan
Галлия, Бразилия - Орониме
Ауробиндо, Италия - Orthobid
AHPL, Индия - Orthobid Plus [+ Серрапептаза]
AHPL, Индия - Ортобид-MR [+ Тизанидин]
AHPL, Индия - Пакимол Плюс [+ Парацетамол]
IPCA, Индия - Пацисулид
Hankook Korus Pharm Co Ltd, Гонконг - Painspas [+ гидрохлорид дицикловерина]
Alobiote, Индия - Pantames
Pantafarm, Италия - Pentra
Drug International, Бангладеш - Прексулид
Cifarma Cientifica Farmaceutica, Бразилия - Promesulida
Promepar, Парагвай - Pu Fei Te
Xincat Pharmaceutical, Китай - Pu Wei
Тяньцзиньский институт фармацевтических исследований Pharmaceutical, Китай - Пираним
Сага, Индия - Quidofil
Serral, Мексика - Redaflam
Maver, Мексика - Reduben
Cofasa, Венесуэла - Relisulide
Juggat, Индия - Relmex
Quimica Ariston, Эквадор - Remov
Пиам, Италия; Пиам, Мальта - Ромасулид
Кочак, Турция - Rui Li
Nanjing Sanrui Pharmaceutical Co., Ltd, Китай - Rui Pu Le
Zhongrui Kangzhi Pharmaceutical, Китай - Rui Zhi Li
Zhongrui Kangzhi Pharmaceutical, Китай - Rui Zhi Qing
Zhongrui Kangzhi Pharmaceutical, Китай - Sai Pu Da
Sunstone Pharmaceutical, Китай - Scaflam
Mantecorp FSA, Бразилия - Scaflan
Schering-Plough, Венесуэла - Scaflogin
Globo, Бразилия - Скалид
Униан-Кимика, Бразилия - Seren-N [+ серрапептаза]
Active HC, Индия - Серралекс-НМ [+ серрапептаза]
Lexus, Индия - Северин
Чиноин, Коста-Рика; Чиноин, Доминиканская Республика; Чиноин, Мексика; Чиноин, Панама; Чиноин, Сальвадор - Северин NF
Чиноин, Мексика - Sharonim
Sharon Bio-Medicine Ltd, Гонконг - Si Rui
Huabang Medical & Chemical, Китай - Solving
MDM, Италия - Specilid
Alet Pharmaceuticals, Греция - Суарон
GMP, Грузия - Sulicox
Genetikapharma, Эквадор - Сулидамор
Дамор, Италия - Сулидан
Копад Египет, Египет - Сулид
Ауробиндо, Италия; Хикма, Египет - Сулид 5%
Хикма, Египет - Sulidin
Embil Pharma, Филиппины; Exeltis, Турция - Сулидин плюс [+ лидокаин]
Exeltis, Турция - Sulidol-GB
Нафар, Мексика - Sulidor
Caldeira & Metelo, Португалия - Suljel
Berko, Турция - Sumo
Navana, Бангладеш - Сумо [+ парацетамол]
Алкем, Индия - Sumo-MR [+ тизанидин]
Alkem, Индия - Sumo-Spas [+ Camylofin]
Alkem, Индия - Sundir
Quimica Son’s, Мексика - Thermo Sulidin [+ Capsaicin]
Embil, Турция - Торо-Сановель
Сановель, Грузия - Tranzicalm
Vocate, Греция - Uciton
UCI-Farma, Бразилия - Ventor
Rafarm, Греция; Реплек, Македония; Replek Farm, Босния и Герцеговина - Volonten
Viofar, Греция - Windose
Biomiicron, Индия - Ксилокс 50 мг / г
Гуидотти, Венгрия - Ксимеде
Комбифар, Индонезия - Залид [+ тизанидин]
Active HC, Индия - Цитрофлам [+ азитромицин]
Римса, Мексика - Золан 100 мг [ветеринарное применение]
Вирбак, Нидерланды - Золан 50 мг [ветеринарное применение]
Вирбак, Нидерланды - Золандин-MR [+ Тизанидин]
AHPL, Индия - Abilid-MD
ABL Lifecare, Индия - Abinim-MD
Alpic Biotech, Индия - Maxsulid
Mantecorp FSA, Бразилия - Nimecox
Leti, Венесуэла - Nimedex
Italfarmaco, Италия - Пеналгин
Euroetika, Колумбия
Глоссарий
| Срок | Определение | |||
|---|---|---|---|---|
| BAN | Утвержденное британское название | |||
| DCF | Dénomination Commune Française | |||
| DCIT | DCIT | DCIT | DCIT | Неофициальный синоним |
| JAN | Принятое японское имя | |||
| OS | Официальный синоним | |||
| PH | Фармакопейное имя | |||
| Рекомендуемое международное непатентованное наименование (Всемирная организация здравоохранения) |
Дополнительная информация о соглашениях о наименовании лекарственных средств: Международные непатентованные наименования.
Важное примечание: международная база данных Drugs.com находится в стадии бета-версии. Это означает, что он все еще находится в стадии разработки и может содержать неточности. Он не предназначен для замены опыта и суждения вашего врача, фармацевта или другого медицинского работника. Его не следует толковать как указание на то, что использование каких-либо лекарств в любой стране безопасно, подходит или эффективно для вас.Проконсультируйтесь со своим лечащим врачом перед применением каких-либо медикаментов.
Дополнительная информация
Всегда консультируйтесь со своим врачом, чтобы информация, отображаемая на этой странице, соответствовала вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Нимесулид — это рецептурный нестероидный противовоспалительный препарат (НПВП) с обезболивающими и жаропонижающими свойствами, утвержденными показаниями к его применению для лечения острой боли, симптоматического лечения остеоартроза и первичной дисменореи у подростков и взрослых старше 12 лет. Старый. Рекомендуемые дополнительные знанияИсторияВпервые он был запущен в Италии под названиями Aulin и Mesulid в 1985 году и в настоящее время доступен более чем в 50 странах мира, в том числе во Франции, Португалии, Греции, Швейцарии, Бельгии, Мексике, Бразилии. Нимесулид никогда не подавался на оценку FDA в США, где он не продается. В 2002 г. профиль пользы / риска нимесулида был рассмотрен EMEA после решения о временном прекращении продажи препарата в марте 2002 г. в связи с сообщениями о побочных эффектах со стороны печени у пациентов, очевидно получавших нимесулид. EMEA сообщает о благоприятном соотношении польза / риск1 августа 2003 г. Комитет по патентованным лекарственным средствам (CPMP) EMEA сообщил, что профиль пользы / риска лекарственных средств, содержащих нимесулид (аулин, месулид, нимед и связанные названия продуктов) для системного и местного применения, является благоприятным и что Разрешения на продажу должны быть сохранены / предоставлены.CPMP рекомендовал ограничить использование нимесулида показаниями для лечения острой боли, симптоматического лечения болезненного остеоартрита и первичной дисменореи для системных препаратов и симптоматического облегчения боли, связанной с растяжениями и острым тендинитом, для местного препарата. [2] Alembic Ltd. выпустила циркуляр, в котором просила оптовых и розничных продавцов вывести все запасы нимегезика капель (детская лекарственная форма нимесулида) в 2003 году, что согласуется с тем фактом, что нимесулид, как и большинство НПВП, не показан в дети. [3] Ирландский комитет по лекарственным средствам (IMB) приостанавливает действие препаратов, содержащих нимесулид (15 мая 2007 г.)Ирландский комитет по лекарственным средствам (IMB) решил приостановить выпуск нимесулида на ирландском рынке и направить его в Комитет ЕС по лекарственным средствам для человека (CHMP) для проверки его профиля пользы / риска. Это решение связано с тем, что Национальное отделение трансплантации печени больницы Сент-Винсент направило в IMB отчет о шести (6) случаях потенциально связанной печеночной недостаточности. Эти случаи произошли в период с 1999 по 2006 год. [4] Управление здравоохранения Сингапура приостанавливает действие препаратов, содержащих нимесулидВ ожидании рассмотрения безопасности препарата в EMEA, применение нимесулида было приостановлено с немедленным вступлением в силу (15 июня 2007 г.) [5] [6] EMEA подтверждает положительное соотношение польза / риск21 сентября 2007 г. EMEA выпустило пресс-релиз о своем обзоре безопасности нимесулида для печени. EMEA пришло к выводу, что преимущества этих лекарств перевешивают их риски, но необходимо ограничить продолжительность использования, чтобы свести к минимуму риск развития у пациентов проблем с печенью.Поэтому в странах Европы, Ближнего Востока и Африки ограничено использование системных препаратов (таблеток, растворов, суппозиториев) нимесулида до 15 дней. [7] Прайм-тайм RTE расследует3 декабря 2007 г. ирландское агентство RTÉ представило программу-расследование, в которой освещаются смертельные побочные эффекты нимесулида и его связь с более чем 300 случаями заболеваний печени по всей Европе. Несмотря на несколько попыток его забанить; он остается на рынке в основном из-за бюрократической волокиты ЕС [ необходима ссылка ] .Он стал причиной смерти многих людей как в Ирландии, так и во всем мире, его следует избегать, особенно когда доступны более безопасные альтернативы. Наличие Выпускается в различных формах: таблетки, порошок для растворения в воде, суппозитории и гель для местного применения. Торговые наименованияНимесулид доступен во всем мире как оригинальный продукт под следующими торговыми марками: Aulin, Ainex, Drexel, Donulide, Edrigyl, Eskaflam, Heugan, Mesulid, Minapon, Nexen, Nimed, Nimedex, Nimutab, Nisulid, Scaflam, Scaflan. Сулиден и золан для ветеринарии. Также существует множество дженериков и копий (Coxtral, Lusemin, Medicox, Nidol, Nimalox, Nimesil, Nimotas, Nimulid, Nise, Ventor, Willgo и другие). ФармакокинетикаНимесулид быстро всасывается после перорального приема [8] . Нимесулид подвергается обширной биотрансформации, в основном в 4-гидроксинимесулид (который, по-видимому, также является биологически активным). [8] . Пища, пол и пожилой возраст имеют незначительное влияние на фармакокинетику нимесулида [8] . Умеренная почечная недостаточность не требует корректировки дозировки, в то время как пациенты с тяжелой почечной недостаточностью или печеночной недостаточностью противопоказаны [9] Нимесулид имеет относительно быстрое начало действия, при этом значительное уменьшение боли и воспаления наблюдается в течение 15 минут после приема препарата. впуск [10] [11] .Почти 498 миллионов пациентов прошли курс лечения нимесулидом с момента его запуска до сегодняшнего дня [ необходима ссылка ] .
| |
.
 Найдите на карте ближайший пункт сдачи анализов и запишитесь по телефону.
Найдите на карте ближайший пункт сдачи анализов и запишитесь по телефону.