АКДС | Прививки.уз — Предупредить. Защитить. Привить.
Новые инфо материалы по иммунизации во время пандемии COVID-19
для медицинский работников и родителей
Вакцинация во время пандемии COVID-19
Вопросы и ответы для РОДИТЕЛЕЙ
Вакцинация во время пандемии COVID-19
Вопросы и ответы для МЕДРАБОТНИКОВ
В ВОЗ отмечают 40-летие победы над оспой
и призывают проявить такую же солидарность в борьбе с COVID-19
Может ли БЦЖ вакцина помочь в борьбе с коронавирусом?
Международные исследования анализируют влияние БЦЖ вакцины на коронавирус
Совместное заявление ВОЗ и ЮНИСЕФ
Во время пандемии COVID-19 крайне важно сохранить услуги плановой иммунизации
В условиях пандемии COVID-19 вакцинацию необходимо продолжать, чтобы она сохраняла свою эффективность
Европейская неделя иммунизации — 2020
ГАВИ, ВОЗ, ЮНИСЕФ: успешное сотрудничество и новые планы
22-23 ноября 2019 года в конференц-зале гостиницы Hyatt Regency Tashkent при поддержке ВОЗ Министерство здравоохранения провело ежегодную национальную конференцию по иммунизации
Первый этап вакцинации против ВПЧ прошел успешно и эффективно
Минздрав провел конференцию по итогам первого этапа прививочной кампании против ВПЧ в Узбекистане.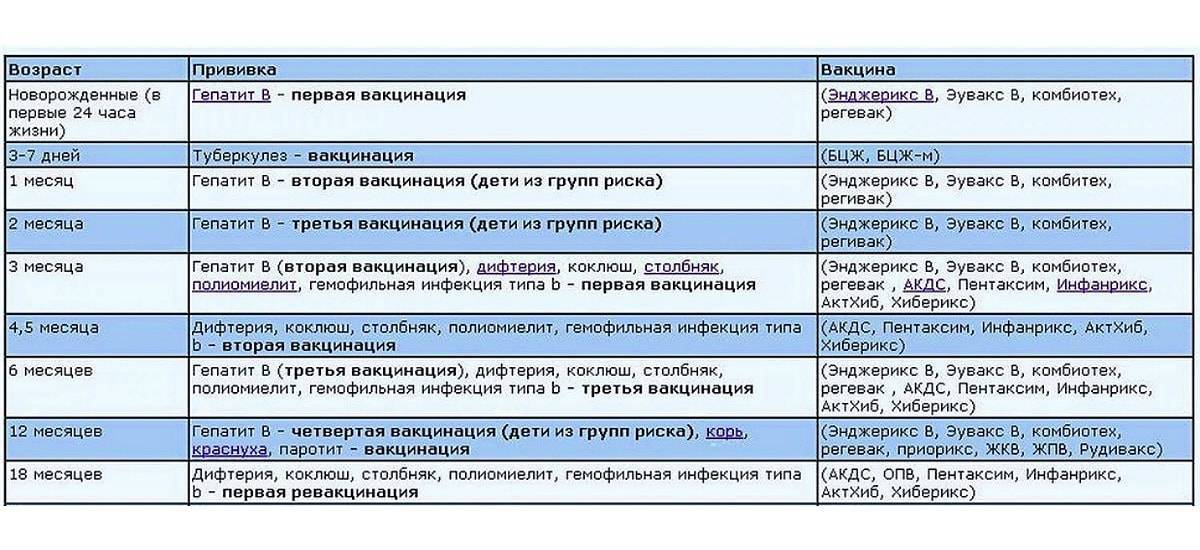
Первые результаты вакцинации от ВПЧ!
Как вы знаете, с 21 октября 2019 года по всей республике проводится вакцинация против ВПЧ.
В Узбекистане дан старт вакцинации против вируса папилломы человека
В столице состоялась пресс-конференция, посвященная началу вакцинации против вируса папилломы человека.
Встреча с блогерами о ВПЧ
«Мероприятие полностью меня поглотило».
Профилактика рака шейки матки и внедрение ВПЧ вакцины в Узбекистане
Все о вакцинации от ВПЧ
Встреча с Ассоциацией частных школ Узбекистана по внедрению ВПЧ вакцины
Научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
20 августа 2019 года В Ташкенте под слоганом «Будущее без рака шейки матки» прошла научно-практическая конференция по профилактике, раннему выявлению и лечению рака шейки матки.
Рабочий визит делегации Республики Узбекистан по опыту внедрения внедрения вакцинации против ВПЧ в Молдове
«Это наши мамы, наши сестры, наши дочери, которых мы можем защитить от рака шейки матки уже сегодня благодаря вакцине от ВПЧ и программе скрининга», — неоднократно повторяли представители Молдовы.
Техническая поддержка Узбекистану в оценке температурных рисков в системе холодовой цепи для вакцин
В рамках оказания технической поддержки Узбекистану в достижении лучших стандартов качества и безопасности вакцин, с 13 по 24 августа 2019 года проходит миссия в составе консультантов ВОЗ г-жи Claire Frijs-Madsen и г-жи Erida Nelaj.
Прививки: абсолютно исчерпывающая инструкция для взрослых и детей Даже для тех, кто не верит в вакцинацию
Антипрививочное движение продолжает шириться, а вместе с ним растети частота вспышек инфекций
Совсем недавно в рамках Европейской недели иммунизации состоялась очень необычная и интересная встреча
Пресс-центр
опубликовано: | изменено:
Прививка от дифтерии
Варианты вакцин
Вакцины против дифтерии производятся на основе дифтерийного анатоксина, являющегося модифицированным бактериальным токсином, который индуцирует защитный антитоксин.Прививка для профилактики дифтерии представляет собой анатоксин, адсорбированный на алюминия гидроксиде. Дифтерийный анатоксин выпускается также в комбинации со столбнячным анатоксином (прививки АДС, АДС-м) и коклюшной вакциной (цельноклеточной – АКДС, Бубо-М, Бубо-Кок; и бесклеточной, или ацеллюлярной – Инфанрикс, Пентаксим, Тетраксим, Инфанрикс Пента, ИнфанриксГекса). Профилактические прививки позволяют создать длительный и напряжённый антитоксический иммунитет от дифтерии.
Прививка АКДС состоит из смеси корпускулярной коклюшной вакцины, дифтерийного и столбнячного анатоксинов. АДС-анатоксин представляет собой очищенные и адсорбированные дифтерийный и столбнячный анатоксины. АДС-М-анатоксин отличается от АДС уменьшенным содержанием антигенов — в одной прививочной дозе (0,5 мл) содержится 5 ЛФ (единица измерения активности компонентов) дифтерийного анатоксина и 5 ЕС (единица измерения активности компонентов) столбнячного анатоксина (для сравнения, в 0,5 мл прививки АДС содержится 30 ЛФ дифтерийного анатоксина и 20 ЕС столбнячного анатоксина).
АДС-анатоксин представляет собой очищенные и адсорбированные дифтерийный и столбнячный анатоксины. АДС-М-анатоксин отличается от АДС уменьшенным содержанием антигенов — в одной прививочной дозе (0,5 мл) содержится 5 ЛФ (единица измерения активности компонентов) дифтерийного анатоксина и 5 ЕС (единица измерения активности компонентов) столбнячного анатоксина (для сравнения, в 0,5 мл прививки АДС содержится 30 ЛФ дифтерийного анатоксина и 20 ЕС столбнячного анатоксина).
Все вакцины для профилактики дифтерии, столбняка и коклюша являются инактивированными (убитыми), то есть они не содержат ничего живого. Известно, что отдельные антигены в чистом виде и инактивированные вакцины уступают по эффективности живым вакцинам. В этой связи в качестве усилителя (т.н. адъюванта) прививки против дифтерии, столбняка, коклюша (и ряда других инфекций) используется гидроокись алюминия. Смысл использования этого вещества заключается в усилении воспалительной реакции в месте введения вакцин и, как следствие, интенсификации иммунных реакций и увеличении эффективности прививки в целом.
Принципы и цели вакцинации
Дифтерия – крайне опасное своими осложнениями заболевание, для ее профилактики необходима вакцинация. Производство вакцин – сложный многоступенчатый процесс. Дифтерийный анатоксин получают из токсина, продуцируемого дифтерийным микробом. Микроорганизмы культивируют в жидкой питательной среде, в которую они выделяют токсин. Полученную среду тщательно освобождают от микробных клеток, а затем обрабатывают, чтобы полностью обезвредить токсин, сохранив только его иммунизирующую активность. Дифтерийный анатоксин контролируется по нескольким показателям (приняты ВОЗ в 1965 г.): прежде всего, на безопасность, то есть полноту обезвреживания токсина. Этот показатель проверяют на чувствительных животных, вводя им дозу, в 50-100 раз превышающую дозу для человека, что позволяет выявить следовые количества недообезвреженного токсина. После теста на безопасность его проверяют на возможность возврата токсических свойств. С этой целью очищенный анатоксин инкубируют в течение шести недель при разных температурных режимах, а затем опять проводят контрольный тест на животных.
После теста на безопасность его проверяют на возможность возврата токсических свойств. С этой целью очищенный анатоксин инкубируют в течение шести недель при разных температурных режимах, а затем опять проводят контрольный тест на животных.
Дозировка
— у детей с 3-х месяцев до 4 лет — три прививки от дифтерии по 0,5 мл с интервалом 6 недель, с последующей ревакцинацией через 12 месяцев после третьей прививки; у детей старше 4 лет и взрослых – две прививки от дифтерии по 0,5 мл с интервалом 4-6 недель с последующей ревакцинацией через 9-12 месяцев
После проведения серии первичной иммунизации средняя продолжительность защиты от дифтерии составляет около 10 лет. Далеко не все знают, что во взрослом возрасте показана ревакцинация ассоциированным дифтерийно-столбнячным анатоксином с уменьшенным содержанием антигена (АДС-м) каждые 10 лет.
Эффективность вакцин
Введение в 1994 г. массовой иммунизации населения страны против дифтерии с повторной ревакцинацией взрослых в 2003-2004 гг. позволило обеспечить достаточную специфическую защиту населения от этой инфекции. В совокупности с многолетним надзором это привело к снижению заболеваемости дифтерией в России с 26,8 в 1994 г. до 0,01 на 100 тыс. населения в 2009-2011 гг. В течение периода 1980-2000 гг. общее число зарегистрированных случаев дифтерии было снижено более чем на 90%.
Все компоненты АКДС-вакцин способны формировать иммунитет практически у 100% привитых.
Побочные реакции
После введения адсорбированных препаратов (внутримышечно или подкожно) на месте инъекции может некоторое время сохраняться небольшое уплотнение, которое не опасно для организма.
Прививки АКДС являются наиболее реактогенными, «тяжелыми» вакцинами детского возраста. В среднем побочные реакции встречаются у трети привитых, причем не на каждую прививку. Пик частоты реакций отмечается, как правило, на третье и четвертое введения вакцины, что совпадает с пиковыми показателями выработки иммунитета. Они проявляются умеренным повышением температуры тела, легким недомоганием в течение суток после вакцинации. Возможны также покраснение, припухание, болезненность в месте инъекции, редко бывают быстропроходящие эфемерные высыпания. Реакции в месте введения прививки от дифтерии в целом отмечаются у 15-25% привитых: покраснение (1-2%) и отечность (1-2%), вызванные иммунным воспалением в месте введения вакцины и действием адъюванта. Боль в месте укола (вероятность около 15%, проявляется тем, что при движениях ребенок «бережет» ножку и плачет) также является следствием воспалительной реакции.
Они проявляются умеренным повышением температуры тела, легким недомоганием в течение суток после вакцинации. Возможны также покраснение, припухание, болезненность в месте инъекции, редко бывают быстропроходящие эфемерные высыпания. Реакции в месте введения прививки от дифтерии в целом отмечаются у 15-25% привитых: покраснение (1-2%) и отечность (1-2%), вызванные иммунным воспалением в месте введения вакцины и действием адъюванта. Боль в месте укола (вероятность около 15%, проявляется тем, что при движениях ребенок «бережет» ножку и плачет) также является следствием воспалительной реакции.
Общие реакции на прививку от дифтерии в среднем отмечаются у 20% привитых: повышение температуры тела (до 30%), прочие (беспокойство или, наоборот, заторможенность, рвота, понос, нарушения аппетита). Как правило, все побочные реакции на АКДС-вакцины развиваются не позднее 24 (72) часов после прививки, длятся не более 24 (48) часов и не требуют лечения.
Риск поствакцинальных осложнений
Как и на введение любой другой вакцины, в редких случаях возможны аллергические реакции на компоненты АКДС-вакцины. Эти осложнения связаны не со свойствами прививки, а с количеством вспомогательных веществ в конкретных препаратах, наличием у ребенка аллергии к ним и, в части случаев, несоблюдением правил вакцинации. Показателен тот факт, что, согласно статистике поствакцинальных осложнений в США, даже тяжелые аллергические реакции на АКДС-вакцины не привели к тяжелым последствиям ни в одном случае с 1978 года, с учетом того, что за этот период было сделано около 80 млн прививок против дифтерии. К вероятным специфическим осложнениям на прививки АКДС можно отнести неврологические осложнения, которые крайне редки. Как предполагается, они могут быть вызваны тем, что токсины коклюшной палочки (даже инактивированной) в комбинированных вакцинах имеют свойство раздражать, у крайне небольшой части восприимчивых детей, мозговые оболочки.
Редкими проявлениями неврологических осложнений на прививку от дифтерии могут быть: судороги без повышения температуры – 0,3-90 на 100 тыс. прививок, осложнения в виде энцефалопатии – менее 1 случая на 300 тысяч привитых. В настоящее время в мире судороги без повышения температуры не считают осложнением на прививку. Исследования, проведённые в Великобритании в 1960-1970 гг. свидетельствуют об одинаковой частоте развития судорог у привитых и непривитых детей. При этом первые проявления таких заболеваний как эпилепсия, органическое поражение головного мозга могут проявляться в виде судорог в возрасте 3-4 месяцев, когда начинают проводить вакцинацию, и связаны с прививкой только временным фактором.
прививок, осложнения в виде энцефалопатии – менее 1 случая на 300 тысяч привитых. В настоящее время в мире судороги без повышения температуры не считают осложнением на прививку. Исследования, проведённые в Великобритании в 1960-1970 гг. свидетельствуют об одинаковой частоте развития судорог у привитых и непривитых детей. При этом первые проявления таких заболеваний как эпилепсия, органическое поражение головного мозга могут проявляться в виде судорог в возрасте 3-4 месяцев, когда начинают проводить вакцинацию, и связаны с прививкой только временным фактором.
Противопоказания
Помимо общих противопоказаний к вакцинации против дифтерии, таких как острое заболевание, аллергия к компонентам прививок и тяжелый иммунодефицит (при котором формирование иммунитета невозможно), АКДС-вакцины временно или абсолютно противопоказаны в случае, если у ребенка имеется прогрессирующая патология нервной системы, либо отмечались судороги без повышения температуры (афебрильные). В этом случае дети прививаются вакциной от дифтерии без коклюшного компонента (прививка АДС). Временными и относительными противопоказаниями являются обострение хронических заболеваний (прививки можно проводить вне обострений), недавно перенесенная острая респираторная инфекция (ОРИ) (прививки против дифтерии можно проводить сразу после выздоровления). Следует заметить, что в США легкая ОРИ не является противопоказанием, и прививки могут быть проведены, в том числе, на фоне незначительного повышения температуры, кашля, насморка. Также противопоказанием является развитие сильных общих и местных реакций на предшествующее введение АКДС прививки (повышение температуры выше 40 С, отек и гиперемия в месте введения вакцины свыше 8 см в диаметре).
Когда прививать?
Курс первичной вакцинации против дифтерии проводят детям с 3-месячного возраста троекратно, с интервалом 45 дней. Первая ревакцинация проводится прививкой АКДС через 12 месяцев после 3-й вакцинации, вторая ревакцинация — с 7 лет АДС-М-анатоксином, третья — в 14 лет, и далее взрослым– каждые 10 лет АДС-М-анатоксином
Что делать, если у ребенка припухло бедро после прививки
Ребенку сделали прививку от дифтерии, столбняка и коклюша в бедро.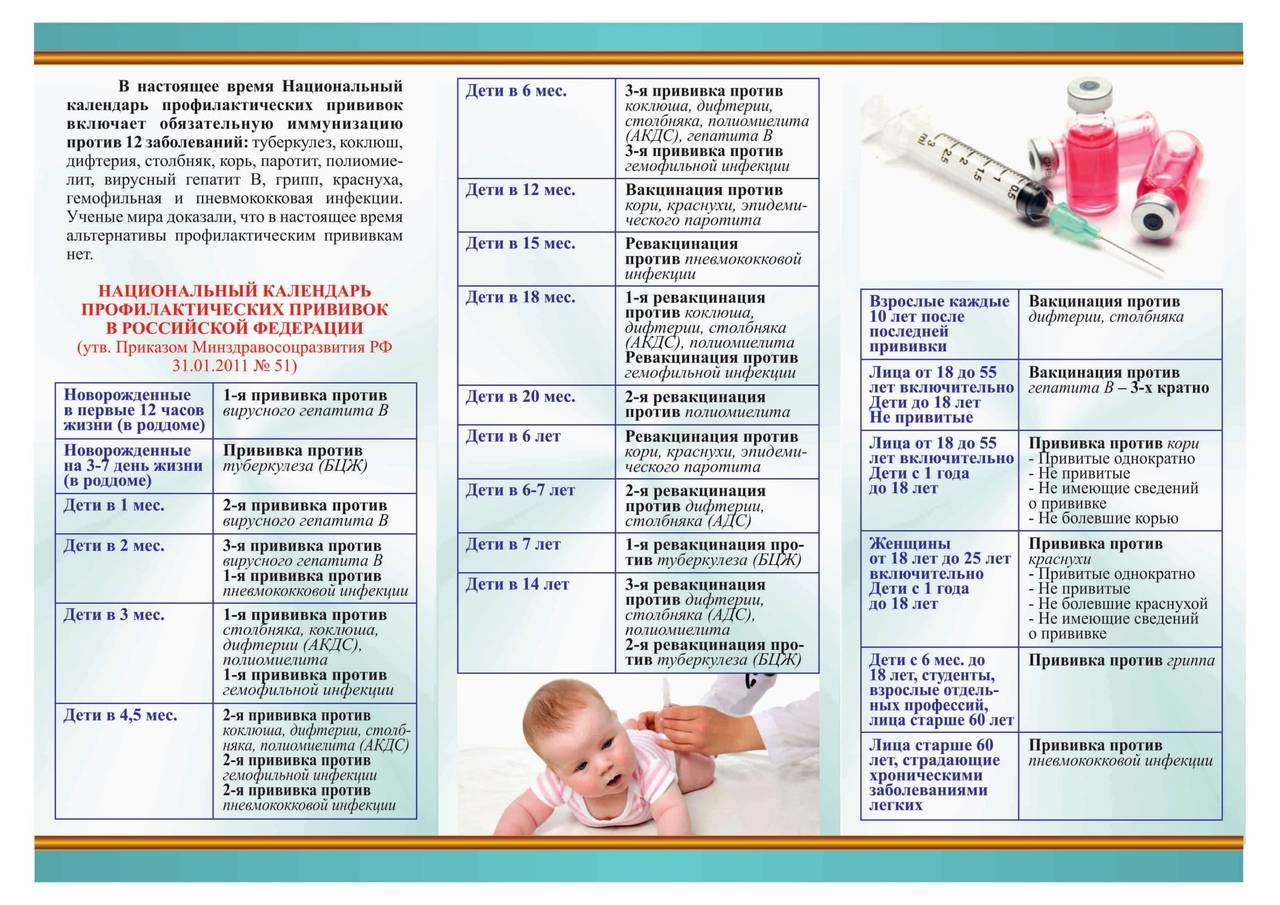 Вдруг через некоторое время появилась припухлость в месте укола. Конечно же, любые отклонения от нормы вызывают беспокойство, и вы идете к врачу. Врач успокаивает и говорит, что это пройдет, это такая реакция на прививку АКДС. Она возможна и описана в инструкции как допустимая постпрививочная реакция. Вы успокаиваетесь и ждете какое-то время, но что-то лучше не становится и как-то покраснело, затвердело то место на бедре, куда была введена прививка. Беспокойство побуждает вас пойти к хирургу.
Вдруг через некоторое время появилась припухлость в месте укола. Конечно же, любые отклонения от нормы вызывают беспокойство, и вы идете к врачу. Врач успокаивает и говорит, что это пройдет, это такая реакция на прививку АКДС. Она возможна и описана в инструкции как допустимая постпрививочная реакция. Вы успокаиваетесь и ждете какое-то время, но что-то лучше не становится и как-то покраснело, затвердело то место на бедре, куда была введена прививка. Беспокойство побуждает вас пойти к хирургу.
Давайте поговорим о постпрививочном и постинъекционном инфильтрате. Что же думают практические врачи на эту тему?
Педиатры порой встречаются с местной реакцией на прививку именно на бедре, потому что прививки малышам от дифтерии, коклюша и столбняка делают именно в наружную поверхность бедра. На бедре после прививки у некоторых детей появляется припухлость, и размер этой припухлости может быть различным — от нескольких сантиметров до отека большей части боковой поверхности бедра. При этом малыш нормально себя ведет и место припухлости не болит.
Через какое-то время отечность проходит бесследно, или может сохраняться небольшое уплотнение в месте укола, которое ощущается как шишечка при прощупывании. Но и эта шишечка через какое-то время исчезнет. Вот именно такой сценарий благоприятен. Такая реакция происходит за счет местного иммунного ответа тканей на вакцину. Это постпрививочный небактериальный инфильтрат. Он не требует лечения — ни общего, ни местного.
Но вот другой вариант развития событий. Отек и затвердевание тканей в месте укола нарастают, и нет тенденции к их исчезновению даже спустя 7—10 дней. Здесь есть опасения, что безобидный постпрививочный инфильтрат может перейти в постинъекционный инфильтрат, который проходит несколько стадий развития — от катаральной до гнойной. В таких случаях надо вместе с врачом держать ситуацию под контролем. Здесь помогает ультразвуковое исследование мягких тканей и врачебное наблюдение в динамике. Только визуальный осмотр и данные УЗИ мягких тканей в помощь врачу помогут выбрать тактику лечения. Выбор стоит между консервативным лечением мазями или хирургическим лечением. Выжидательная тактика врача оправдана в том случае, если у ребенка нет болезненности и выделений в месте инъекции.
Выбор стоит между консервативным лечением мазями или хирургическим лечением. Выжидательная тактика врача оправдана в том случае, если у ребенка нет болезненности и выделений в месте инъекции.
Прививка АДСМ
Проводим вакцинацию от столбняка и дифтерии. Безопасно, быстро, в 8 районах Санкт-Петербурга.
АДСМ (АДС) — это вакцина, используемая для прививки от столбняка и дифтерии – инфекционных заболеваний, опасных развитием осложнений и летальным исходом.
Дифтерия – острое бактериальное заболевание, проявляется тяжелой интоксикацией, воспалением рото- и носоглотки, поражением сердечно-сосудистой системы, почек, печени и др. Дифтерия преимущественно передается воздушно-капельным путем (в редких случаях контактно-бытовым). Риск заражения при контакте с больным очень высок.
Столбняк – крайне опасное бактериальное заболевание с высокой вероятностью смертельного исхода. Болезнь протекает стремительно, поражая нервную систему и вызывая сильные судороги, мышечный гипертонус и боль. Заражение столбняком чаще всего происходит через попадание возбудителя из почвы, воды, загрязненных предметов в рану, ожог или поврежденную слизистую.
Дифтерия и столбняк практически не поддаются лечению сверхсильными антибиотиками, и даже при успешном выздоровлении риск грозных осложнений очень велик. Обезопасить себя от заражения можно с помощью своевременной вакцинации АДСМ. Прививка во взрослом возрасте обеспечивает защиту на 10 лет.
Другие названия: вакцинация АДСМ, вакцинация АДС, прививка АДС, вакцинация от столбняка, вакцинация от дифтерии, прививка от столбняка, прививка от дифтерии
Кому и в каких случаях необходима прививка АДСМ?
Вакцинация АДСМ нужна всем, кто хочет обезопасить себя от столбняка и дифтерии. В детском возрасте прививка проводится планово дважды — в 7 и 14 лет. Взрослым людям с 18 лет необходимо самостоятельно повторять вакцинацию каждые 10 лет на протяжении всей жизни. Ограничений по возрасту нет.
Ограничений по возрасту нет.
Прививка АДСМ особенна необходима лицам с нарушенным режимом вакцинации — непривитым в детском возрасте, привитым однократно, а также в случаях, когда после последней вакцинации прошло более 20 лет.
Как проводится вакцинация от столбняка и дифтерии?
Прививка АДСМ ставится посредством инъекции строго внутримышечно. Подкожное введение вакцины чревато неэффективностью в связи с медленным попаданием препарата в кровь.
Чаще всего укол производится в верхнюю треть плеча. В некоторых случаях возможно введение вакцины в бедро или подлопаточную область.
Есть ли противопоказания к прививке?
Вакцина АДСМ хорошо переносится и крайне редко приводит к побочным реакциям. Тем не менее существуют общие и специфические противопоказания, о которых следует предварительно сообщить врачу.
К общим противопоказаниям относятся острые и хронические заболевания в стадии обострения, ВИЧ, туберкулез, беременность.
Противопоказаниями непосредственно к АДСМ будут являться тяжелые реакции на препарат и заболевания центральной нервной системы.
Какие документы понадобятся для проведения вакцинации от кори?
В центрах «Медкомиссии №1» для вакцинации понадобится только паспорт. При наличии возьмите с собой прививочный сертификат с информацией о проведенных прививках.
Куда и когда можно обратиться?
Сделать прививку АДСМ можно в любом удобном центре «Медкомиссия №1». Мы работаем в 8 районах Санкт-Петербурга и имеем все необходимые лицензии. В наших клиниках используются только проверенные безопасные вакцины, предоставляется консультация врача.
Почему стоит обратиться к нам?
Надежно — наши центры имеют все необходимые лицензии на данный вид услуг. Вакцинация проводится сертифицированными специалистами с большим опытом работы. Используется только высококачественные препараты.
Быстро – запись на услугу доступна по телефону и в онлайн режиме на сайте, где вы можете выбрать удобное время и ближайший филиал. Процедура вакцинации и консультация терапевта займет несколько минут.
Процедура вакцинации и консультация терапевта займет несколько минут.
Удобно – наши медицинские центры расположены в 8 районах Санкт-Петербурга и работают без выходных.
Получить консультацию или записаться на прием можно по телефону +7 (812) 380-82-54
Записаться на прием >>>
Вакцина АДС-М — многопрофильная клиника Чудо-Доктор в Москве
Наличие вакцин уточняйте у администраторов клиники.
Дифтерия (греч. διφθέρα — кожа), устар. дифтерит — инфекционное заболевание, вызываемое бактерией Corynebacterium diphtheriae (бацилла Лёффлера). Чаще всего поражает ротоглотку, но нередко затрагивает гортань, бронхи, кожу и другие органы.
Столбняк — это инфекционное заболевание, вызываемое бактерией Clostridium tetani, с острым характером течения и преимущественным поражением нервной системы.
Вакцина рассматривается как смесь компонентов, подвергнутых прохождению специальной обработки. Составляющие препарата не могут стать причиной тяжелой токсической реакции или спровоцировать инфекционное поражение.
Прививка АДС-М подстегивает иммунную систему на соответствующий ответ, в котором и заключается принцип ее действия. В результате человек обретает невосприимчивость к таким заболеваниям, как дифтерия и столбняк.
Симптомы инфекционного заболевания
Перечисленные инфекции относятся к разряду бактериальных патологий острого характера. Заболевший представляет угрозу для окружающих. В ситуации со столбняком заразиться реально и от животных. Дифтерия локализуется в области верхних дыхательных путей.
К числу клинических симптомов относятся следующие признаки:
- Увеличение температуры на фоне слабости и измененных размеров лимфатических узлов;
- Болезненные ощущения в горле, тканевый отек в зоне шеи, трудности при глотании;
- Гиперемия глоточной слизистой оболочки и увеличение миндалин;
- Налет на них, захватывающий прилегающие ткани.

При наступлении осложнений страдает сердце, наступает мышечный шейный паралич, нарушается функционирование нервной системы. При особых обстоятельствах не исключается летальный исход.
Когда делают прививку от дифтерии?
Вакцина АДС-М считается комплексной. Ее введение допустимо через 3 месяца с момента рождения ребенка. Клиническая картина столбняка разнится с таковой при дифтерии.
Как правило, больные ощущают:
- Температурное повышение и слабость;
- Мышечную напряженность и спастичность лица наряду с аналогичными симптомами в остальными частях тела;
- Проблемы с дыханием, заключенные в его затруднении;
- Дыхательные спазмы, приводящие к смертельному исходу.
Рассматриваемые заболевания наносят ущерб нервной системе. Их возбудители невосприимчивы к лечению даже сильнейшими антибактериальными средствами. Облегчить протекание инфекции или предотвратить ее поможет вовремя сделанная АДСМ прививка.
Она показана не только в детском возрасте. Возрастная принадлежность не служит препятствием для принятия профилактических мер, направленных на отведение угрозы заражения в любой момент.
Что за прививка АДС-М?
Формой выпуска вакцины является суспензия. Для нее характерен желто-белый оттенок. Все ампулы вмещают 1 мл вещества, соответствующий удвоенной дозе анатоксина.
Инструктивные материалы рекомендуют применять прививку, если:
- Планируется профилактика дифтерии и столбняка в детском возрасте с 6 лет;
- Необходимо вакцинировать взрослых, с момента последнего прививания которых прошло 20 лет;
- Требуется заменить АКДС и АДС, основываясь на детских реакциях и осложнениях;
- Нужно привить 4-летних детей, не получивших в свое время АКДС.
Прививка АДС-М взрослым и детям показана каждые 10 лет. Она формирует иммунитет на долгие годы.
Она формирует иммунитет на долгие годы.
Куда делают прививку АДС-М?
В соответствии с обновленными рекомендациями практикуется внутримышечное введение препарата в области передненаружной части бедра. Возможно подкожное глубокое инъецирование в подлопаточную зону.
Противопоказания для применения АДС-М
АДС-М прививка детям и взрослым не делается при наличии противопоказаний постоянного или временного свойства.
К числу первых относятся:
- Яркая реакция на вакцинацию указанным препаратом в прошлом;
- Осложнения после его введения.
Ко второй группе принадлежат:
- Беременность и кормление грудью;
- Обострение хронических состояний;
- Текущий инфекционный процесс;
- Аллергическая реакция;
- Продромальные явления с плохим самочувствием, суставной ломотой, слабостью.
Прививка разрешается спустя месяц после исчезновения признаков аллергии. В остальных случаях выдерживать паузу не требуется.
Люди, не привитые от инфекций, составляют группу риска. Они могут заразиться ими сами и инфицировать других, в особенности детей со слабым иммунитетом. Единовременная вакцинация АДС-М способна предотвратить возможную гибель человека от дифтерии и столбняка.
Преимущества вакцинации АДС-М в клинике «Чудо Доктор»
Обращение к врачу — терапевту с целью получения прививки сопровождается медицинским осмотром. В медицинском центре используются только те препараты, которые прошли сертификацию и подтвердили свое качество. Вакцина отличается высокой эффективностью с минимальными побочными явлениями.
Персонал клиники строго придерживается соблюдения правил при выполнении прививки от столбняка и дифтерии. Это обстоятельство исключает возникновение осложнений и побочных реакций на используемый препарат.
Специалисты «Чудо Доктор» помогут достигнуть максимального результата в деле сохранения здоровья. Вы не столкнетесь с неожиданными проблемами в будущем, вызванными такими серьезными заболеваниями.
Вы не столкнетесь с неожиданными проблемами в будущем, вызванными такими серьезными заболеваниями.
Подумайте о своем здоровье – заблаговременно пройдите вакцинацию!
О прививках. Как подготовить ребёнка к прививке?
Главная » Здоровье » О прививках. Как подготовить ребёнка к прививке?
Родители знают: уберечь свое чадо от инфекционных заболеваний в большом детском коллективе, будь то ясли, детский садик или школа, практически невозможно. Единственным средством защиты детей остаются прививки.
Цифры в календаре прививок означают лишь приблизительный возраст, с которого можно начинать вакцинацию. Но родителям всегда стоит помнить, что нужный момент подбирается индивидуально. Если у малыша есть отклонения в развитии (не только отставание, но и опережение) или противопоказания (аллергия и т.п.) лечащий врач может отойти от строгого графика.
Раньше срока делаются лишь прививки в случаях, если в группе детского садика или семье кто-то заболел заразной болезнью.
Отложить прививку необходимо, если ребенок только что перенес какое-либо инфекционное или вирусное заболевание. Нужно хорошенько долечить его и только тогда отправляться на прививку. Врачи советуют переждать как минимум месяц после выздоровления, а также воздержаться от плановых прививок во время эпидемий гриппа и ОРЗ.
Количество плановых прививок рассчитано на самый слабый иммунитет. Потому что практически у всех наших детей сегодня он именно такой. И даже еще слабее, потому что участились случаи заболевания привитых детей, чей организм не способен выработать необходимые антитела даже будучи специально спровоцированным вакциной. Правда, в случае заболевания привитый ребенок переносит его в несравнимо более легкой форме и никогда не погибает.
Вакцины не оказывают на организм ребенка по-настоящему вредного воздействия. Реакция на внесение в организм «заразы» хотя часто и пугает родителей (повышение температуры, краснота, припухлость и болезненность в месте прививки), но неизмеримо легче самой инфекции, против которой делается прививка.
Реакция на внесение в организм «заразы» хотя часто и пугает родителей (повышение температуры, краснота, припухлость и болезненность в месте прививки), но неизмеримо легче самой инфекции, против которой делается прививка.
Чем мы можем помочь нашему малышу, чтобы прививка подействовала с максимальной пользой? Уже за 5-7 дней до прививки постарайтесь отгородить ребенка от многочисленных сборищ – и не только детских. Не стоит вести его на рынок, запихивать в переполненный автобус и идти с ним на юбилей к любимой троюродной бабушке. Если ребенок часто страдает пищевой аллергией, придется несколько дней соблюдать диету, отказавшись от всех «запретных» лакомств. Накануне искупайте ребенка, ведь, как правило, несколько следующих дней ему придется обойтись без ванны. В день прививки измерьте ребенку температуру.
После прививки будьте повнимательнее к малышу. Его «обычные» капризы на этот раз могут быть вызваны недомоганием: побалуйте его ласками, но не лакомствами. Контролируйте температуру – ее повышение до38,5 градусов можно считать нормой. Она держится не дольше 2-3 дней и снижается без применения каких-либо лекарственных препаратов. Если состояние ребенка выходит за рамки обычного легкого недомогания, побалуйте его ласками, но не лакомством.
О профилактике поствакцинальных осложнений
Когда подходит время делать ребенку плановую прививку, у родителей возникает масса опасений и подозрений, касающихся ее безопасности. Как подготовить ребенка к вакцинации и в последствии отличить нормальную реакцию детского организма от негативной? Особенно эти вопросы волнуют родителей детей, страдающих хроническими заболеваниями.
Вакцинация — единственный способ защиты от ряда заболеваний, которые невозможно вылечить другими средствами или само лечение может вызвать осложнение (например, корь, дифтерия и пр.). Врожденной невосприимчивости к инфекционным заболеваниям, от которых существуют прививки — нет.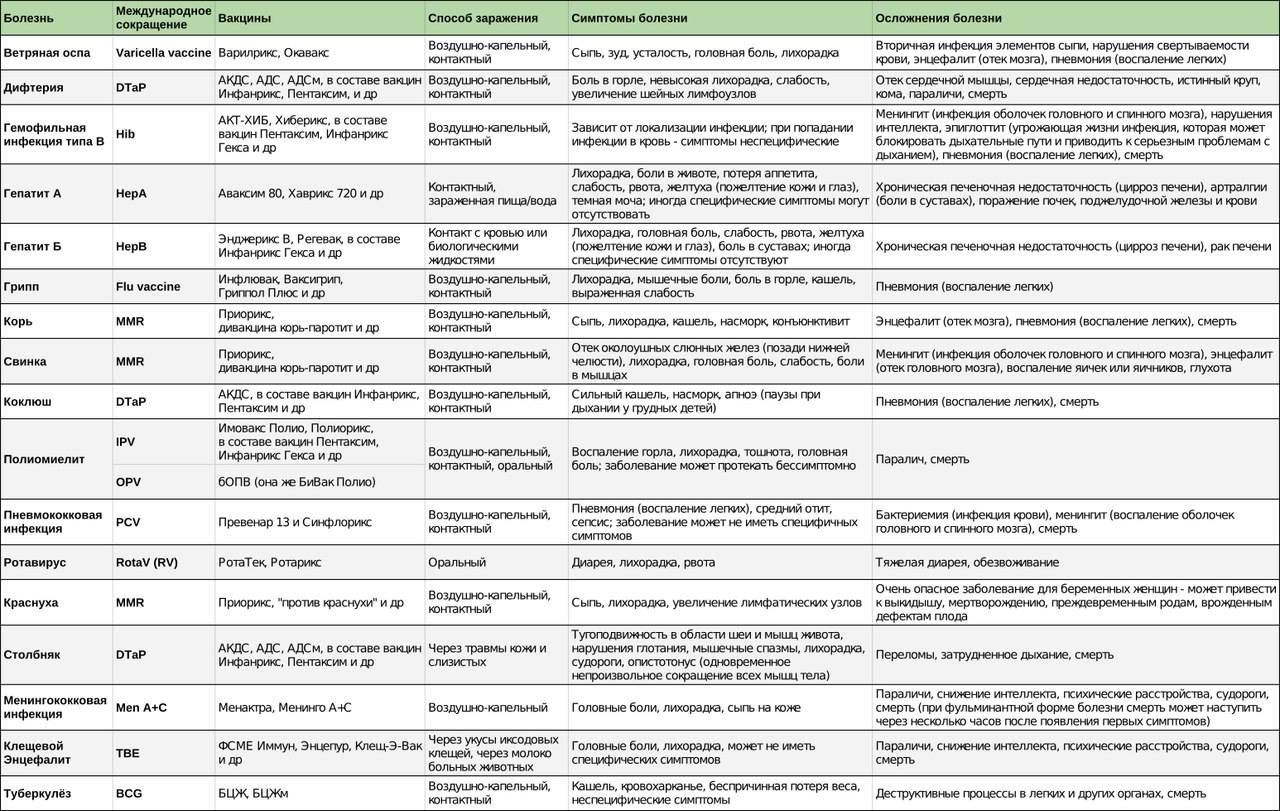 Если мама ребенка когда-то болела ими, то первые 3—6 месяцев жизни доношенный ребенок может быть защищен материнскими антителами, которые попали к нему через плаценту во время беременности и через грудное молоко. У недоношенных детей и детей на искусственном вскармливании такой защиты нет. Поскольку возможность заболеть из-за контактов с другими людьми велика, очень важно прививать малышей с самого раннего возраста.
Если мама ребенка когда-то болела ими, то первые 3—6 месяцев жизни доношенный ребенок может быть защищен материнскими антителами, которые попали к нему через плаценту во время беременности и через грудное молоко. У недоношенных детей и детей на искусственном вскармливании такой защиты нет. Поскольку возможность заболеть из-за контактов с другими людьми велика, очень важно прививать малышей с самого раннего возраста.
Как же подготовить малыша к прививке и попытаться свести к минимуму риск возникновения осложнений?
Сразу отметим, что здоровых детей не требуется специально готовить к прививке, нужно лишь предварительно измерить температуру тела (она должна быть нормальной, чаще 36,6 градусов С; у детей до 1 года нормальной температурой может быть 37,1—37,2 градусов за счет особенностей теплообмена, он повышен, не зря детей, которые уже ходят, бегают, рекомендуется одевать чуть холоднее, чем взрослых), привести ребенка к специалисту и ответить на его вопросы.
Некоторые врачи прибегают к практике назначения всем детям перед прививкой, так сказать профилактически, приема противоаллергических препаратов, например ТАВЕГИЛА, КЛАРИТИНА, ЗИРТЕКА. В действительности такой «поголовной» необходимости нет. Не все дети предрасположены к аллергии и соответственно не все нуждаются в таких лекарствах. Скорее это происходит из-за желания врача лишний раз подстраховаться или из-за того, что выявление детей группы риска по аллергии это более трудоемкий процесс. Но если ребенок склонен к аллергическим реакциям, то профилактическое применение противоаллергических препаратов оправдано. Например, такая ситуация, ребенок первого года жизни, ранее аллергия не проявлялась, прививается против коклюша, дифтерии, столбняка (АКДС).
Первая прививка (на первом году АКДС делается трижды) прошла без особенностей, но после второй прививки ребенку начали вводить новое питание, и у малыша появилась впервые аллергическая сыпь, значит, перед третьей прививкой следует профилактически дать ребенку противоаллергический препарат, чтобы высыпания не повторились. Для профилактики поствакцинальных осложнений врач должен, в первую очередь, оценить состояние здоровья ребенка перед прививкой. Выявить противопоказания к ней — временные и постоянные (например, выраженная аллергическая реакция на предыдущее введение подобной вакцины), и решить вопрос о необходимости назначения каких-либо предварительных дополнительных обследований и лекарственных препаратов. Перед прививкой врач (фельдшер) осматривает ребенка, измеряет температуру (она должна быть нормальной — 36,6 градусов С), подробно расспрашивает родителей о жизни ребенка, перенесенных им заболеваниях и прочее. Родители, в свою очередь, должны проинформировать врача о всех особенностях и проблемах здоровья своего малыша.
Для профилактики поствакцинальных осложнений врач должен, в первую очередь, оценить состояние здоровья ребенка перед прививкой. Выявить противопоказания к ней — временные и постоянные (например, выраженная аллергическая реакция на предыдущее введение подобной вакцины), и решить вопрос о необходимости назначения каких-либо предварительных дополнительных обследований и лекарственных препаратов. Перед прививкой врач (фельдшер) осматривает ребенка, измеряет температуру (она должна быть нормальной — 36,6 градусов С), подробно расспрашивает родителей о жизни ребенка, перенесенных им заболеваниях и прочее. Родители, в свою очередь, должны проинформировать врача о всех особенностях и проблемах здоровья своего малыша.
О чем необходимо сказать врачу:
- Не повышалась ли температура в дни, предшествующие вакцинации? Не было ли каких-либо других признаков нездоровья, например, кашля, чихания, насморка, которые могут свидетельствовать о начале заболевания?
- Имеются ли у ребенка какие-либо хронические заболевания и не получает ли он в связи с этим постоянно лекарственные препараты, если да, то какие?
- Не было ли ранее судорог, выраженных аллергических реакций на пищу, лекарства и пр.?
- Необходимо рассказать, как ребенок переносил предыдущие прививки, повышалась ли у него температура, ухудшалось ли самочувствие и др.
- Не рекомендуется делать прививки сразу после возвращения из длительной поездки, особенно, если резко менялся климат, так как это создает условия для заболеваний.
- Необходимо сказать, получал ли ребенок в последние три месяца препараты, изготовленные на основе крови, или производилось ли переливание крови. Это влияет на сроки последующей вакцинации против кори, краснухи и паротита, они увеличиваются, т.к. препараты крови содержат готовые антитела — специфические защитные белки крови против указанных инфекций, которые «мешают» ребенку активно выработать иммунитет самому.

Если при осмотре перед прививкой врач делает заключение, что ребенок практически здоров, проводится прививка.
Когда и как прививают больных детей?
Если у ребенка имеются заболевания, находящиеся в настоящее время вне обострения и ему нужно сделать прививку, то к мерам профилактики, проводимым у здоровых детей, добавляются предварительные обследования. Решается вопрос о необходимости назначения различных препаратов за 3—4 дня до проведения прививки и на весь период после процесса: 3—5 дней после введения неживых, химических вакцин и т.д., и 14 дней при использовании живых вакцин. В своих прошлых публикациях мы указывали на возможность развития осложнений после прививок . Их профилактика включает еще целый комплекс мероприятий, к которым относится соблюдение техники вакцинации, назначение в ряде случаев до прививки и после лекарственных средств, помогающих избежать осложнений, определенный режим и питание ребенка, патронаж (специальное наблюдение) после вакцинации. Медицинские работники навещают привитого ребенка на дому или узнают о состоянии его здоровья по телефону, чтобы не пропустить ситуации осложнения, развившиеся после прививки.
Какие признаки могут указать на неврологические проблемы ребенка при осмотре перед прививкой?
У маленьких детей — напряжение, выбухание большого родничка в вертикальном положении, расширение подкожных вен головы, частые срыгивания, излишние движения языка, повышение мышечного тонуса рук и ног, тремор (мелкое дрожание) подбородка и рук в спокойном состоянии, нарушение сна и пр. Перечисленные признаки могут свидетельствовать о повышенном внутричерепном давлении. Чрезмерно быстрый рост головы, увеличение размеров большого родничка, вместо его сокращения и другие признаки могут свидетельствовать о гидроцефальном синдроме — избыточном накоплении мозговой жидкости в желудочках мозга и других внутричерепных пространствах.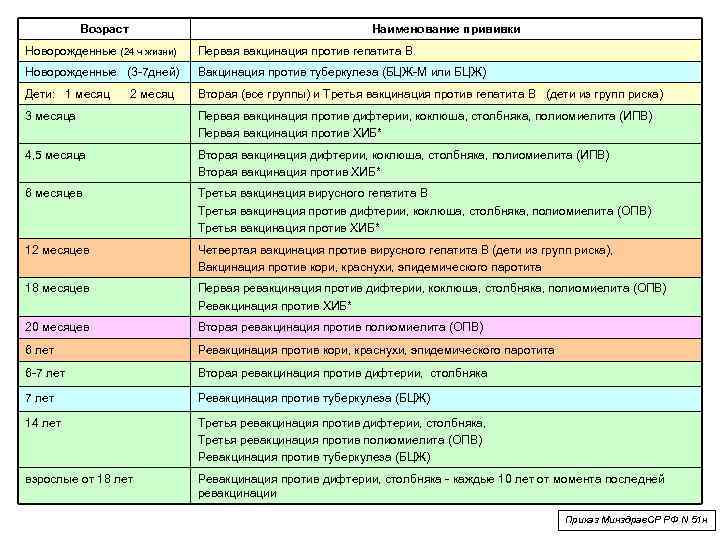 Эти и другие заболевания нервной системы выявляет и описывает при плановом осмотре детей до 3-х месяцев невролог.
Эти и другие заболевания нервной системы выявляет и описывает при плановом осмотре детей до 3-х месяцев невролог.
Для подтверждения или исключения патологии проводят дополнительные исследования, например, ультразвуковое исследование головного мозга — нейросонографию, когда датчик аппарата устанавливается на большом родничке и на экране отображается картина строения мозга. Многие педиатры, неврологи склонны настороженно относиться к вакцинации детей с неврологическими проблемами из-за боязни усугубить течение патологии в поствакцинальном периоде. Это не правильно, так как инфекция, от которой проводится прививка, гораздо более опасна для ребенка с поражением нервной системы. Например, коклюш у таких детей, особенно в возрасте до года может вызывать тяжелые поражения мозга, судороги и прочее. К сожалению, иногда о поражении нервной системы начинают думать уже после прививки, которая спровоцировала временные ухудшения в работе этой системы. Поэтому основным средством предупреждения поствакцинальных осложнений со стороны нервной системы является своевременное выявление неврологической патологии у новорожденного, ее лечение и проведение прививок на фоне медикаментозной терапии или по ее окончании.
Какие медикаментозные средства обычно применяют при подготовке к иммунизации детей с неврологическими проблемами?
Детям с повышенным внутричерепным давлением и гидроцефальным синдромом, назначают мочегонные средства (в том числе травы), препараты, улучшающие кровоток и обмен веществ в мозговой ткани. Курсы терапии повторяют 2-3 раза в год, в эти же периоды может быть проведена иммунизация ребенка. Если прививкуделают после завершения лечения, то желательно в момент иммунизации снова провести короткий курс ранее применявшихся средств (мочегонных, успокоительных и т.п.). Если у ребенка были судороги, вызванные повышенной температурой, прививкиможно проводить не ранее, чем через 1 месяц после приступа. До и после прививки назначают противосудорожные, и иногда мочегонные лекарства. Детям, перенесшим судороги, причиной которых являлась температура выше 38,0 градусов С, в дальнейшем можно делать все прививки. Если судороги были на фоне температуры менее 38,0 градусов С, то не вводят коклюшную вакцину, входящую в состав комплексной вакцины против коклюша, дифтерии, столбняка (АКДС). Остальные вакцины могут быть использованы. Всем детям, ранее имевшим судороги или предрасположенным к ним, после прививки назначают и жаропонижающие препараты, так как вакцины могут вызвать высокую температуру и снова провоцировать судороги.
До и после прививки назначают противосудорожные, и иногда мочегонные лекарства. Детям, перенесшим судороги, причиной которых являлась температура выше 38,0 градусов С, в дальнейшем можно делать все прививки. Если судороги были на фоне температуры менее 38,0 градусов С, то не вводят коклюшную вакцину, входящую в состав комплексной вакцины против коклюша, дифтерии, столбняка (АКДС). Остальные вакцины могут быть использованы. Всем детям, ранее имевшим судороги или предрасположенным к ним, после прививки назначают и жаропонижающие препараты, так как вакцины могут вызвать высокую температуру и снова провоцировать судороги.
При наличии у ребенка эпилепсии, вакцинация также осуществляется не ранее, чем через 1 месяц после приступа, без коклюшной вакцины, на фоне противосудорожной терапии. При тяжелых формах эпилепсии вопрос о прививках решается индивидуально с врачом невропатологом. Дети с непрогрессирующими поражениями нервной системы (хромосомные, генетические заболевания, врожденные аномалии развития, детский церебральный паралич и т.п.), психическими заболеваниями вне острого периода, с умственной отсталостью и перенесшие воспалительные заболевания нервной системы не имеют противопоказаний к прививкам. Их вакцинируют с использованием симптоматической (применяемой при лечении конкретного заболевания) терапии или не назначают лекарств совсем.
Прививки и аллергические заболевания
Достаточно частой патологией на первом году жизни и в более старшем возрасте являются аллергические заболевания: пищевая аллергия, бронхиальная астма и т.п. Прививки в таком случае проводят не ранее 1 месяца после завершения обострения. Основными принципами профилактики осложнений после вакцинации у этой группы детей является — режим питания (особенно для детей с пищевой аллергией), исключающий введение новых продуктов за 5-7 дней до и после прививки. На новую пищу у них возможна аллергическая реакция, которую родители и врач ошибочно будут трактовать как реакцию на вакцину. Так же исключаются аллергены, на которые ребенок заведомо дает аллергические реакции. Например, ребенка с аллергией на пыльцу какого-либо растения не прививают, когда оно цветет.
На новую пищу у них возможна аллергическая реакция, которую родители и врач ошибочно будут трактовать как реакцию на вакцину. Так же исключаются аллергены, на которые ребенок заведомо дает аллергические реакции. Например, ребенка с аллергией на пыльцу какого-либо растения не прививают, когда оно цветет.
До и после прививки могут быть назначены противоаллергические препараты, препараты, содержащие бифидо- и лактобактерии. Они благотворно влияют на микрофлору кишечника, так как при аллергических заболеваниях часто происходит ее нарушение. Детям с бронхиальной астмой, постоянно получающим ингаляционные препараты, в том числе и гормональные, это лечение не отменяется, а продолжается.
Вакцинация часто болеющих детей
При иммунизации детей, страдающих частыми респираторными заболеваниями, хроническими заболеваниями ЛОР — органов (уши, гортань, нос), повторными бронхитами, пневмониями, наиболее частой проблемой является развитие респираторных и других инфекций в поствакцинальном периоде. Предрасполагают к возникновению частых заболеваний особенности иммунной системы ребенка. Не у всех детей в одно время «созревают» иммунные реакции, поэтому одни являются более, а другие — менее восприимчивыми к инфекциям. Способствует заболеваниям и стрессовая ситуация, например, когда ребенок не комфортно себя чувствует в детском учреждении и находится в состоянии хронического стресса.
В какой-то мере к стрессу можно отнести и прививку. Для профилактики таких заболеваний до и после вакцинации назначают общеукрепляющие средства (витамины, растительные и гомеопатические средства) или противовирусные препараты, изготовленные на основе крови человека (ИНТЕРФЕРОН) или синтетический интерферон (ВИФЕРОН) и пр., а также, препараты, способные моделировать иммунитет (РИБОМУНИЛ, ПОЛИОКСИДОНИЙ и др.).
Как готовят к прививке старших дошкольников с хроническими заболеваниями?
У более старших детей после прививки могут обостриться уже диагностированные хронические заболевания эндокринной системы, соединительной ткани, крови и кроветворных органов, почек, печени, сердца и др. Основной принцип иммунизации таких детей — прививать не ранее, чем через 1 месяц после окончания обострения и осуществлять профилактику обострений после прививки. Детям с хроническими заболеваниями проводят минимальное лабораторное обследование (например, анализы мочи при болезнях почек). Если анализы в норме, то ребенка прививают на фоне противорецидивной терапии, которую назначают за 3-5 дней до и на 7-14 дней после прививки. Рекомендуется провести контрольные лабораторные обследования через 7, 14 и 30 дней после прививки (анализы мочи, крови и др.). Такое обследование позволяет быть уверенным в достаточности медикаментозной терапии, которую получал ребенок в момент прививок. Если в анализах выявляются изменения, характерные для обострения хронического заболевания, то последующие прививки проводят после нормализации состояния на фоне более интенсивного лечения. Вот такая непростая последовательность комбинаций требуется для прививания заведомо нездорового малыша.
Основной принцип иммунизации таких детей — прививать не ранее, чем через 1 месяц после окончания обострения и осуществлять профилактику обострений после прививки. Детям с хроническими заболеваниями проводят минимальное лабораторное обследование (например, анализы мочи при болезнях почек). Если анализы в норме, то ребенка прививают на фоне противорецидивной терапии, которую назначают за 3-5 дней до и на 7-14 дней после прививки. Рекомендуется провести контрольные лабораторные обследования через 7, 14 и 30 дней после прививки (анализы мочи, крови и др.). Такое обследование позволяет быть уверенным в достаточности медикаментозной терапии, которую получал ребенок в момент прививок. Если в анализах выявляются изменения, характерные для обострения хронического заболевания, то последующие прививки проводят после нормализации состояния на фоне более интенсивного лечения. Вот такая непростая последовательность комбинаций требуется для прививания заведомо нездорового малыша.
Но все же следует помнить о том, что инфекция, в плане обострения хронического заболевания много опаснее, чем возможность минимальных, крайне редко встречающихся, контролируемых обострений при вакцинации. Кроме того, детям с любыми хроническими заболеваниями рекомендуется проводить дополнительные прививки (помимо плановых) против гемофильной инфекции типа В, менингококковой, пневмококковой инфекций, гриппа. После прививки, и в последующие дни, родителям следует обращать внимание на состояние ребенка.
Первые три дня рекомендуется измерять температуру, особенно после прививкипротив коклюша, дифтерии и столбняка (АКДС, Тетракок). Если состояние не изменилось и не ухудшилось, т.е. малыш весел, бодр, у него хороший аппетит, спокойный сон и пр., то его режим жизни менять не нужно. Продолжайте как обычно, кормить, купать ребенка, гулять с ним. Единственно — следует ограничить общение с чихающими, кашляющими людьми, и детьми, чтобы ребенок не имел шансов заразиться. С этой же точки зрения не желательно путешествовать с ребенком сразу после прививки.
С этой же точки зрения не желательно путешествовать с ребенком сразу после прививки.
Если родителям необходимо куда-то уезжать с малышом, следует подумать о прививках заранее, за 1-2 недели до отъезда. За это время успеют выработаться антитела на введенную вакцину и успеют проявиться нежелательные эффекты от прививки, если им суждено быть. В дороге или в чужом городе может оказаться сложнее оказать медицинскую помощь ребенку.
Что же делать, если после прививки повысилась температура, ухудшилось общее состояние малыша?
Следует воздержаться от купания и прогулок. Сообщите о нарушении состояния ребенка медицинской сестре, которая проводит патронаж после прививки или врачу. Дайте жаропонижающие средства в возрастной дозировке: для детей, перенесших ранее судороги — сразу же при любой повышенной температуре (даже если это 37,1 градусов С), для остальных — при температуре выше 38,5 градусов С. Своевременное обращение к врачу позволит выяснить, с чем связана температура — с обычной реакцией на вакцину, случайным заболеванием или с чем-либо еще.
Правильно поставленный диагноз — залог безопасности дальнейшей вакцинации. Помните, что в месте введения всех вакцин может появиться краснота и уплотнение, которые должны пройти через 1-3 дня. Если уплотнение, покраснение держится дольше 4 дней или его размеры более 5-8 см, необходимо обязательно проконсультироваться у врача.
Можно ли делать прививку в специальном центре?
Любого ребенка, а тем более, страдающего каким-либо заболеванием можно прививать в специализированных центрах иммунопрофилактики (филиалы таких центров могут существовать и в участковых поликлиниках), под наблюдением врачей иммунологов. Они составят индивидуальный график прививок, подберут оптимальный тип вакцины для конкретного малыша и пр. Такие меры позволят свести к минимуму риск развития поствакцинальных осложнений и создать эффективную защиту организма от тяжелых и опасных инфекций.
Исключение из правил
Известно, что детям во время острого заболевания или обострения хронического, плановые прививки не проводят. Вакцинацию откладывают до выздоровления или завершения обострения хронического процесса. Однако, если возникает экстренная ситуация, когда нужно привить нездорового ребенка, это может быть сделано (вакцинация по экстренным показаниям). Например, ребенок болен ОРВИ, или у него обострилось хроническое заболевание, и при этом он общался с больным дифтерией или его укусила собака и т.д. В таких случаях противопоказаниями к вакцинации можно пренебречь, чтобы по жизненно важным обстоятельствам срочно привить ребенка.
Прививка от Covid-19: мои побочные эффекты, откуда они и что они значат
- Джеймс Галлахер
- Корреспондент Би-би-си по вопросам науки и здравоохранения
Подпись к фото,
Джеймс Галлахер на себе прочувствовал сильные побочные эффекты от прививки
Можно сказать, что я был на седьмом небе, когда настал мой черед получить прививку от Covid-19. Я писал о пандемии с самого начала, еще тогда, когда число зараженных ограничивалось несколькими десятками жителей Уханя, когда рассказывал о том, как разные страны пытались наперегонки разработать свою вакцину.
Поэтому, когда настал мой черед закатать рукав во врачебном кабинете, я чувствовал себя как марафонец, добравшийся наконец до финиша.
Но, и я буду с вами предельно откровенен, вакцина с легкостью положила меня на обе лопатки. Скажу сразу, что даже если бы я заранее знал, как мне будет плохо, я бы все равно сделал прививку. Уж лучше побочные эффекты, нежели ковид или еще год карантина. Или, что гораздо страшнее, повышенный шанс заразить кого-то из родных и близких.
Первую дозу вакцины AstraZeneca мне вкололи в 9.30 утра. К вечеру мое самочувствие ухудшилось до такой степени, что последующие три дня я с огромным трудом выбирался из постели.
Самыми неприятными симптомами были мигрень и рвота, к которым добавились боль во всем теле, сильный озноб и полное отсутствие каких бы то ни было сил.
Разумеется, прикованный к одру болезни я скорбно вопрошал: «Почему я?»
Оправившись, я задался вопросом: почему для кого-то прививка проходит бесследно, а кому-то, как мне, приходится страдать и мучиться? И означают ли эти страдания, что моя иммунная система выработала супер сильную защиту от вируса? И вот что мне удалось выяснить.
Откуда берутся побочные эффекты?
Автор фото, Getty Images
Подпись к фото,
В Британии работает множество больших и малых центров вакцинации, для которых используются самые разные помещения. Этот центр, например, оккупировал один из клубов регби
Любая вакцина, в том числе и от Covid-19, занимается тем, что дурит наш организм, заставляя его думать, что он сражается с настоящим коронавирусом. Обманутый организм включает иммунную систему, приказывая ей срочно начать борьбу с очередной инфекцией.
Первым делом вам могут грозить не слишком приятные ощущения конкретно в месте укола: допустим, это небольшая припухлость и не слишком сильная боль, что означает, что ваша иммунная система стала набирать обороты.
Дальнейшие эффекты могут уже распространиться на все остальные части тела, вызывая гриппозные симптомы, в том числе повышенную температуру, озноб и тошноту.
Профессор иммунологии из Эдинбургского университета Эленор Райли сказала мне, что все эти ощущения вызваны реакцией на воспалительные процессы.
Вакцина — это своего рода биохимическая пожарная тревога, которая дует во все трубы и звонит во все колокола, сообщая нам о том, что в организме что-то не так.
«Вакцина мобилизует иммунную систему, которая отправляет свои клетки непосредственно к месту укола, чтобы они на месте разобрались, что же там происходит», — говорит профессор Райли.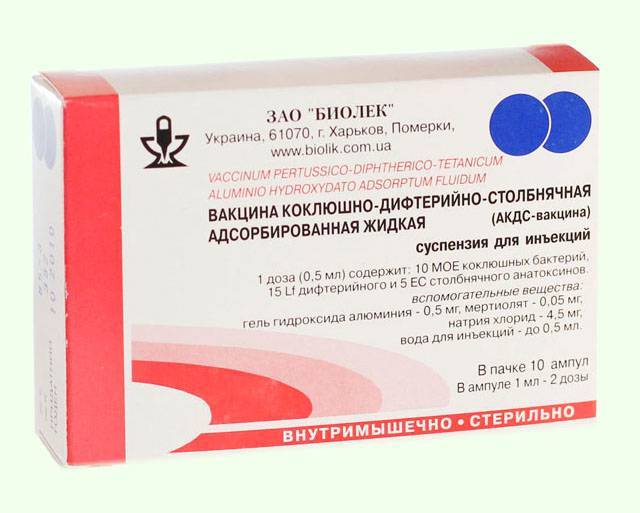
Вот эти-то самые клетки и вызывают болезненные симптомы.
Почему у кого-то сильные побочные эффекты, а у кого-то нет?
Автор фото, Getty Images
Подпись к фото,
Профессор Эндрю Полларж свою прививку тоже получил.
Почему у кого-то сильные побочные эффекты, а у кого-то нет?
Хотя механизм воздействия вакцины на организм всегда один и тот же, сила побочных эффектов очень сильно варьируется.
Кто-то вообще ничего не заметит, кто-то может впасть в сонливость, но не настолько сильную, чтобы нельзя было работать, ну а кому-то придется пересидеть (вернее, перележать) это дело в постели.
«Джеймс, — сказал мне профессор Эндрю Поллард, возглавлявший клинические испытания вакцины AstraZeneca, — самым важным фактором в твоем случае является возраст. Чем старше человек, тем легче он переносит прививку. У тех, кому за 70, побочных эффектов практически нет вообще». Мне, кстати, за 30.
Допустим. Но почему тогда побочные эффекты разнятся у людей одного возраста? Профессор Райли считает, что в основе широкого спектра побочных эффектов лежит огромное генетическое разнообразие наших иммунных систем.
«Это значит, что чья-то иммунная система склонна нестись на всех порах и реагировать на раздражители гораздо агрессивнее. Люди, у которых, как и у тебя, побочные эффекты превращаются в реалистичное подобие гриппа, являются счастливыми обладателями организма, склонного к слишком быстрой и сильной реакции. Не исключено, что ты входишь в группу тех, у кого грипп и простуда тоже протекают особенно тяжело».
Кроме того, у иммунной системы хорошая память, и если ей ранее приходилось бороться с каким-то другим коронавирусом, то она уже знает, что делать, и стреляет сразу изо всех стволов.
Означает ли моя реакция на прививку более сильную защиту?
Автор фото, Getty Images
Подпись к фото,
Центром вакцинации стал и собор в Солсбери
Я надеялся, несколько эгоистично, что мои сильные побочные эффекты означают и более сильную, а следовательно и более полезную реакцию иммунной системы. И да, в прошлом были прецеденты, когда прослеживалась именно такая связь. Как отметил профессор Поллард: «Такие примеры есть. Например, во время эпидемии гриппа в 2009 году сильные побочные эффекты означали и более сильную иммунную реакцию».
И да, в прошлом были прецеденты, когда прослеживалась именно такая связь. Как отметил профессор Поллард: «Такие примеры есть. Например, во время эпидемии гриппа в 2009 году сильные побочные эффекты означали и более сильную иммунную реакцию».
Но вот с ковидной вакциной этот номер не проходит: есть ли у вас побочные эффекты, или нет, но все получают примерно одинаковое количество антител. Пожилые люди, для которых вакцинация проходит практически без каких бы то ни было неприятных ощущений, получают точно такую же защиту, как и те, кого прививка укладывает в постель.
Объяснить этот феномен можно, если рассмотреть, как взаимодействуют две части иммунной системы.
Первая — это, так называемый, врожденный иммунитет, способность организма обезвреживать непрошенных гостей даже в том случае, если они ему раньше не попадались. Вторая — иммунитет приобретенный, при котором наше тело сначала учится как бороться с конкретной опасностью, а потом это запоминает.
Иммунная система синтезирует особые В-лимфоциты, которые производят антитела для поиска и последующего уничтожения вирусов, также, как и Т-лимфоциты, они же Т-клетки, которые атакуют любую часть нашего собственного тела, пораженную инфекцией.
Профессор Райли объясняет, что варьирующимся фактором является именно врожденный иммунитет, который зависит от возраста, а также отличается у разных людей. Он и определяет силу побочных эффектов.
«Чтобы разбудить приобретенный иммунитет, и получить полный набор В- и Т-лимфоцитов, требуется очень незначительное вмешательство врожденного иммунитета, который у всех разный», — говорит он.
Будет ли мне так же плохо и после второй прививки?
Автор фото, Getty Images
Подпись к фото,
Премьер-министр Борис Джонсон тоже активно включился в агитацию за необходимость прививок. Впрочем, сомневающихся и отказывающихся в Британии довольно мало
Совершенно логично предположить, что, если мой первый опыт был насколько неприятным, то на горизонте маячит вторая порция таких же удовольствий. Но меня уверили, что это будет совсем не так страшно.
Но меня уверили, что это будет совсем не так страшно.
«Вторая доза будет совершенно безобидной, успокоил меня профессор Поллард. — Она вовсе не такая сильная, как первая». Но это касается только разработанной в Оксфорде вакцины Astra-Zenica.
Поллард предупредил, что, по некоторым данным, вторая доза вакцины Pfizer может вызвать несколько более сильные побочные эффекты, чем доза первая.
А надо ли вообще обсуждать побочные эффекты?
Автор фото, Getty Images
Подпись к фото,
На всякий случай британских граждан после прививки просят подождать 15 минут, чтобы удостовериться, что они будут чувствовать себя достаточно хорошо, чтобы благополучно добраться до дома. На знаке надпись: «Место, где можно прийти в себя после вакцинации»
Новостные бюллетени полны разговоров о том, что у очень небольшого числа людей разработанная в Британии вакцина может вызвать образование тромбов.
Еще до начала широкомасштабной программы вакцинации я говорил о том, насколько опасно делать скоропалительные выводы о том, что проблемы, случившиеся после прививки, ею же и вызваны.
Европейское агентство лекарственных средств уже подтвердило: нет никаких показателей, что вакцинация вызывает образование тромбов.
Но другие побочные эффекты есть, и они вполне реальны. По словам того же Полларда, о них следует говорить открыто и честно.
«Если с самого начала вам скажут, что, да, вы вполне можете почувствовать себя отвратительно, как Джеймс Галлахер, но это — не опасно, а просто не слишком приятно, то вы просто примите парацетамол и перетерпите пару дней, — говорит Поллард. — Но если подобные ощущения свалятся на вас неожиданно, беспокойство вам обеспечено».
Можно ли предотвратить или лечить?
Препараты от ВИЧ значительно улучшили качество жизни людей, живущих с ВИЧ и СПИДом, но они пока не могут вылечить инфекцию. Кто-то из группы высокого риска заражения ВИЧ может принять таблетки, чтобы предотвратить инфекцию, но им придется принимать по одной каждый день. Этот метод, называемый ПрЭП, не эффективен на 100%.
Этот метод, называемый ПрЭП, не эффективен на 100%.
Вот почему исследователи работают над созданием вакцины против ВИЧ.
Вакцина предотвращает или контролирует конкретную инфекцию, обучая иммунную систему организма бороться с ней.За прошедшие годы ученые создали вакцины от болезней, включая брюшной тиф, корь, полиомиелит, грипп и оспу. На поиск вакцины против ВИЧ было потрачено больше денег, чем на любую другую вакцину в истории.
Хотя с момента открытия вируса прошли десятилетия, у нас до сих пор нет вакцины от него. Почему? Его разработка — почти всегда долгий процесс. Впервые вирус полиомиелита был идентифицирован в 1908 году, но только в 1955 году первая вакцина была одобрена!
Продолжение
Вакцина против ВИЧ еще сложнее, потому что:
- Существует множество типов ВИЧ, и постоянно появляются новые.
- У ВИЧ есть хитрые способы «перехитрить» иммунную систему.
- Ученые до сих пор не до конца понимают, какие части иммунной системы работают против ВИЧ.
Несмотря на сложные проблемы, многие исследователи надеются на перспективы вакцины против ВИЧ.
Два вида вакцин
Профилактическая вакцина научит вашу иммунную систему «распознавать» и бороться с ВИЧ до того, как вирус вызовет инфекцию и заставит вас заболеть. Они предназначены для людей с отрицательным результатом на ВИЧ.Когда-нибудь вакцина сможет предотвратить заражение ВИЧ у всех, большинства или некоторых людей.
Профилактическая вакцина не может заразить вас ВИЧ, так как не содержит живых вирусов. Но это может побудить вашу иммунную систему вырабатывать антитела, которые обнаружатся в анализе крови и дадут ложноположительный результат.
Терапевтическая вакцина поможет контролировать инфекцию и замедлить прогрессирование болезни. Они работают, усиливая вашу иммунную систему, чтобы находить и уничтожать ВИЧ-инфицированные клетки, а также предотвращая или ограничивая создание копий самого себя. Их тестируют на людях, которые уже ВИЧ-положительны, но имеют здоровую иммунную систему.
Их тестируют на людях, которые уже ВИЧ-положительны, но имеют здоровую иммунную систему.
Тестирование вакцин и клинические испытания
Сначала вакцины против ВИЧ тестируются в лабораториях и на животных. Тогда на одну вакцину против ВИЧ могут потребоваться годы тестирования на людях, прежде чем она станет приемлемой для населения.
Вакцина для предотвращения ВИЧ обычно проходит три фазы клинических испытаний для проверки ее безопасности и эффективности. Предполагается, что люди на всех трех этапах продолжают практиковать безопасный секс.Это , а не , которые намеренно заразились ВИЧ после вакцинации.
Каждая фаза должна пройти хорошо, чтобы перейти к следующей.
- Фаза I длится от 12 до 18 месяцев. Небольшое количество здоровых, ВИЧ-отрицательных добровольцев помогает исследователям проверить безопасность и определить оптимальные дозы.
- Фаза II может длиться до 2 лет. Сотни здоровых, ВИЧ-отрицательных добровольцев помогают исследователям улучшить дозировку и проверить, насколько хорошо реагирует иммунная система.
- Фаза III может длиться от 3 до 4 лет с участием тысяч здоровых, ВИЧ-отрицательных добровольцев.
Положительные признаки
Некоторые люди не заражаются ВИЧ, даже после того, как они уже более одного раза заразились им. Похоже, что другие инфицированные не страдают от болезни в течение десяти или более лет. Эти примеры показывают, что некоторые иммунные системы способны бороться с ВИЧ.
Продолжение
В исследованиях в пробирках редкие антитела действительно работают против ВИЧ.
Вакцины успешно защитили обезьян от родственника ВИЧ. Даже когда вакцины не защищали обезьян полностью, они позволяли им жить намного дольше.В разработке находится более 100 вакцин, и, по крайней мере, две в настоящее время находятся на поздней стадии, в стадии проведения многонациональные клинические испытания вакцин.
Выяснение того, что работает в этих случаях, может дать ключ к разгадке процесса разработки вакцины против ВИЧ.
Разработка вакцины против ВИЧ-инфекции
ОСНОВНЫЕ МОМЕНТЫ
- Исследователи работали над вакциной против ВИЧ с 1980-х годов, но прогресс в создании эффективной вакцины был намного медленнее, чем предполагалось.
- Поиск хотя бы частично эффективной вакцины по-прежнему имеет решающее значение для противодействия ВИЧ.
- Наибольшее сокращение числа новых инфекций будет достигнуто за счет комбинации PrEP, универсального антиретровирусного лечения для людей, уже живущих с ВИЧ, и вакцины.
- Вакцина против ВИЧ — более реалистичная перспектива сегодня, чем десять лет назад, и оптимистичный прогноз доступности вакцины против ВИЧ заключается в том, что она может быть доступна к 2030 году.
Изучите эту страницу, чтобы узнать больше о необходимости вакцины против ВИЧ, проблемах в разработке вакцины, прогрессе в разработке вакцины и создании эффективной вакцины против ВИЧ.
Что такое вакцина против ВИЧ?
Сегодня эффективной вакцины против ВИЧ не существует. Вакцина, которая может предотвратить инфекцию, научит иммунную систему реагировать на ВИЧ, вырабатывая антитела, которые могут связываться с вирусом и не давать ему инфицировать клетки, или путем стимулирования других иммунных реакций, убивающих вирус.
Ни одна вакцина не эффективна на 100%, как и в случае с ВИЧ. Некоторые люди, получившие вакцину, не будут достаточно сильно реагировать на вакцину и не будут защищены, как в случае вакцины против сезонного гриппа . Но поиск хотя бы частично эффективной вакцины по-прежнему имеет решающее значение для противодействия ВИЧ, поскольку все успешные стратегии ликвидации болезни включают вакцину в свой арсенал.
По оценкам ЮНЭЙДС, 1,8 миллиона человек заразились ВИЧ в 2017 году, 36,9 миллиона человек жили с ВИЧ и 21,7 миллиона получали антиретровирусную терапию. Несмотря на резкое улучшение доступа к антиретровирусной терапии и свидетельства того, что в некоторых регионах мира расширение масштабов лечения привело к сокращению числа новых случаев инфицирования ВИЧ, все еще существует потребность в вакцине против ВИЧ.
Модель, разработанная Международной инициативой по вакцине против СПИДа, показала, что даже если цели ЮНЭЙДС по расширению масштабов лечения будут достигнуты к 2020 году, вакцина, остановившая 70% инфекций, сократит количество новых инфекций на 44% в первые 10 лет после прогнозируемого внедрение в 2027 году. К 2070 году вакцина с эффективностью 70% снизит количество новых инфекций на 78%.
Модель также обнаружила, что вакцина с эффективностью 70% будет иметь большее влияние на новые инфекции, чем доконтактная профилактика (PrEP).Наибольшее сокращение числа новых инфекций будет достигнуто за счет комбинации PrEP, универсального антиретровирусного лечения для людей, уже живущих с ВИЧ, и вакцины.
В этом исследовании предполагалось, что вакцина обеспечит защиту только на пять лет, прежде чем людям понадобится повторная вакцинация. Стоимость введения такой вакцины все равно будет значительно ниже, чем стоимость лечения PrEP или ВИЧ. За счет предотвращения новых инфекций и снижения затрат на профилактику вакцина против ВИЧ повысит устойчивость противодействия ВИЧ.
Другое модельное исследование показало, что вакцина с 50% -ной эффективностью окажет наибольшее влияние на восток и юг Африки. Даже если все эти страны достигнут целей ЮНЭЙДС по расширению масштабов лечения к 2020 году, внедрение вакцины предотвратит примерно 7 миллионов новых случаев инфицирования к 2035 году.
Исследователи работали над вакциной против ВИЧ с 1980-х годов, но прогресс в создании эффективной вакцины был намного медленнее, чем предполагалось.
Большинство вакцин против других заболеваний стимулируют выработку антител, которые «нейтрализуют» вирусную инфекционность, но в случае ВИЧ нейтрализующие антитела не устраняют инфекцию.Это связано с тем, что ВИЧ так быстро воспроизводится и мутирует так быстро, что антитела, вырабатываемые против вируса, быстро становятся неэффективными против новых вирусов. Ежедневно производятся миллионы новых вирусов, каждый из которых немного отличается от вирусов предыдущих поколений. Антитела против ВИЧ могут быть эффективными только в том случае, если они могут связываться с участками вируса, которые мало различаются между вирусами.
Антитела против ВИЧ могут быть эффективными только в том случае, если они могут связываться с участками вируса, которые мало различаются между вирусами.
Другая проблема заключается в том, что у ВИЧ есть несколько подтипов, которые сосредоточены в разных регионах мира.Например, подтип B распространен в Северной Америке и Европе, но подтип C распространен в южной и восточной Африке. Любая вакцина должна быть эффективной против всех подтипов, или против разных подтипов должны быть разработаны разные вакцины.
Вакцина может также стимулировать выработку клеток иммунной системы, называемых Т-лимфоцитами, которые могут очищать ВИЧ-инфицированные клетки. Но ВИЧ также эволюционировал, чтобы подавить некоторые иммунные реакции, которые важны на ранних стадиях вирусной инфекции.
Еще одна проблема в разработке вакцины — найти эффективные способы безопасной доставки белков ВИЧ, которые позволят иммунной системе распознавать ВИЧ и реагировать на него, не вызывая инфекции. ВИЧ интегрируется в человеческие клетки и использует эти клетки для размножения, поэтому живые или аттенуированные цельновирусные вакцины непригодны для использования при ВИЧ. Вместо этого белки ВИЧ должны быть сконструированы таким образом, чтобы сделать их безвредными, но все же распознаваемыми иммунной системой. Эти белки или последовательности вирусного материала должны быть доставлены с помощью вектора — другого безвредного вируса, такого как оспа канареек или вирус простуды, — который представляет их иммунной системе.
Исследователи все еще работают над тем, чтобы понять, что они называют «коррелятами защиты» — маркеры иммунной системы, которые показывают, что человек защищен от ВИЧ после вакцинации. Эти измерения должны быть основаны на наблюдениях в клинических испытаниях и исследованиях на животных. Прогресс в определении коррелятов защиты был медленным из-за отсутствия моделей на животных. Животные не могут быть инфицированы вирусом иммунодефицита человека, поэтому исследования должны проводиться на обезьянах с использованием обезьяньего эквивалента SIV или конструкции под названием SHIV.
Первое крупное испытание вакцины против ВИЧ сообщило о результатах в 2003 году. В этом испытании была протестирована вакцина под названием AIDSVax, которая объединила фрагменты поверхностного белка gp120 ВИЧ из подтипа B. Вакцина была разработана для производства нейтрализующих антител против gp120 . Испытание показало, что вакцина не обеспечивает защиты по сравнению с фиктивной вакциной. Испытание вакцины с использованием того же дизайна, но с комбинацией последовательностей gp120 из подтипов A и E, также не показало защитного эффекта.
Другая стратегия вакцины, использующая векторный вирус для доставки последовательностей белка ВИЧ для стимуляции клеточного иммунитета , а не выработки антител, была протестирована в исследовании STEP.В качестве переносчика пробной вакцины использовался аденовирус, вызывающий симптомы простуды. Исследование STEP было остановлено в 2007 году после того, как анализ показал, что вакцина не снизила риск заражения.
Последующий анализ показал, что люди с наивысшими уровнями ранее существовавших антител к аденовирусам имели более высокий риск заражения, чем люди, получившие фиктивную вакцину. Результаты исследования показали, что необходимы дополнительные исследования для разработки вакцин, вызывающих защитные Т-клеточные реакции против ВИЧ.
В 2009 году испытание RV144 сообщило о небольшом снижении риска заражения в испытании с использованием подхода первичной буст-вакцины — первого испытания, когда-либо сделавшего это. В ходе испытания был протестирован вакцинационный подход, при котором люди получали «первичную» дозу ALVAC-HIV, вектор канареек, содержащий три генно-инженерные последовательности генов ВИЧ, и бустерную дозу с использованием вакцины AIDSVax gp120. «Первичная» вакцина была разработана для стимуляции клеточного иммунного ответа, тогда как цель бустерной вакцины состояла в том, чтобы стимулировать нейтрализующие ответы антител.Прайм-буст-вакцинация снизила риск заражения на 31%, что значительно снизило риск.
Результат испытания RV144 стал неожиданностью для исследователей вакцин. Они предположили, что одним из эффектов вакцины будет выработка сильных Т-клеточных ответов CD8, которые приведут к снижению вирусной нагрузки у тех, кто действительно заразился, несмотря на вакцинацию. Но вакцина не вызвала сильных ответов Т-лимфоцитов CD8 и не вызвала сильных ответов антител.
Результаты испытания RV144 показывают, с какой проблемой сталкиваются ученые, пытаясь определить, как определить, стоит ли испытывать потенциальную вакцину в крупных клинических испытаниях.Результаты испытаний предполагают, что вакцина может потребоваться для стимуляции антител и клеточного иммунного ответа на ВИЧ, и что клеточные ответы зависят от специфических ответов антител.
Версия вакцины, испытанная в исследовании RV144, впоследствии была протестирована в Южной Африке в исследовании HVTN 100. Эта вакцина содержала последовательности вируса ВИЧ подтипа C, который чаще всего встречается в южной части Африки, и использовала другой график дозирования, разработанный для получения более сильных ответов на вакцину.Исследование показало, что вакцина вызывает сильный ответ антител на белки оболочки ВИЧ. Вакцина вызвала особенно сильные ответы антител, которые коррелировали с защитой от инфекции в исследовании RV144.
Текущие испытания вакцин: Ухамбо и Имбокодо
Модифицированная вакцина RV144, испытанная в испытании HVTN100, сейчас проходит испытания в крупном исследовании фазы 3, HVTN 702 (также известном как Uhambo), в южной части Африки. Исследование, в котором примут участие 5400 человек, призвано показать, снижает ли вакцина риск заражения как минимум на 50% и продлевает ли период защиты по сравнению с исследованием RV144.Результаты исследования ожидаются к 2021 году.
Второе крупное исследование вакцины, HVTN 705 (также известное как Imbokodo), тестирует первичную буст-вакцину другой конструкции, которая показала многообещающие эффекты в предварительных исследованиях. Вакцина, подлежащая тестированию в HVTN 705, сочетает в себе «первичную» вакцину, в которой используется аденовирусный вектор для доставки «мозаичных» белков, предназначенных для выработки ответов против широкого спектра вирусов, и бустер ВИЧ подтипа C, предназначенный для стимуляции выработки антител против белок оболочки ВИЧ gp140.
Вакцина, подлежащая тестированию в HVTN 705, сочетает в себе «первичную» вакцину, в которой используется аденовирусный вектор для доставки «мозаичных» белков, предназначенных для выработки ответов против широкого спектра вирусов, и бустер ВИЧ подтипа C, предназначенный для стимуляции выработки антител против белок оболочки ВИЧ gp140.
Эта вакцина, разработанная фармацевтической компанией Janssen, тестируется на 2600 женщинах в возрасте от 18 до 35 лет в южной и восточной Африке. Результаты ожидаются к 2022 году.
Если вакцина, протестированная в исследовании HVTN 702, окажется эффективной, это не приведет к немедленному лицензированию и развертыванию вакцины. Вместо этого исследователи говорят, что они будут использовать результаты исследования, чтобы улучшить вакцину и узнать, как расширить производство вакцины. То же самое и с исследованием HVTN 705.
Будущие подходы к разработке вакцины против ВИЧ
Также разрабатываются несколько других многообещающих подходов к разработке вакцины против ВИЧ.
Широко нейтрализующие антитела могут распознавать множество различных штаммов ВИЧ. Они нацелены на области ВИЧ, которые не мутируют и мало различаются между вирусными подтипами. Эти антитела вырабатывают менее 20% людей, живущих с ВИЧ. Широко нейтрализующие антитела можно выделить и воспроизвести в лаборатории. Инфузии широко нейтрализующих антител проходят испытания в качестве метода профилактики ВИЧ в клиническом испытании AMP, результаты которого должны быть представлены в 2020 году.В нескольких других исследованиях тестируются различные комбинации нейтрализующих антител широкого спектра действия.
В рамках других исследований проводится тестирование ДНК-вакцин против ВИЧ . ДНК-вакцины предназначены для преодоления проблем, связанных с использованием целых вирусов или попытками создания рекомбинантных вирусных последовательностей, которые могут стимулировать сильные иммунные ответы. ДНК-вакцины доставляют ДНК, которая содержит код определенных вирусных белков. Клетки захватывают ДНК и производят белки, которые распознаются иммунной системой, что приводит к более сильным иммунным ответам, чем вакцины на основе вирусных векторов.Некоторые ДНК-вакцины находятся на ранней стадии исследований на людях.
ДНК-вакцины доставляют ДНК, которая содержит код определенных вирусных белков. Клетки захватывают ДНК и производят белки, которые распознаются иммунной системой, что приводит к более сильным иммунным ответам, чем вакцины на основе вирусных векторов.Некоторые ДНК-вакцины находятся на ранней стадии исследований на людях.
ПОМОГИТЕ НАМ ПОМОГИТЕ ДРУГИМ
Avert.org помогает предотвратить распространение ВИЧ и улучшить сексуальное здоровье, предоставляя людям достоверную и актуальную информацию.
Мы предоставляем все это БЕСПЛАТНО, но для того, чтобы Avert.org продолжал работать, нужны время и деньги.
Можете ли вы поддержать нас и защитить наше будущее?
Помогает каждый вклад, даже самый маленький.
Этические вопросы при разработке вакцин
Помимо этических проблем, возникающих при всех формах медицинских исследований, испытания вакцины против ВИЧ поднимают несколько собственных.
Участники испытаний должны иметь доступ к стандартному медицинскому обслуживанию в дополнение к тестируемому вмешательству. Стандарт ухода за профилактикой ВИЧ быстро меняется, поскольку все больше и больше стран начинают предоставлять PrEP. Появление в будущем вагинального кольца, содержащего антиретровирусный препарат, также повлияет на стандарты ухода за женщинами при испытаниях вакцин.
Получение экспериментальной вакцины может снизить пользу, которую участники испытаний могут получить от будущей более эффективной вакцины, а также может создать у участников впечатление, что они защищены от ВИЧ.Это ложное чувство безопасности может побудить участников пойти на риск во время и после испытания, ведущий к ВИЧ-инфекции.
Люди, принимающие участие в испытаниях вакцины и получающие активную вакцину, могут иметь положительный результат теста на антитела к ВИЧ. Участникам испытаний требуется конфиденциальность и защита от дискриминации, как и людям, живущим с ВИЧ.
Испытания вакцины также поднимают вопросы относительно лечения людей, которые заразились, несмотря на вакцинацию. Испытания предназначены для измерения вирусной нагрузки у инфицированных людей, чтобы выяснить, оказывает ли вакцина какое-либо влияние на естественное течение ВИЧ после заражения.Но поскольку в настоящее время руководства рекомендуют лечение для всех, живущих с ВИЧ, на какой срок этично откладывать лечение после заражения во время испытания вакцины? И если лечение предоставляется немедленно, когда оно недоступно для других вне исследования, поощряет ли это участие в исследовании?
Испытания предназначены для измерения вирусной нагрузки у инфицированных людей, чтобы выяснить, оказывает ли вакцина какое-либо влияние на естественное течение ВИЧ после заражения.Но поскольку в настоящее время руководства рекомендуют лечение для всех, живущих с ВИЧ, на какой срок этично откладывать лечение после заражения во время испытания вакцины? И если лечение предоставляется немедленно, когда оно недоступно для других вне исследования, поощряет ли это участие в исследовании?
Что произойдет, если будет обнаружена высокоэффективная вакцина?
Оптимистичный прогноз доступности вакцины против ВИЧ состоит в том, что она может быть доступна к 2030 году. Более пессимистический взгляд заключается в том, что разработка вакцины, которая будет признана достаточно эффективной, чтобы оправдать финансирование широкомасштабных кампаний вакцинации в России, может занять от 20 до 30 лет. регионы, где ВИЧ является эндемическим заболеванием.
Решающим фактором, определяющим скорость, с которой вакцина станет доступной, является вопрос минимальной эффективности, необходимой для того, чтобы сделать ее рентабельной.
Ни одна вакцина не защищает каждого, кто ее получает. Эффективность вакцины против сезонного гриппа сильно меняется из года в год. Вопрос к исследователям вакцины против ВИЧ: следует ли внедрять вакцину, которая снижает риск заражения на 50%, немедленно или следует продолжить исследования в надежде, что вакцина с эффективностью 90% станет возможной через несколько лет?
Моделирование, проведенное Международной инициативой по вакцине против СПИДа, показывает, что даже если вакцина эффективна только на 30%, она снизит количество новых инфекций на 44% за 10 лет при использовании вместе с универсальным лечением и PrEP.Обзор всех исследований экономической эффективности вакцины против ВИЧ показал, что эффективность вакцины гораздо менее важна, чем стоимость лечения ВИЧ или уровень передачи ВИЧ при определении того, будет ли вакцина рентабельной. Если вакцина признана готовой для широкого использования людьми, потребуется адекватное финансирование, чтобы гарантировать закупку вакцины. Производителям потребуются гарантии для увеличения объемов производства. После проверки производственных процессов для обеспечения стабильно высокого качества партий вакцины необходимо будет получить лицензию на вакцину в каждой стране, где она будет использоваться.
Если вакцина признана готовой для широкого использования людьми, потребуется адекватное финансирование, чтобы гарантировать закупку вакцины. Производителям потребуются гарантии для увеличения объемов производства. После проверки производственных процессов для обеспечения стабильно высокого качества партий вакцины необходимо будет получить лицензию на вакцину в каждой стране, где она будет использоваться.
Национальным властям также необходимо будет решить, кому сделать вакцинацию в первую очередь. Эти решения, вероятно, будут приниматься для каждой страны и будут зависеть от эффективности и стоимости вакцины, а также от скорости передачи. Например, некоторые страны с высоким уровнем заболеваемости ВИЧ среди молодых женщин могут решить отдать приоритет девочкам-подросткам и молодым женщинам. В других странах с концентрированными эпидемиями приоритетными группами могут быть потребители инъекционных наркотиков, секс-работники или мужчины, практикующие секс с мужчинами.
Вакцина против ВИЧ — это сегодня более реалистичная перспектива, чем десять лет назад. Исследования показали некоторые доказательства того, что современные разработки вакцин могут вызывать сильные иммунные реакции, защищающие некоторых людей от ВИЧ-инфекции. Результаты более крупных исследований между 2021 и 2022 годами, вероятно, предоставят гораздо больше информации о сроках создания эффективной вакцины.
В поисках вакцины для профилактики ВИЧ
Ключевые моменты
- Профилактическая вакцина — это реальная перспектива, хотя она не может защитить всех или защитить от ВИЧ каждый раз.За десятилетия исследований эффективность вакцины может повыситься.
- Для успешной вакцины, вероятно, потребуется стимулировать несколько ветвей иммунной системы, чтобы они ответили на ВИЧ. Научиться стимулировать длительные реакции — основная задача современных исследований вакцин.
- Несколько крупных испытаний проверяют многообещающие вакцины, результаты которых ожидаются примерно в 2023 году.

Вакцины, предотвращающей заражение ВИЧ, пока нет. Но есть реальный шанс, что вакцина, которая защитит людей от инфекции, станет доступной в течение пяти-десяти лет.На этой странице кратко излагается текущее состояние исследований и проблемы, с которыми сталкиваются ученые.
Разработать вакцину против ВИЧ было сложно по нескольким причинам. В то время как большинство других вакцин работают, обучая адаптивную часть иммунной системы вырабатывать антитела, которые устраняют инфекцию, антитела не могут избавиться от ВИЧ-инфекции. Это потому, что ВИЧ очень быстро мутирует, избегая антител.
Вакцинальные подходы, которые оказались успешными против других вирусов — убитых или ослабленных версий вируса — не оказались подходящими в случае ВИЧ из-за риска того, что вирусный материал, используемый в вакцине, интегрируется в клетки человека и в конечном итоге приведет к репликация нового вируса.
Другая проблема заключается в том, что ВИЧ делится на семьи или подтипы, которые преобладают в разных частях мира. Вакцина должна быть эффективной против всех подтипов, или против разных подтипов должны быть разработаны разные вакцины.
Большинство вакцин работают, стимулируя одну часть иммунного ответа с целью выработки антител против инфекционного агента. Вакцина против ВИЧ может потребоваться для стимулирования эффективных ответов на ВИЧ со стороны трех частей иммунной системы:
- Ответы антител за счет выработки широко нейтрализующих антител, распознающих части ВИЧ, которые не мутируют.
- Клеточные иммунные ответы, состоящие из Т-лимфоцитов CD4, которые распознают ВИЧ и стимулируют другие Т-клетки, такие как клетки CD8, для уничтожения инфицированных вирусом клеток.
- Врожденные иммунные ответы, такие как естественные клетки-киллеры (NK), которые могут быть вызваны некоторыми типами антител, стимулированных вакциной против ВИЧ. NK-клетки могут разрушать ВИЧ-инфицированные клетки.
Широко нейтрализующие антитела были обнаружены у людей, которые заразились ВИЧ, но не испытали повреждения иммунной системы, так называемые «элитные контролеры». Эти антитела могут блокировать большинство штаммов ВИЧ, поскольку они нацелены на участки на поверхности вируса, которые не меняются от одного поколения ВИЧ к другому. Большинство людей не вырабатывают эти антитела в ответ на ВИЧ-инфекцию. Разработчики вакцины должны научиться стимулировать выработку широко нейтрализующих антител с помощью вакцины.
Эти антитела могут блокировать большинство штаммов ВИЧ, поскольку они нацелены на участки на поверхности вируса, которые не меняются от одного поколения ВИЧ к другому. Большинство людей не вырабатывают эти антитела в ответ на ВИЧ-инфекцию. Разработчики вакцины должны научиться стимулировать выработку широко нейтрализующих антител с помощью вакцины.
Вакцина, стимулирующая Т-клетки, может привести к эффективному разрушению любых клеток, которые не смогли защитить антитела к ВИЧ, или может привести к снижению уровня ВИЧ у людей, которые заразились, несмотря на вакцинацию.
Но вакцина, разработанная для выработки клеточного иммунитета против ВИЧ, сталкивается с проблемой, поскольку Т-клетки центральной памяти являются наиболее важным резервуаром ВИЧ-инфицированных клеток в организме. Вакцина, которая стимулировала выработку Т-клеток центральной памяти, на самом деле могла бы повысить восприимчивость к инфекции (как, по-видимому, произошло в одном испытании).
Врожденная иммунная система, наиболее примитивная, но наиболее быстро действующая часть, на самом деле не может быть «научена» распознавать патогены с помощью вакцины таким же образом.Но исследования вакцин, которые показали признаки эффективности, показывают, что одним из важных факторов было образование классов антител, которые, в свою очередь, стимулируют естественные клетки-киллеры врожденной иммунной системы для уничтожения ВИЧ-инфицированных клеток в процессе, называемом ADCC (антитело- направленная клеточная цитотоксичность).
Что было известно о том, как создать эффективную вакцину против ВИЧ?
Исследователи вакцин многому научились из исследований на животных, из исследований людей, которые подвергались воздействию ВИЧ, но не заразились, а также из клинических испытаний экспериментальных вакцин против ВИЧ.
Глоссарий
вакцина
Вещество, содержащее антигенные компоненты инфекционного организма. Стимулируя иммунный ответ (но не болезнь), он защищает от последующей инфекции этим организмом или может направлять иммунный ответ против установленной инфекции или рака.
антитело
Белковое вещество (иммуноглобулин), вырабатываемое иммунной системой в ответ на чужеродный организм. Многие диагностические тесты на ВИЧ обнаруживают наличие антител к ВИЧ в крови.
пробный
Клиническое испытание — это научное исследование, которое оценивает лечение или вмешательство с участием людей-добровольцев, чтобы ответить на конкретные вопросы о его безопасности, эффективности и медицинских эффектах.
эффективность
Насколько хорошо что-то работает (в реальных условиях). См. Также «эффективность».
Широко нейтрализующие антитела (bNAbs)
Нейтрализующее антитело (NAb) — это антитело, которое полностью защищает свою клетку-мишень от антигена.Широко нейтрализующее антитело (bNAb) представляет собой нейтрализующее антитело, которое оказывает этот эффект против широкого спектра антигенов. У людей, живущих с ВИЧ, был выделен ряд широко нейтрализующих антител. Некоторые из них изучаются и в некоторых случаях используются в клинических испытаниях для защиты людей от ВИЧ-инфекции, лечения ВИЧ-инфекции и уничтожения ВИЧ-инфицированных CD4 + Т-клеток в скрытых резервуарах.
Были протестированы многочисленные подходы к разработке вакцины, чтобы узнать больше о том, как защитить от ВИЧ и как вызвать сильные иммунные ответы против ВИЧ.В ходе испытаний вакцины были изучены следующие вопросы:
- Как вакцина может безопасно ввести гены или белки ВИЧ в организм?
- Сколько доз вакцины необходимо для сильного иммунного ответа?
- Может ли комбинация вакцин, вводимых в определенной последовательности, вызвать более сильный ответ?
- Какая комбинация белков ВИЧ вызывает самый сильный ответ?
- Насколько широк иммунный ответ — работает ли он против всех типов ВИЧ?
- Как долго длится ответ?
Первое крупное испытание вакцины против ВИЧ сообщило о результатах в 2003 году.Вакцина AIDSVAX, использованная в этом испытании, была разработана для стимуляции выработки антител против участка поверхностного белка ВИЧ, gp120.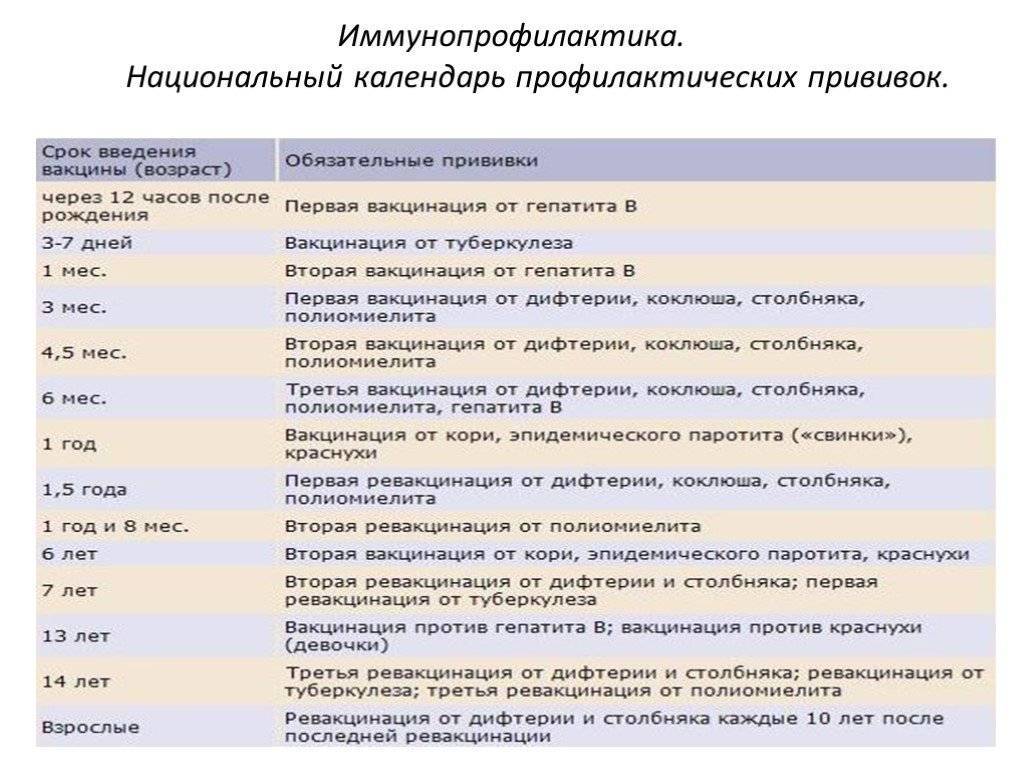 Испытание показало, что AIDSVAX не более эффективен, чем плацебо или фиктивная вакцина в предотвращении ВИЧ-инфекции.
Испытание показало, что AIDSVAX не более эффективен, чем плацебо или фиктивная вакцина в предотвращении ВИЧ-инфекции.
Другой подход к вакцине был протестирован в большом испытании под названием STEP. В этом испытании была протестирована вакцина, разработанная для стимулирования клеточного иммунного ответа. В вакцине использовался аденовирус (Ad5), вызывающий симптомы простуды, для безопасной доставки белков ВИЧ.Испытание было остановлено в 2007 году после того, как промежуточный анализ показал, что вакцина не снизила риск заражения. Дальнейший анализ показал, что люди с наивысшими уровнями антител к аденовирусу, используемому в вакцине, имели самый высокий риск заражения ВИЧ после вакцинации, по крайней мере, на ранней стадии испытания. Это исследование показало, что необходимо проявлять осторожность при выборе вируса или вектора, используемого для доставки белков ВИЧ в вакцину.
Другое исследование вакцины с использованием вектора Ad5, но содержащей белки ВИЧ подтипа B, не показало эффективности и повышения риска заражения ВИЧ для вакцинированных мужчин после того, как исследование было неслепым.До сих пор неясно, почему у этих участников увеличился риск заражения.
Альтернативный подход, разработанный для стимуляции как клеточного иммунитета, так и выработки антител, был протестирован в испытании RV144. В этом исследовании использовались две вакцины в так называемом «первичном бусте». Вакцина под названием ALVAC-HIV использовалась для «праймирования» клеточной иммунной системы с использованием трех последовательностей белков ВИЧ. Вакцину AIDSVAX позже использовали для усиления иммунного ответа. Вакцины «Prime-boost» предназначены для создания сильных и длительных иммунных ответов.
Испытание RV144 показало, что комбинация прайм-буст снижает риск заражения на 31%. Многие исследователи были удивлены этим результатом, поскольку AIDSVAX не защищал от инфекции при использовании отдельно. Другой неожиданный результат заключался в том, что вакцина не вызвала сильного ответа Т-лимфоцитов CD8 у большинства участников и не привела к снижению вирусной нагрузки у людей, которые заразились, несмотря на вакцинацию. Вакцина действительно вызвала сильный антительный ответ на участок поверхностного белка ВИЧ.
Вакцина действительно вызвала сильный антительный ответ на участок поверхностного белка ВИЧ.
Дальнейший анализ показал, что специфические ответы антител, которые также стимулировали врожденные иммунные ответы (антителозависимая клеточно-опосредованная цитотоксичность, ADCC), были сильно связаны со снижением риска инфекции у реципиентов вакцины. Это открытие побудило исследователей протестировать дальнейшие стратегии первичной вакцинации.
Версия комбинации вакцин, использованная в испытании RV144, адаптированная к типу ВИЧ, распространенному в южной и восточной Африке (подтип C), была протестирована в исследовании HVTN 100.Это исследование показало, что вакцина вырабатывала очень сильные ответы антител, которые связаны с защитой от инфекции в испытании RV144. Затем вакцина была протестирована в гораздо более крупном испытании на юге Африки. В исследовании HVTN 702 (также известном как Uhambo) приняли участие 5407 человек, и его целью было проверить, может ли вакцина снизить риск заражения ВИЧ как минимум на 50%. Испытание также было организовано, чтобы выяснить, сохраняются ли сильные иммунные ответы на ВИЧ дольше при использовании этой вакцины по сравнению с испытанием RV144, где защитный эффект вакцины начал ослабевать через год.Однако в феврале 2020 года было объявлено, что это испытание было прекращено досрочно, поскольку промежуточный обзор показал, что вакцина неэффективна. Это серьезная неудача, но результаты еще не анализировались подробно.
Текущие основные исследования вакцин
В другом крупном исследовании на юге Африки тестируется другой подход с первичной буст-вакцинацией. Этот вакцинный подход вызвал сильные иммунные ответы в исследованиях на животных и в предварительных исследованиях на людях.В исследовании HVTN 705 (также известном как Imbokodo) используется «первичная» вакцина, состоящая из аденовирусного вектора, который доставляет «мозаику» оболочки ВИЧ и внутренних белков из четырех подтипов ВИЧ, предназначенных для выработки ответов против широкого спектра подтипов ВИЧ. Аденовирус, используемый в этой вакцине (Ad26), гораздо реже, чем аденовирус, использованный в исследовании STEP (Ad5), в надежде, что ранее существовавшие антитела будут менее распространены и не будут влиять на активность вакцины.
Аденовирус, используемый в этой вакцине (Ad26), гораздо реже, чем аденовирус, использованный в исследовании STEP (Ad5), в надежде, что ранее существовавшие антитела будут менее распространены и не будут влиять на активность вакцины.
Было показано, что бустерная вакцина, использованная в этом исследовании, стимулирует выработку антител против белка оболочки gp140 ВИЧ.
В исследовании Imbokodo приняли участие 2637 женщин в возрасте от 18 до 35 лет, которые относятся к группе населения с самым высоким риском заражения ВИЧ на юге Африки. Результаты этого исследования ожидаются в 2023 году.
Ожидается, что в 2019 году в другом исследовании (испытание HVTN 706) того же подхода к мозаичной вакцине начнется набор участников в Северной Америке, Латинской Америке и Европе. в Европе и Америке.Это испытание не даст результатов раньше 2023 года.
Совершенно иной подход тестируется в исследованиях AMP. Вместо того, чтобы использовать вакцину для производства широко нейтрализующих антител, эти исследования проверяют концепцию введения широко нейтрализующих антител — антитело-опосредованная профилактика (AMP). Исследования проверят, насколько хорошо эти антитела защищают от ВИЧ-инфекции. Если метод окажется успешным, то опосредованная антителами профилактика может стать дополнительным методом профилактики до тех пор, пока не будут разработаны вакцины для стимуляции широко нейтрализующих ответов антител.
Одно исследование (HVTN 704) тестирует инфузию широко нейтрализующего антитела VRC01 на 2700 мужчинах, имеющих половые контакты с мужчинами, и трансгендерных женщинах в США, Перу, Бразилии и Швейцарии. Другое исследование, HVTN 703, тестирует те же антитела на 1900 женщинах в южной части Африки. Результаты ожидаются в 2022 году.
Защитит ли вакцина всех?
Многие ожидают, что вакцины против ВИЧ первого поколения будут эффективны только частично. Некоторые люди будут иметь более слабый иммунный ответ после вакцинации или пропустят дозу вакцины и не смогут достичь защиты.Вакцина RV144 снизила риск заражения только на 31%, но испытания новых вакцин направлены на снижение риска заражения по крайней мере на 50%, а предпочтительно на 65% или более, чтобы продвинуться вперед. Вакцина, которая снизила риск заражения только наполовину, может, тем не менее, быть очень рентабельной в регионах мира, где уровень инфицирования высок, а стоимость лечения будет продолжать расти, если уровень инфицирования не может быть снижен.
Когда будет доступна вакцина против ВИЧ?
Ученые перешли от оптимизма к пессимизму в отношении шансов на разработку эффективной вакцины за последние тридцать лет.Ученые снова становятся оптимистичными после результатов недавних исследований.
Даже если крупные испытания, проводимые в настоящее время, дадут положительные результаты после 2023 года, потребуется несколько лет, чтобы результаты были полностью проанализированы и представлены на утверждение регулирующим органам. Необходимо будет расширить производство вакцин, и доноры должны будут выделить деньги на оплату кампаний вакцинации против ВИЧ в странах с низкими доходами. Кроме того, могут потребоваться дальнейшие исследования для проверки того, что вакцины, эффективные в одном клиническом испытании, демонстрируют аналогичную эффективность в других популяциях.
Даже если исследования вакцин дадут положительные результаты в ближайшие несколько лет, это не будет означать, что потребность в исследованиях вакцины против ВИЧ исчезнет. Потребуются дальнейшие исследования, чтобы повысить эффективность вакцин, упростить и удешевить производство вакцин, а также выяснить, как доставить их наибольшему количеству людей в различных регионах мира. Наличие эффективной вакцины — это одна из проблем, но другая серьезная проблема будет заключаться в том, чтобы обеспечить возможность вакцинации всех, кто подвержен риску заражения ВИЧ.
Будет ли когда-нибудь вакцина против ВИЧ?
Инфекционные болезни, ведущие к длительной инвалидности, представляют собой постоянную угрозу для человечества, но благодаря вакцинации многие из них остались в анналах истории. Вирусы, такие как полиомиелит, гепатит B, гепатит C и вирус папилломы человека, могут привести к хроническим заболеваниям, но современная медицина означает, что все они могут быть эффективно заражены. Однако когда дело доходит до вируса иммунодефицита человека (ВИЧ), который, по мнению многих эпидемиологов, по-прежнему находится на глобальном уровне пандемии, медицинские исследователи не достигли такого успеха.
ВИЧ подразделяется на три стадии. Острый ВИЧ определяется симптомами гриппа, которые возникают в первые дни и недели после заражения, за которыми следует хронический ВИЧ, бессимптомная стадия, которая может длиться несколько лет. При отсутствии лечения хронический ВИЧ в конечном итоге трансформируется в синдром приобретенного иммунодефицита (СПИД).
СПИД постепенно приводит к сбою иммунной системы, позволяя развиваться оппортунистическим инфекциям и клеточным аномалиям, которые организм обычно отправляет. У больного СПИДом простуда может вызвать отказ легких или скопление мутантных клеток может превратиться в опухоль гораздо легче, чем у здорового человека.
Болезнь не привлекала основное внимание в медицинском сообществе до 1981 года, когда начали регистрироваться вспышки редких заболеваний среди геев в Лос-Анджелесе, Нью-Йорке и Сан-Франциско, а именно рак под названием саркома Капоши и необычное заболевание легких под названием пневмоцистная пневмония. К концу года зарегистрировано 337 случаев заражения ВИЧ. К 31 декабря из этих пациентов 130 умерли.
Азидотимидин был представлен в 1987 году в качестве первого препарата для лечения ВИЧ, но только в 1997 году высокоактивная антиретровирусная терапия (ВААРТ) стала новым стандартом лечения, что привело к снижению смертности на 47%.ВААРТ не может избавить организм от ВИЧ, но эффективное лечение может снизить вирусную нагрузку до такой степени, что она считается «неопределяемой». Это означает, что стандартные тесты на ВИЧ не смогут обнаружить вирус, он не может быть передан другому человеку и не приведет к развитию СПИДа.
ВИЧ превратился из смертного приговора в управляемое хроническое заболевание, но у нас до сих пор нет вакцины.
Почему так сложно сделать прививку от ВИЧ?
После того, как исследователи из Национального института здоровья США и Института Пастера подтвердили, что ВИЧ-инфекция привела к СПИДу в 1984 году, министр здравоохранения и социальных служб США Маргарет Хеклер заявила, что вакцина будет доступна в течение двух лет.Однако сама природа ВИЧ чрезвычайно усложняла ситуацию.
Ведущий специалист по профилактике СПИДа Маттео Кассолато говорит: «В отличие от кори и других вирусов, наша иммунная система не способна естественным образом восстанавливаться после ВИЧ.
«Поскольку люди, инфицированные ВИЧ, не могут избавиться от вируса естественным путем, мы не знаем, как будет выглядеть защита от ВИЧ у человека. Если бы мы знали это, исследователи вакцин точно знали бы, какой тип иммунного ответа вакцина должна вызвать в нашем организме, чтобы обеспечить защиту от ВИЧ-инфекции.”
Тематические отчеты
Беспокоитесь ли вы о темпах инноваций в вашей отрасли?
В отчете
GlobalData по темам TMT за 2021 год рассказывается все, что вам нужно знать о темах подрывных технологий и о том, какие компании лучше всего могут помочь вам в цифровой трансформации вашего бизнеса.
Узнать больше
Вакцины предназначены для обучения иммунной системы защите от инфекции с помощью убитых или ослабленных патогенов или их производных, таких как антигены или ДНК.Эти убитые или ослабленные патогены вызывают иммунный ответ, обучая организм распознавать атаку рассматриваемой инфекции в будущем.
Но человеческий организм не вызывает такой же иммунный ответ на ВИЧ, как на патогены, против которых можно сделать вакцинацию.
Кассолато говорит: «Когда какой-либо чужеродный патоген попадает в организм, обычно происходит то, что иммунная система обнаруживает вирус и пытается контролировать или уничтожать его. Специальные клетки, называемые CD4 и CD8, распознают вирус как нечто чужеродное и атакуют его.
«Однако с ВИЧ клетки CD4 и CD8 становятся мишенью вируса ВИЧ. Нацеливая инфекцию на те же клетки, которые должны защищать нас от нее, ВИЧ в конечном итоге ослепляет и ослабляет нашу иммунную систему ».
Генетическое разнообразие, мутации и отсутствие надежных моделей животных
Генетическое разнообразие ВИЧ также чрезвычайно затрудняет вакцинацию против него. У этого вируса самый высокий уровень мутаций среди всех биологических объектов, что означает, что существует множество его различных штаммов.Поэтому исследователи должны иметь возможность разработать вакцину, способную защитить от всех различных штаммов ВИЧ, что было бы невероятно сложно.
Помимо множественных мутаций, на самом деле существует два вида ВИЧ, оба из которых в конечном итоге перерастут в СПИД, если их не лечить. ВИЧ-1 на сегодняшний день является наиболее распространенным штаммом болезни, при этом около 95% людей, инфицированных ВИЧ во всем мире, имеют ВИЧ-1. Между тем, ВИЧ-2 обнаружен в основном в Западной Африке, откуда, как считается, произошли оба вируса, поскольку он гораздо менее вирулентен, чем ВИЧ-1.
Хотя и ВИЧ-1, и ВИЧ-2 оказывают схожее воздействие на человеческий организм, они имеют только 55% идентичности генетической последовательности — этого достаточно, чтобы не все тесты и методы лечения могли работать для обоих типов. С вакциной дело, скорее всего, будет таким же.
Последним ключевым препятствием является то, что у нас нет надежной модели на животных, на которой можно было бы проводить испытания вакцины против ВИЧ, что обычно является ключевым этапом, когда дело доходит до такого рода медицинских исследований.
«Хотя можно проводить тесты на животных, существуют значительные ограничения», — говорит Кассолато.«Хотя существует аналогичный вирус, называемый вирусом обезьяньего иммунодефицита, приматы не переносят и не передают ВИЧ сами по себе, а это означает, что трудно сравнить, как вакцина работает у приматов, с тем, как она может работать у людей».
История до сих пор
Самой успешной вакциной против ВИЧ на сегодняшний день было испытание RV144, завершившееся в 2009 году. В нем приняли участие 16 402 мужчины и женщины в возрасте от 18 до 30 лет, и оно длилось почти шесть лет. В рандомизированных группах двойного слепого исследования добровольцы получали вакцину против ВИЧ или плацебо, а затем проходили тестирование на ВИЧ каждые шесть месяцев в течение трех лет для мониторинга своего инфекционного статуса.
Добровольцы RV144 получили четыре инъекции вакцины ALVAC HIV и две вакцины AIDSVAX B / E. ALVAX HIV содержал генно-инженерные версии трех генов ВИЧ (env, gag и pol), в то время как AIDSVAX B / E состоял из генно-инженерного gp120, белка, который существует на поверхности клеток ВИЧ.
В конце исследования уровень ВИЧ-инфекции среди добровольцев, получивших экспериментальную вакцину, был на 31% ниже, чем уровень ВИЧ-инфекции среди добровольцев, которым вводили плацебо.Уровень успеха 31% был недостаточным для Министерства здравоохранения Таиланда, чтобы рассмотреть вопрос об одобрении вакцины, но это было первое доказательство того, что какая-либо вакцина вообще эффективна в снижении риска заражения ВИЧ.
«Хотя 31% отнюдь не ошеломляющая цифра, это указывает на то, что вакцина против ВИЧ могла защитить от вируса», — говорит Кассолато.
В настоящее время проводится ряд испытаний вакцины против ВИЧ, но два из них — исследование Imbokodo и исследование Mosaico — отличаются от своих аналогов.
Imbokodo и Mosaico: два испытания дают надежду
Исследование Imbokodo, начатое в ноябре 2017 года, проверяет, может ли вакцина, разработанная Janssen, безопасно и эффективно снизить уровень новых ВИЧ-инфекций. Все добровольцы — молодые женщины в возрасте от 18 до 35 лет с исследовательскими центрами в Малави, Мозамбике, Южной Африке, Замбии и Зимбабве. В восточной и южной частях Африки женщины и девушки составляют почти 60% ВИЧ-положительного населения.
Johnson & Johnson объявила в июле 2020 года, что все 2600 участников испытания, наконец, были вакцинированы, и заявила, что первые результаты могут быть получены уже в конце 2021 года.
Основываясь на исследовании Imbokodo, исследование Mosaico позволит оценить, может ли очень похожая схема вакцинации снизить иммунный ответ против различных штаммов ВИЧ среди цисгендерных мужчин и трансгендеров, имеющих половые контакты с другими цисгендерными мужчинами или трансгендерами. Возраст участников исследования Mosaico, начавшегося в июне 2019 года, составляет от 18 до 60 лет, они проживают в США, Аргентине, Италии, Мексике, Перу, Польше и Испании.
В Европе и Америке геи, бисексуалы и трансгендеры непропорционально сильно страдают от ВИЧ — две трети новых диагнозов ВИЧ в США поступают от геев и бисексуалов, в то время как, по оценкам, 14% трансгендерных женщин в стране инфицированы ВИЧ. .Но участники испытания Mosaico должны будут соответствовать ряду строгих критериев — просто быть ЛГБТ + недостаточно, чтобы считаться группой риска.
В течение последних шести месяцев им пришлось бы: иметь восприимчивый анальный или вагинальный секс без презервативов вне 12-месячных моногамных отношений с партнером, который, как известно, является ВИЧ- или ВИЧ-положительным, и принимал ВААРТ; были диагностированы ректальная или уретральная гонорея, хламидиоз или сифилис; употребляли стимуляторы, такие как кокаин или амфетамины; или имел пять или более сексуальных партнеров.
В обоих исследованиях оценивается вакцина на основе мозаики под названием Ad26.Mos4.HIV. В вакцине используется сконструированный аденовирусный вектор, безвредный родственник простуды, для доставки «мозаики» из тщательно отобранных антигенов ВИЧ.
Эта комбинация антигенов должна стимулировать какой-то иммунный ответ у участников исследования. Используемая комбинация антигенов не обнаружена ни в одном отдельном вирусе ВИЧ, а собрана вместе из нескольких вирусов, так что вакцина может защитить от множества глобальных штаммов ВИЧ.
Исследования различаются, когда дело доходит до стадии бустерного впрыска. Вирусная оболочка ВИЧ содержит белок gp140. В испытании Mosaico третья и четвертая инъекции будут сопровождаться комбинацией gp140 из Clade C, преобладающего типа ВИЧ в Африке и Азии, а также мозаикой gp140 из других штаммов. С другой стороны, режим Imbokodo будет содержать только белки Clade C gp140.
«Разработка любой вакцины — сложная задача, но ВИЧ особенно сложен из-за множества препятствий», — говорит Кассолато.«Однако наука и исследования развиваются быстрыми темпами, и это, конечно, возможно».
Связанные компании
Proceedix
Безбумажный порядок, рабочие инструкции и инспекционные работы
28 августа 2020
SpotSee
Мониторы температуры и состояния при транспортировке и регистраторы данных
28 августа 2020
Почему так сложно сделать вакцину от ВИЧ?
История разработки вакцины против ВИЧ отмечена многочисленными неудачами и разочарованиями, и каждый очевидный «прорыв» представляет собой еще больше проблем и препятствий, которые необходимо преодолеть.Часто кажется, что на шаг вперед, который делают исследователи, непредвиденное препятствие отбрасывает их на один или даже два шага.
В некотором смысле это справедливая оценка, учитывая, что нам еще предстоит увидеть жизнеспособную вакцину-кандидат. С другой стороны, ученые, по сути, добились огромных успехов в последние годы, лучше понимая сложную динамику ВИЧ-инфекции и реакцию организма на такую инфекцию. Эти достижения настолько волнуют, что некоторые теперь считают, что вакцина станет возможной в ближайшие 15 лет (среди них лауреат Нобелевской премии и соавтор исследования в области ВИЧ Франсуаза Барре-Синусси).
Еще неизвестно, будет ли такая вакцина доступной, безопасной и простой для введения и распространения среди населения всего мира. Но что мы точно знаем, так это то, что необходимо будет устранить ряд ключевых препятствий, если какой-либо такой кандидат когда-либо выйдет за пределы стадии проверки концепции.
Международная инициатива по вакцине против СПИДа (IAVI)
Как ВИЧ препятствует разработке вакцины
С самой фундаментальной точки зрения усилиям по разработке вакцины против ВИЧ препятствует генетическое разнообразие самого вируса.Цикл репликации ВИЧ не только быстр (немногим более 24 часов), но и подвержен частым ошибкам, создавая мутировавшие копии самого себя, которые рекомбинируют в новые штаммы по мере передачи вируса от человека к человеку. Разработка единой вакцины, способной уничтожить более 60 доминантных штаммов, а также множество рекомбинантных штаммов — и на глобальном уровне — становится еще более сложной задачей, когда обычные вакцины могут защитить только от ограниченного числа вирусных штаммов.
Во-вторых, борьба с ВИЧ требует надежного ответа со стороны иммунной системы, и это снова приводит к ее отказу.Традиционно специализированные лейкоциты, называемые Т-лимфоцитами CD4, инициируют ответ, передавая сигнал клеткам-киллерам к месту инфекции. По иронии судьбы, это те самые клетки, на которые нацелена ВИЧ-инфекция. Поступая таким образом, ВИЧ снижает способность организма защищаться, поскольку популяция CD4 систематически истощается, что в конечном итоге приводит к нарушению защиты, которое называется иммунным истощением.
Наконец, искоренению ВИЧ препятствует способность вируса прятаться от иммунной защиты организма.Вскоре после заражения, в то время как другой ВИЧ свободно циркулирует в кровотоке, подмножество вируса (называемого провирусом) внедряется в скрытые клеточные убежища (так называемые скрытые резервуары). Попав внутрь этих клеток, ВИЧ не может быть обнаружен.
Вместо инфицирования и уничтожения клетки-хозяина, латентный ВИЧ делится вместе с хозяином с сохранением своего генетического материала. Это означает, что даже если ВИЧ, находящийся в свободном обращении, погибнет, «скрытый» ВИЧ может дать реактивную реакцию и запустить инфекцию заново.
Преодоление препятствий
В последние годы стало ясно, что преодоление этих препятствий потребует многоаспектной стратегии и что единый подход вряд ли приведет к достижению целей, необходимых для разработки стерилизующей вакцины.
Таким образом, основные компоненты этой стратегии должны быть направлены на:
- Способы нейтрализации множества генетических штаммов ВИЧ
- Способы вызвать соответствующий иммунный ответ, необходимый для защиты
- Способы поддержания целостности иммунной системы
- Способы очистки и уничтожения скрытых вирусов
Прогресс достигается по многим из этих предложенных стратегий с разным уровнем эффективности и успеха, и его можно примерно определить следующим образом:
Стимулирующие широко нейтрализующие антитела
Среди людей, живущих с ВИЧ, есть группа людей, известных как элитные контролеры (ЭК), которые, по-видимому, обладают способностью подавлять репликацию вируса без антиретровирусной терапии.
В последние годы ученые начали идентифицировать конкретные генетические мутации, которые, по их мнению, обусловливают эту естественную защитную реакцию. Среди них — подмножество специализированных защитных белков, известных как широко нейтрализующие антитела (или bNAb).
Антитела защищают организм от конкретного болезнетворного агента (патогена). Большинство из них не являются нейтрализующими антителами широкого спектра действия, что означает, что они убивают только один или несколько типов патогенов.
Некоторые недавно обнаруженные bNAb обладают способностью убивать широкий спектр вариантов ВИЧ — до 95% в некоторых случаях — тем самым ограничивая способность вируса инфицировать и распространяться.
На сегодняшний день ученым еще предстоит определить эффективные средства для индукции ответа bNAb до уровней, при которых он может считаться защитным, и что для развития такого ответа, вероятно, потребуются месяцы или даже годы. Еще больше усложняет ситуацию тот факт, что мы еще не знаем, может ли стимуляция этих bNAb быть вредной — могут ли они действовать против собственных клеток организма и свести на нет какую-либо пользу от лечения.
При этом большое внимание уделяется прямой инокуляции bNAb людям с установленной ВИЧ-инфекцией.Один из таких bNAb, известный как 3BNC117, по-видимому, не только блокирует заражение новых клеток, но также очищает ВИЧ-инфицированные клетки. Такой подход может однажды позволить альтернативный или дополнительный подход к терапии для людей, уже инфицированных вирусом.
Восстановление иммунной целостности
Даже если бы ученые смогли эффективно стимулировать производство bnAbs, это, вероятно, потребовало бы надежного иммунного ответа. Это считается серьезной проблемой, поскольку сам ВИЧ вызывает истощение иммунной системы, активно убивая «вспомогательные» Т-клетки CD4.
Кроме того, способность организма бороться с ВИЧ с помощью так называемых «убийц» Т-лимфоцитов CD8 со временем постепенно ослабевает по мере того, как организм подвергается так называемому иммунному истощению. Во время хронической инфекции иммунная система будет постоянно регулировать себя, чтобы гарантировать, что она не будет ни чрезмерно стимулирована (вызывая аутоиммунное заболевание), ни недостаточно стимулирована (позволяя патогенам беспрепятственно распространяться).
В частности, при длительной ВИЧ-инфекции может происходить недостаточная активация, поскольку клетки CD4 постепенно уничтожаются, и организм становится менее способным идентифицировать патоген (ситуация аналогична ситуации у пациентов с раком).Когда это происходит, иммунная система непреднамеренно «тормозит» соответствующую реакцию, делая ее все менее и менее способной защищаться.
Ученые из Университета Эмори начали изучать возможность использования клонированных антител под названием ипилимумаб , которые могут «ослабить тормоза» и активизировать производство Т-клеток CD8.
Одно из наиболее восторженно воспринятых исследований, в настоящее время находящихся на испытаниях на приматах, включает использование отключенной «оболочки» обычного вируса герпеса, называемого ЦМВ, в которую вставлены не вызывающие болезни фрагменты SIV (версия ВИЧ для приматов). .Когда субъектам вводят генетически измененный ЦМВ, организм реагирует на «ложную» инфекцию ускорением выработки Т-клеток CD8 для борьбы с тем, что, по их мнению, является ВИО.
Что делает модель ЦМВ особенно привлекательной, так это то, что вирус герпеса не выводится из организма, как вирус простуды, а продолжает размножаться. Приносит ли это долговременную иммунную защиту, еще предстоит определить, но это убедительное доказательство правильности концепции.
Пнуть и убить скрытый ВИЧ
Одно из самых серьезных препятствий на пути разработки вакцины против ВИЧ — это скорость, с которой вирус способен создавать скрытые резервуары, чтобы избежать обнаружения иммунной системой.Считается, что это может произойти всего за четыре часа в случае передачи через анальный секс — быстро от места заражения к лимфатическим узлам — до четырех дней при других типах передачи половым или несексуальным путем.
На сегодняшний день мы не совсем уверены, насколько обширными или большими могут быть эти резервуары, ни с какой их способностью вызывать возврат вируса (т. Е. Возвращение вируса) у тех, кто считается очищенным от инфекции.
Некоторые из наиболее агрессивных аспектов исследования включают в себя так называемую стратегию «пинка-убийство», в которой используются стимулирующие агенты, которые могут «вытолкнуть» латентный ВИЧ из укрытия, тем самым позволяя второстепенному агенту или стратегии «убить» недавно обнаруженный вирус. .
В этом отношении ученые добились определенного успеха, используя препараты, называемые ингибиторами HDAC, которые традиционно использовались для лечения эпилепсии и расстройств настроения. Хотя исследования показали, что новые препараты HDAC способны «разбудить» спящий вирус, ни одному из них еще не удалось очистить резервуары или даже уменьшить их размер. В настоящее время надежды возлагаются на совместное использование HDAC и других новых лекарственных средств (включая PEP005, используемый для лечения одного из видов рака кожи, связанного с солнцем).
Однако более проблематичным является тот факт, что ингибиторы HDAC потенциально могут вызывать токсичность и подавление иммунных ответов.В результате ученые также изучают класс лекарств, называемых агонистами TLA, которые, по-видимому, способны стимулировать иммунный ответ, а не «вытряхивать» вирус из укрытия. Ранние исследования на приматах были многообещающими, не только с измеримым сокращением латентных резервуаров, но и со значительным увеличением активации клеток-киллеров CD8.
Как так быстро была найдена вакцина от COVID-19?
Когда во всем мире начинается вакцинация COVID-19, ЮНЭЙДС поговорила с Питером Годфри-Фоссеттом, старшим научным советником ЮНЭЙДС и профессором международного здравоохранения и инфекционных заболеваний Лондонской школы гигиены и тропической медицины, о том, что сдерживает вакцину против ВИЧ. .
Многие спрашивают: «Как вакцина от COVID-19 была найдена так быстро?»
Вирус SARS-CoV-2, вызывающий COVID-19, перешел от животных к людям в 2019 году. В то время как в случае ВИЧ этот скачок произошел 100 лет назад, примерно в 1920-х годах, и стал проблемой в 1980-х годах. когда он начал распространяться среди людей в гораздо большей степени.
Причина, по которой мы наблюдаем такое усиление вакцины против COVID-19, заключается в срочности. В 2020 году COVID-19 заразил почти 100 миллионов человек на планете.В 2020 году COVID-19 уже убил 2 миллиона человек.
Итак, эта срочность возникает, несмотря на то, что мы наблюдаем кардинальные изменения в жизни каждого человека, с изменениями в путешествиях, социальном дистанцировании, масках, мытье рук и дезинфицирующих средствах, и тем не менее, мы все еще наблюдаем быстрый рост инфекций. Это вызывает огромную потребность в создании вакцины. И, конечно же, это имеет огромное экономическое влияние.
ВИЧ и SARS-CoV-2 совершенно разные, верно?
Между SARS-CoV-2 и ВИЧ есть фундаментальные различия.Хотя они оба являются вирусами, SARS-CoV-2 — очень простая инфекция. Заболевание может быть сложным, а иногда и загадочным, но почти у каждого инфицированного SARS-CoV-2 вырабатываются антитела к белку шипа, который нейтрализует вирус и приводит к выздоровлению с удалением вируса.
Напротив, почти у всех инфицированных ВИЧ вырабатываются антитела, и мы используем эти антитела в регулярных тестах на ВИЧ. Но, к сожалению, очень немногие из них вылечивают инфекцию, и этих антител недостаточно для нейтрализации ВИЧ.Оболочка ВИЧ, более или менее похожая на шип, представляет собой сложную структуру на поверхности вируса. Он покрыт сахаром, а активный центр находится глубоко внутри, поэтому с ним трудно взаимодействовать.
По мере того, как люди заражаются ВИЧ, со временем у некоторых людей вырабатываются антитела, способные нейтрализовать ВИЧ, но на это может потребоваться много лет, и, кроме того, ВИЧ — это ретровирус, поэтому мы говорим об антиретровирусных препаратах. Ретровирус — это вирус, который копирует свой генетический код и интегрирует его в генетический код человека.И когда он копирует, он копирует свой генетический код, но делает это неточно, он делает много ошибок. Это означает, что белок оболочки и сам ВИЧ постоянно меняются, меняют свою форму, что затрудняет защиту антител от него, поэтому даже нейтрализующие антитела от одного человека часто не могут нейтрализовать вирус от другого человека.
Мы обнаружили некоторые так называемые широко нейтрализующие антитела, например, антитела, которые нейтрализуют множество различных штаммов ВИЧ.И это те антитела, которые люди изучают в настоящее время и пытаются понять, защищают ли они людей от заражения различными штаммами ВИЧ. Они могли бы стать важной частью процесса разработки вакцины против ВИЧ, если бы мы могли получить более широкие нейтрализующие антитела, которые будут генерироваться до того, как возникнет ВИЧ-инфекция.
Наконец, мы должны помнить, что, в отличие от COVID-19 или, может быть, частично, в отличие от COVID-19, ВИЧ во многом зависит от Т-клеток — другой половины системы защиты человека.В иммунной системе человека есть антитела, но у нее также есть так называемый клеточный иммунитет, которым руководят Т-клетки, и это намного сложнее изучать и гораздо разнообразнее, а также делает ВИЧ сложным и отличным от COVID-19, когда он приходит. к разработке вакцины.
Сколько денег вкладывается в вакцины против ВИЧ?
Каждый год в течение последнего десятилетия мы инвестировали около 1 миллиарда долларов США в исследования и разработки, чтобы попытаться создать вакцину против ВИЧ. Это много или недостаточно? Это около 5% глобального бюджета на борьбу с ВИЧ.Был некоторый ограниченный успех. Еще в 2009 году был большой ажиотаж, когда вакцина-кандидат в Таиланде действительно обеспечила некоторую защиту от ВИЧ-инфекции, но недостаточную для ее массового производства.
И затем, в течение следующего десятилетия, последующие испытания научили нас многому об иммунологии, о том, как человеческий организм и иммунная система взаимодействуют с ВИЧ, но они не привели к снижению числа новых ВИЧ-инфекций. В настоящее время надежда основывается на двух крупных исследованиях, которые в настоящее время находятся в этой области, и в разработке находится много других кандидатов.Так что, я думаю, есть надежда, но в краткосрочной перспективе у нас явно не будет вакцины, как от COVID-19.
COVID-19 попал в заголовки газет — а как насчет других инфекционных заболеваний?
В Африке туберкулез, малярия и ВИЧ убивают в пять раз больше людей в год, чем COVID-19 в этом году в Африке. Это огромные проблемы, и они существуют уже давно. У нас есть вакцина против туберкулеза, вакцина БЦЖ, которую впервые применили 100 лет назад, начиная с 1920 года, но, к сожалению, она не защищает от обычных взрослых форм туберкулеза.Совсем недавно были открыты новые вакцины против туберкулеза и малярии, но они не очень эффективны. Ведутся дискуссии о том, стоит ли их увеличивать, потому что их защитная эффективность составляет всего 30% или меньше.
Хорошая новость заключается в том, что новая вакцина против малярии только что прошла большую фазу трех испытаний в Африке, и на самом деле она производится на той же установке, которая производила вакцину AstraZeneca Oxford COVID-19, поэтому есть надежда, что проводимые исследования вакцины против COVID-19 могут стать выстрелом в руку для всех других важных убийц инфекционных заболеваний, которые на самом деле убивают намного больше людей в Африке и других частях мира с ограниченными ресурсами.
Смотрите: научный советник ЮНЭЙДС объясняет некоторые различия между ВИЧ и COVID-19
Иммунология и неуловимая вакцина против СПИДа
Rerks-Ngarm, S. et al. Вакцинация ALVAC и AIDSVAX для предотвращения заражения ВИЧ-1 в Таиланде. N. Engl. J. Med. 361 , 2209–2220 (2009) Первое испытание вакцины против ВИЧ для человека, показавшее снижение заражения ВИЧ после иммунизации, которое состояло из комбинации четырех первичных доз рекомбинантного вектора канареечной оспы плюс двух бустерных инъекций с рекомбинантным gp120 ВИЧ. .
CAS
PubMed
Google Scholar
Buchbinder, S.P. et al. Оценка эффективности вакцины против ВИЧ-1 с клеточным иммунитетом (Step Study): двойное слепое рандомизированное плацебо-контролируемое испытание концепции. Ланцет 372 , 1881–1893 (2008)
CAS
PubMed
PubMed Central
Google Scholar
МакЭлрат, М.J. et al. Иммунитет, индуцированный вакциной против ВИЧ-1, в тестовом поэтапном исследовании: когортный анализ. Ланцет 372 , 1894–1905 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Gilbert, P. B. et al. Корреляция между иммунологическими ответами на вакцину с рекомбинантным гликопротеином 120 и заболеваемостью ВИЧ-1 в фазе 3 испытания превентивной вакцины против ВИЧ-1. J. Infect. Дис. 191 , 666–677 (2005)
CAS
PubMed
Google Scholar
Альтфельд, М.и другие. Суперинфекция ВИЧ-1, несмотря на широкие Т-клеточные ответы CD8 + , содержащие репликацию первичного вируса. Nature 420 , 434–439 (2002)
ADS
CAS
PubMed
Google Scholar
Haase, A. T. Нацеливание на раннюю инфекцию для предотвращения передачи ВИЧ-1 через слизистые оболочки. Nature 10.1038 / nature08757 (этот выпуск)
Liu, J. et al. Иммунный контроль заражения SIV с помощью вакцины на основе Т-клеток у макак-резусов. Nature 457 , 87–91 (2009)
ADS
CAS
PubMed
Google Scholar
Wilson, N.A. et al. Клеточные ответы, индуцированные вакциной, контролируют репликацию вируса иммунодефицита обезьян после гетерологичного заражения. J. Virol. 83 , 6508–6521 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Хансен, С.G. et al. Ответы эффекторных Т-клеток памяти связаны с защитой макак-резусов от заражения обезьяньим вирусом иммунодефицита слизистой оболочки. Nature Med. 15 , 293–299 (2009) Постоянные эффекторные Т-клеточные ответы CD4 и CD8 памяти были индуцированы у обезьян CMV-векторами, экспрессирующими SIV Gag, Rev-Tat-Nef и Env, и после повторного интраректального заражения низкой дозой SIV, 4 из 12 иммунизированных обезьян были защищены от системного распространения инфекции.
CAS
PubMed
Google Scholar
Коэн, М.С., Хеллманн, Н., Леви, Дж. А., Декок, К. и Ланге, Дж. Распространение, лечение и профилактика ВИЧ-1: эволюция глобальной пандемии. J. Clin. Вкладывать деньги. 118 , 1244–1254 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Кронер, Б. Л., Розенберг, П. С., Аледорт, Л. М., Алворд, В. Г. и Гёдерт, Дж. Дж. Заболеваемость ВИЧ-1 среди лиц с гемофилией в США и Западной Европе, 1978–1990 гг.Многоцентровое когортное исследование гемофилии. J. Acquir. Иммунодефицит. Syndr. 7 , 279–286 (1994)
CAS
PubMed
Google Scholar
Fowke, K. R. et al. Устойчивость к ВИЧ-1-инфекции среди постоянно серонегативных проституток в Найроби, Кения. Ланцет 348 , 1347–1351 (1996)
CAS
PubMed
Google Scholar
Салазар-Гонсалес, Дж.F. et al. Генетическая идентичность, биологический фенотип и пути эволюции вирусов-основателей / вирусов-основателей при острой и ранней инфекции ВИЧ-1. J. Exp. Med. 206 , 1273–1289 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Дикс, С. Г. и Уокер, Б. Д. Контроллеры вируса иммунодефицита человека: механизмы надежного вирусного контроля в отсутствие антиретровирусной терапии. Иммунитет 27 , 406–416 (2007)
CAS
PubMed
Google Scholar
Дюваль, М.G. et al. Поддержание ВИЧ-специфических CD4 + Т-лимфоцитов помогает отличить ВИЧ-2 от инфекции ВИЧ-1. J. Immunol. 176 , 6973–6981 (2006)
CAS
PubMed
Google Scholar
Sodora, D. L. et al. К вакцине против СПИДа: уроки естественного заражения вирусом обезьяньего иммунодефицита африканских приматов-хозяев. Nature Med. 15 , 861–865 (2009)
CAS
PubMed
Google Scholar
Мартин, М.P. et al. Врожденное партнерство подтипов HLA-B и KIR3DL1 против ВИЧ-1. Nature Genet. 39 , 733–740 (2007)
CAS
PubMed
Google Scholar
Наканиши, Ю., Лу, Б., Джерард, К. и Ивасаки, А. CD8 + Мобилизация Т-лимфоцитов в инфицированную вирусом ткань требует помощи Т-лимфоцитов CD4 + . Природа 462 , 510–513 (2009) На модели инфекции HSV-2 мышей показано, что Т-хелперные клетки CD4 контролируют миграцию Т-клеток CD8 в слизистую оболочку посредством секреции IFN-γ и индукции местная секреция хемокинов.
ADS
CAS
PubMed
PubMed Central
Google Scholar
Douek, D.C. et al. ВИЧ преимущественно инфицирует ВИЧ-специфические CD4 + Т-клетки. Nature 417 , 95–98 (2002)
ADS
CAS
PubMed
Google Scholar
Клатт, Н. Р. и др. Наличие активированных CD4 + Т-клеток определяет уровень виремии у естественных SIV-инфицированных сажистых мангабей. J. Clin. Вкладывать деньги. 118 , 2039–2049 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Хасенкруг, К. Дж., Брукс, Д. М. и Диттмер, У. Критическая роль Т-клеток CD4 + в контроле репликации и распространения ретровируса у постоянно инфицированных мышей. J. Virol. 72 , 6559–6564 (1998)
CAS
PubMed
PubMed Central
Google Scholar
Virgin, H.W., Wherry, E. J. и Ahmed, R. Новое определение хронической вирусной инфекции. Ячейка 138 , 30–50 (2009)
CAS
PubMed
Google Scholar
Matloubian, M., Concepcion, R.J. & Ahmed, R. Cd4 + Т-клетки необходимы для поддержания цитотоксических Т-клеточных ответов Cd8 + во время хронической вирусной инфекции. J. Virol. 68 , 8056–8063 (1994)
CAS
PubMed
PubMed Central
Google Scholar
Пайк, р.и другие. Гонка между распространением ретровируса и ответом Т-клеток CD4 + определяет исход острой инфекции дружественного вируса. J. Virol. 83 , 11211–11222 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Окое, А. и др. Глубокое распространение CD4 + / CCR5 + Т-клеток индуцируется истощением лимфоцитов CD8 + , но не учитывает ускоренный патогенез ВИО. J. Exp. Med. 206 , 1575–1588 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Scheid, J. F. et al. Широкое разнообразие нейтрализующих антител, выделенных из В-клеток памяти у ВИЧ-инфицированных. Nature 458 , 636–640 (2009)
ADS
CAS
PubMed
Google Scholar
Hübner, W.и другие. Количественная трехмерная видеомикроскопия передачи ВИЧ через вирусологические синапсы Т-клеток. Наука 323 , 1743–1747 (2009)
ADS
PubMed
PubMed Central
Google Scholar
Уокер, Л. М. и др. Широкие и мощные нейтрализующие антитела от африканского донора открывают новую мишень для вакцины против ВИЧ-1. Science 326 , 285–289 (2009) Используя высокопроизводительный метод скрининга, были выделены два мощных и широко перекрестно-реактивных нейтрализующих антитела, нацеленных на новый широко нейтрализующий эпитоп, экспрессируемый на тримерном белке оболочки и охватывающий консервативные области вариабельные петли субъединицы gp120.
ADS
CAS
PubMed
PubMed Central
Google Scholar
Derdeyn, C.A. et al. Чувствительный к нейтрализации ВИЧ-1 после гетеросексуальной передачи. Наука 303 , 2019–2022 (2004)
ADS
CAS
PubMed
Google Scholar
Chen, L. et al. Структурные основы уклонения от иммунитета в месте прикрепления CD4 на gp120 ВИЧ-1. Наука 326 , 1123–1127 (2009)
ADS
CAS
PubMed
PubMed Central
Google Scholar
Hessell, A. J. et al. Эффективная защита антител с низким титром от повторного заражения SHIV слизистых оболочек в низких дозах у макак. Nature Med. 15 , 951–954 (2009) Это исследование показывает, что системные антитела могут защищать слизистые оболочки от заражения лабораторными вирусными запасами, что указывает на то, что индукция системного гуморального иммунитета может ингибировать распространение ВИЧ.
CAS
PubMed
Google Scholar
Hessell, A. J. et al. Широко нейтрализующее человеческое антитело против ВИЧ 2G12 эффективно защищает от заражения SHIV слизистой оболочки даже при низких титрах нейтрализации сыворотки. PLoS Pathog. 5 , e1000433 (2009)
PubMed
PubMed Central
Google Scholar
Джонсон, П. Р. и др.Вектор-опосредованный перенос генов обеспечивает долгоживущую нейтрализующую активность и защиту от инфекции SIV у обезьян. Nature Med. 15 , 901–906 (2009)
CAS
PubMed
Google Scholar
Nelson, S. et al. Созревание вируса Западного Нила модулирует чувствительность к нейтрализации, опосредованной антителами. PLoS Pathog. 4 , e1000060 (2008) Это исследование показывает, что различия в форме вирусных гликопротеинов на поверхности оболочечного вируса, возникающие во время морфогенеза вируса, могут быть решающим фактором, определяющим степень нейтрализации вируса.
PubMed
PubMed Central
Google Scholar
Квонг, П. Д. и Уилсон, И. А. Антитела к ВИЧ-1 и гриппу: взгляд на антигены по-новому. Nature Immunol. 10 , 573–578 (2009)
CAS
Google Scholar
Hessell, A. J. et al. Рецептор Fc, но не связывание комплемента, важно для защиты антител от ВИЧ. Nature 449 , 101–104 (2007) Это исследование привлекает внимание к тому факту, что in vivo эффекты антител, полученных с помощью вакцины, могут зависеть от взаимодействий между молекулами антител и рецепторами Fc.
ADS
CAS
PubMed
Google Scholar
Мессер, Р. Дж., Диттмер, У., Петерсон, К. Э. и Хасенкруг, К. Дж. Важная роль нейтрализующих вирусов антител в стерилизации иммунитета против ретровирусной инфекции Друга. Proc. Natl Acad. Sci. США 101 , 12260–12265 (2004)
ADS
CAS
PubMed
Google Scholar
Тайлер, К. Л., Манн, М. А., Филдс, Б. Н. и Вирджин, Х. У. Защитные моноклональные антитела против реовируса и их влияние на вирусный патогенез. J. Virol. 67 , 3446–3453 (1993)
CAS
PubMed
PubMed Central
Google Scholar
Мехлхоп, Э.и другие. Активация комплемента необходима для индукции защитного ответа антител против инфекции вируса Западного Нила. J. Virol. 79 , 7466–7477 (2005)
CAS
PubMed
PubMed Central
Google Scholar
Макклеллан, К. Б., Гангаппа, С., Спек, С. Х. и Вирджин, Х. У. Антитело-независимый контроль латентности гамма-герпесвируса посредством индукции В-клетками противовирусных Т-клеточных ответов. PLoS Pathog. 2 , e58 (2006)
PubMed
PubMed Central
Google Scholar
Хасенкруг, К. Дж., Брукс, Д. М. и Чезебро, Б. Пассивная иммунотерапия ретровирусного заболевания: влияние типа главного комплекса гистосовместимости и реакции Т-клеток. Proc. Natl Acad. Sci. США 92 , 10492–10495 (1995)
ADS
CAS
PubMed
Google Scholar
Kiepiela, P.и другие. CD8 + Т-клеточные ответы на различные белки ВИЧ имеют противоречивые ассоциации с вирусной нагрузкой. Nature Med. 13 , 46–53 (2007)
CAS
PubMed
Google Scholar
Chung, C. et al. Не все цитокин-продуцирующие Т-клетки CD8 + подавляют репликацию вируса иммунодефицита обезьян. J. Virol. 81 , 1517–1523 (2007)
CAS
PubMed
Google Scholar
Чен, Х.и другие. Дифференциальная нейтрализация репликации вируса иммунодефицита человека (ВИЧ) в аутологичных Т-лимфоцитах CD4 ВИЧ-специфическими цитотоксическими Т-лимфоцитами. J. Virol. 83 , 3138–3149 (2009) Это исследование показывает, что Т-клетки CD8 широко различаются по своей способности ингибировать репликацию ВИЧ в анализе in vitro , что указывает на то, что большая часть ответа Т-клеток CD8 при хронической инфекции может быть неактуальным.
CAS
PubMed
PubMed Central
Google Scholar
День, С.L. et al. Экспрессия PD-1 на ВИЧ-специфических Т-клетках связана с истощением Т-клеток и прогрессированием заболевания. Nature 443 , 350–354 (2006)
ADS
CAS
PubMed
Google Scholar
Petrovas, C. et al. PD-1 является регулятором вирус-специфической выживаемости Т-лимфоцитов CD8 + при ВИЧ-инфекции. J. Exp. Med. 203 , 2281–2292 (2006)
CAS
PubMed
PubMed Central
Google Scholar
Траутманн, Л.и другие. Повышение экспрессии PD-1 на ВИЧ-специфических Т-клетках CD8 + приводит к обратимой иммунной дисфункции. Nature Med. 12 , 1198–1202 (2006)
CAS
PubMed
Google Scholar
Кауфманн, Д. Э. и др. Повышенная регуляция CTLA-4 ВИЧ-специфическими CD4 + Т-клетками коррелирует с прогрессированием заболевания и определяет обратимую иммунную дисфункцию. Nature Immunol. 8 , 1246–1254 (2007)
CAS
Google Scholar
Querec, T.D. et al. Подход системной биологии предсказывает иммуногенность вакцины против желтой лихорадки у людей. Nature Immunol. 10 , 116–125 (2009) Это исследование показывает, что ряд ранее неизвестных путей связан с эффективными иммунными ответами, индуцированными вакциной против вируса желтой лихорадки, потенциально изменяя то, как мы определяем эффективные ответы и измеряем корреляты иммунитета.
CAS
Google Scholar
Мойр, С.и другие. Доказательства истощения связанных с ВИЧ В-клеток в дисфункциональном компартменте В-клеток памяти у ВИЧ-инфицированных виремических людей. J. Exp. Med. 205 , 1797–1805 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Moir, S. & Fauci, A. S. B-клетки при ВИЧ-инфекции и заболеваниях. Nature Rev. Immunol. 9 , 235–245 (2009)
CAS
Google Scholar
Брукс, Д.Дж., Ли, А. М., Эльзессер, Х., МакГаверн, Д. Б. и Олдстон, М. Б. Блокада ИЛ-10 облегчает Т-клеточные ответы, индуцированные ДНК-вакциной, и улучшает выведение стойких вирусных инфекций. J. Exp. Med. 205 , 533–541 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Brooks, D. G. et al. IL-10 и PD-L1 действуют разными путями, подавляя активность Т-клеток во время стойкой вирусной инфекции. Proc. Natl Acad. Sci. США 105 , 20428–20433 (2008)
ADS
CAS
Google Scholar
Tinoco, R., Alcalde, V., Yang, Y., Sauer, K. & Zuniga, EI. Внутренняя передача сигналов трансформирующего фактора роста β в клетку опосредует вирусспецифичные делеции Т-клеток CD8 + и вирусные персистентность in vivo . Иммунитет 31 , 145–157 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Fröhlich, A.и другие. IL-21R на Т-клетках имеет решающее значение для устойчивого функционирования и контроля хронической вирусной инфекции. Наука 324 , 1576–1580 (2009)
ADS
Google Scholar
Elsaesser, H., Sauer, K. & Brooks, D. G. IL-21 необходим для борьбы с хронической вирусной инфекцией. Наука 324 , 1569–1572 (2009)
ADS
CAS
PubMed
PubMed Central
Google Scholar
Йи, Дж.С., Ду, М. и Зайак, А. Дж. Жизненно важная роль интерлейкина-21 в контроле хронической вирусной инфекции. Наука 324 , 1572–1576 (2009)
ADS
CAS
PubMed
PubMed Central
Google Scholar
Barber, D. L. et al. Восстановление функции истощенных CD8 Т-лимфоцитов во время хронической вирусной инфекции. Nature 439 , 682–687 (2006)
ADS
CAS
PubMed
Google Scholar
Велу, В.и другие. Повышение ВИО-специфического иммунитета in vivo путем блокады PD-1. Nature 458 , 206–210 (2008)
ADS
PubMed
PubMed Central
Google Scholar
Ha, S. J. et al. Усиление терапевтической вакцинации путем блокирования ингибирующих сигналов, опосредованных PD-1, во время хронической инфекции. J. Exp. Med. 205 , 543–555 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Араки, К.и другие. mTOR регулирует дифференцировку Т-лимфоцитов CD8. Nature 460 , 108–112 (2009) Показано, что введение «иммунодепрессивного» препарата рапамицина усиливает ответы Т-клеток памяти, что повышает вероятность того, что сочетание фармакологического и вакцинного подходов может повысить иммунитет.
ADS
CAS
PubMed
PubMed Central
Google Scholar
Лу, В., Арраес, Л. К., Феррейра, В.T. & Andrieu, J.M. Терапевтическая вакцина на основе дендритных клеток от хронической инфекции ВИЧ-1. Nature Med. 10 , 1359–1365 (2004)
CAS
PubMed
Google Scholar
Лунд, Дж. М., Хсинг, Л., Фам, Т. и Руденский, А. Ю. Координация раннего защитного иммунитета против вирусной инфекции с помощью регуляторных Т-клеток. Наука 320 , 1220–1224 (2008)
ADS
CAS
PubMed
PubMed Central
Google Scholar
Чжу, Дж.и другие. Вирус-специфичные Т-клетки CD8 + накапливаются возле сенсорных нервных окончаний в коже половых органов во время субклинической реактивации ВПГ-2. J. Exp. Med. 204 , 595–603 (2007)
CAS
PubMed
PubMed Central
Google Scholar
Gebhardt, T. et al. Т-клетки памяти в нелимфоидной ткани, которые обеспечивают повышенный местный иммунитет во время заражения вирусом простого герпеса. Nature Immunol. 10 , 524–530 (2009) Это исследование предполагает, что могут иметь место тканеспецифические события, которые контролируют долгосрочное присутствие иммунных лимфоцитов в данном месте.
CAS
Google Scholar
Чачу, К. А., Лобуэ, А. Д., Стронг, Д. В., Барич, Р. С. и Вирджин, Х. У. Иммунные механизмы, ответственные за вакцинацию против инфекций слизистых оболочек и лимфатических норовирусов и очищение от них. PLoS Pathog. 4 , e1000236 (2008)
PubMed
PubMed Central
Google Scholar
Paavonen, J. et al. Эффективность вакцины с адъювантом вируса папилломы человека (ВПЧ) -16/18 AS04 против инфекции шейки матки и предрака, вызванного онкогенными типами ВПЧ (PATRICIA): окончательный анализ двойного слепого рандомизированного исследования с участием молодых женщин. Ланцет 374 , 301–314 (2009)
CAS
PubMed
Google Scholar
Кауфман, Д.R. et al. Перенос антигенспецифических Т-лимфоцитов CD8 + на поверхности слизистых оболочек после внутримышечной вакцинации. J. Immunol. 181 , 4188–4198 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Barton, E. S. et al. Латентный период вируса герпеса обеспечивает симбиотическую защиту от бактериальной инфекции. Nature 447 , 326–329 (2007)
ADS
CAS
PubMed
Google Scholar
Вайанд, М.S. et al. Защита живым ослабленным вирусом иммунодефицита обезьян от гетерологичного заражения. J. Virol. 73 , 8356–8363 (1999)
CAS
PubMed
PubMed Central
Google Scholar
Бренчли, Дж. М. и др. Микробная транслокация является причиной системной иммунной активации при хронической ВИЧ-инфекции. Nature Med. 12 , 1365–1371 (2006)
CAS
PubMed
Google Scholar
Slack, E.и другие. Врожденный и адаптивный иммунитет гибко взаимодействуют, чтобы поддерживать мутуализм между хозяином и микробиотой. Наука 325 , 617–620 (2009)
ADS
CAS
PubMed
PubMed Central
Google Scholar
Никс, В. А., Цзян, Б., Махер, К., Строберт, Э. и Оберсте, М. С. Идентификация энтеровирусов у естественно инфицированных приматов, содержащихся в неволе. J. Clin. Microbiol. 46 , 2874–2878 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Финкбайнер, С.R. et al. Метагеномный анализ диареи человека: обнаружение и открытие вирусов. PLoS Pathog. 4 , e1000011 (2008)
PubMed
PubMed Central
Google Scholar
McKenna, P. et al. Микробиом кишечника макаки в норме, лентивирусная инфекция и хронический энтероколит. PLoS Pathog. 4 , e20 (2008)
PubMed
PubMed Central
Google Scholar
Иванов, И.I. et al. Индукция кишечных клеток Th27 сегментированными нитчатыми бактериями. Ячейка 139 , 485–498 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Корбер Б. Т., Летвин Н. Л. и Хейнс Б. Ф. Стратегии Т-клеточной вакцины против вируса иммунодефицита человека, вируса с тысячей лиц. J. Virol. 83 , 8300–8314 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Кил, Б.F. et al. Идентификация и характеристика передаваемых и ранних оболочек вируса-основателя при первичной инфекции ВИЧ-1. Proc. Natl Acad. Sci. США 105 , 7552–7557 (2008)
ADS
CAS
PubMed
Google Scholar
Виннуцци, М., Стоун, Дж. К., Арнольд, Дж. Дж., Камерон, К. Э. и Андино, Р. Разнообразие квазивидов определяет патогенез через кооперативные взаимодействия в вирусной популяции. Nature 439 , 344–348 (2006) В этом исследовании утверждается, что квазивиды вируса действуют in vivo , придавая вирусу патогенетические свойства, что указывает на то, что квазивиды вирусов играют роль в патогенезе, помимо иммунной. побег.
ADS
CAS
PubMed
Google Scholar
Draenert, R. et al. Ограничения на эволюцию и иммунодоминирование ВИЧ-1 выявлены у взрослых монозиготных близнецов, инфицированных одним и тем же вирусом. J. Exp. Med. 203 , 529–539 (2006)
CAS
PubMed
PubMed Central
Google Scholar
Мур, К. Б. и др. Доказательства адаптации ВИЧ-1 к HLA-ограниченным иммунным ответам на популяционном уровне. Наука 296 , 1439–1443 (2002)
ADS
CAS
PubMed
Google Scholar
Brumme, Z. L.и другие. HLA-ассоциированные пути иммунного ускользания в белках Gag, Pol и Nef ВИЧ-1 подтипа B. PLoS One 4 , e6687 (2009)
ADS
PubMed
PubMed Central
Google Scholar
Miura, T. et al. Элитные контроллеры вируса иммунодефицита человека типа 1 HLA-B57 / B * 5801 отбирают редкие варианты gag, связанные со сниженной репликационной способностью вируса и сильным распознаванием цитотоксических Т-лимфоцитов. Дж.Virol. 83 , 2743–2755 (2009)
CAS
PubMed
Google Scholar
Тройер, Р. М. и др. Изменчивое влияние мутаций ускользания ВИЧ-1 на приспособленность к ответу цитотоксических Т-лимфоцитов (CTL). PLoS Pathog. 5 , e1000365 (2009)
PubMed
PubMed Central
Google Scholar
Schneidewind, A. et al. Структурные и функциональные ограничения ограничивают возможности выхода цитотоксических Т-лимфоцитов в иммунодоминантном HLA-B27-ограниченном эпитопе в капсиде вируса иммунодефицита человека 1 типа. J. Virol. 82 , 5594–5605 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Goepfert, P.A. et al. Передача иммунных мутаций ускользания от Gag ВИЧ-1 связана со снижением вирусной нагрузки у связанных реципиентов. J. Exp. Med. 205 , 1009–1017 (2008)
CAS
PubMed
PubMed Central
Google Scholar
Аллен Т.M. et al. Селекция, передача и реверсия мутации ускользания цитотоксических Т-лимфоцитов процессинга антигена при инфекции вируса иммунодефицита человека 1 типа. J. Virol. 78 , 7069–7078 (2004)
CAS
PubMed
PubMed Central
Google Scholar
Goonetilleke, N. et al. Первый Т-клеточный ответ на переданный вирус / вирус-основатель способствует контролю острой виремии при ВИЧ-1-инфекции. J. Exp. Med. 206 , 1253–1272 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Schneidewind, A. et al. Передача и долговременная стабильность компенсированных мутаций ускользания CD8. J. Virol. 83 , 3993–3997 (2009)
CAS
PubMed
Google Scholar
Fischer, W. et al. Поливалентные вакцины для оптимального охвата потенциальных Т-клеточных эпитопов в глобальных вариантах ВИЧ-1. Nature Med. 13 , 100–106 (2007)
CAS
PubMed
Google Scholar
Neil, S. & Bieniasz, P. ВИЧ, факторы ограничения и интерферон. J Интерферон. Цитокин. Res. 29 , 569–80 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Бушман, Ф. Д. и др. Факторы клетки-хозяина в репликации ВИЧ: метаанализ полногеномных исследований. PLoS Pathog. 5 , e1000437 (2009)
PubMed
PubMed Central
Google Scholar
Santiago, M. L. et al. Apobec3 кодирует Rfv3, ген, влияющий на нейтрализующие антитела, контролирующие ретровирусную инфекцию. Наука 321 , 1343–1346 (2008)
ADS
CAS
PubMed
PubMed Central
Google Scholar
Шихи, А.М., Гаддис, Н. С., Чой, Дж. Д. и Малим, М. Х. Выделение человеческого гена, который ингибирует инфекцию ВИЧ-1 и подавляется вирусным белком Vif. Nature 418 , 646–650 (2002)
ADS
CAS
PubMed
Google Scholar
Sheehy, A.M, Gaddis, N.C. и Malim, M.H. Антиретровирусный фермент APOBEC3G расщепляется протеасомой в ответ на ВИЧ-1 Vif. Nature Med. 9 , 1404–1407 (2003)
CAS
PubMed
Google Scholar
Диносо, Дж.B. et al. Модель макаки, инфицированной вирусом иммунодефицита обезьян, для изучения вирусных резервуаров, которые сохраняются во время высокоактивной антиретровирусной терапии. J. Virol. 83 , 9247–9257 (2009)
CAS
PubMed
PubMed Central
Google Scholar
Blazkova, J. et al. CpG-метилирование контролирует реактивацию ВИЧ с латентного периода.

