Парфюмерия Escentric Molecules – каталог духов от бренда Эксцентрик Молекула
О бренде
Немецкий парфюмер Геза Шён известен во всём мире как автор легендарной «Молекулы». В 2001 году, разочарованный глобальной коммерциализацией индустрии, он покинул свой пост в компании Symrise и стал независимым парфюмером. Поиск новых концепций привёл Шёна к идее о создании «антипарфюмерии», призванной стать провокацией и бунтом против скучных коммерческих ароматов.
Так в 2006 году, с первым ароматом Molecule 01, построенным на основе единственного соединения Iso-e-super, появился его собственный бренд Escentric Molecules (рус. Эссентрик Молекьюлз), положивший начало новому жанру «молекулярных» ароматов. Спустя некоторое время марка выпустила Escentric 01 — минималистическую композицию на основе того же материала, остальные ингредиенты которой выгодно подчеркивают достоинства главного элемента формулы. То, что сначала задумывалось как парфюмерное развлечение и шутка, принесло Гезе Шёну всемирную славу и баснословные прибыли. Люди верили в магическую силу «Молекулы», им нравилось, что она работает на невидимом, неосязаемом уровне восприятия, не раздражая при этом ни владельца, ни окружающих его людей.
В 2008 году Шён выпустил новую парфюмерную пару Molecule 02 / Escentric 02 с идентичной идеей. На этот раз в роли главного компонента оказался амброксан. Через два года появились Molecule 03 / Escentric 03 на основе ветиверил ацетата, а в 2017, во время ежегодной парфюмерной выставки Esxense, марка представила Molecule 04 / Escentric 04 на основе современного сандалового одоранта яванола.
Популярность Escentric Molecules породила не только множество подражателей, но и обратила внимание фальсификаторов парфюмерии. Ароматы Escentric Molecules — одни из самых подделываемых в нишевом сегменте (хотя марку уже давно не считают нишевой)./GettyImages-107885241-58b5c7e23df78cdcd8bbb3ec.jpg) В России официальным дистрибьютором продукции марки является компания Esterk Lux Parfum.
В России официальным дистрибьютором продукции марки является компания Esterk Lux Parfum.
Ароматы Escentric Molecules. Секреты духов с феромонами
туалетная вода (edt)
парфюмерная вода (edp)
одеколон (cologne)
духи (parfum)
ароматизатор для дома
парфюмированная вода для одежды
пена для ванны
гель для тела
крем для бритья
пена для бритья
(парфюмерная вода + парфюмерная вода: роликовая миниатюра)
парфюмерная дымка для тела
парфюмированная салфетка
кондиционер для волос
шампунь-гель для душа
(туалетная вода + сахарный скраб для тела)
(парфюмерная вода + лосьон для тела + тушь)
(парфюмерная вода + шарики для ванны + кулон)
(одеколон + гель для душа + гель после бритья)
(парфюмерная вода + парфюмерная вода + хрустальный флакон)
(парфюмерная вода + бальзам для тела + гель для душа + парфюмерная дымка для волос)
(одеколон + одеколон миниатюры + шампунь)
твердые духи
масляные духи
парфюмерное масло
ароматный спрей для комнаты
лосьон для рук
мерцающий гель
освежающая дымка для тела
сухое масло для тела
спрей после бритья
парфюмированный гель
крем после бритья
пудра для тела
гель для рук и тела
гель для рук
лосьон для рук и тела
ароматический диффузор
масло для массажа и ванны
духи с аппликатором на гелевой основе
(парфюмерная вода + дезодорант)
(туалетная вода: пробник + гель для душа)
ароматическая вода
(парфюмерная вода миниатюра + молочко для тела)
увлажняющий гель
духи для тела
(скраб для тела + масло + масло для тела)
(парфюмерная вода + твердые духи)
(кондиционер для волос + лосьон для тела + шампунь)
(лосьон для тела + мыло + соль для ванны)
(парфюмерная вода + гель для душа + ароматическая свеча)
парфюмерная дымка для волос и тела
(туалетная вода + скраб для тела)
ароматическая вода для тела и ванны
(одеколон + гель для душа + ароматическая свеча)
пакет
(парфюмерная вода + мыло + лосьон для тела)
овал для ароматизации помещений
(парфюмерная вода + парфюмерная вода + гель для душа)
(туалетная вода + туалетная вода + гель для душа)
(туалетная вода + туалетная вода + гель для душа + бальзам после бритья)
(парфюмерная вода + гель для душа + лосьон после бритья)
(туалетная вода + туалетная вода + гель для душа + лосьон для тела)
(парфюмерная вода + крем для рук)
(гель для душа + жидкое мыло)
(одеколон + мыло)
(туалетная вода миниатюра + молочко для тела)
(парфюмерная вода + туалетная вода)
(одеколон + лосьон после бритья)
молочко для душа
(туалетная вода + дезодорант-стик + гель для душа)
(духи + духи)
антисептик
мыло для бритья
(бальзам после бритья + гель для душа + одеколон)
коробка
(одеколон + гель для душа + дезодорант)
подставка для отливантов
(парфюмерная вода + духи)
(парфюмерная вода + парфюмерная вода + крем для рук)
(парфюмерная вода + парфюмерная вода миниатюра + гель для душа + крем для тела)
(парфюмерная вода + парфюмерная вода пробник)
(парфюмерная вода + крем для бритья + дезодорант)
(одеколон + одеколон)
(парфюмерная вода + парфюмерная вода миниатюра + парфюмерная вода миниатюра)
(парфюмерная вода + парфюмерная вода миниатюра + крем для рук)
(парфюмерная вода миниатюра + гель для душа + лосьон для тела)
(туалетная вода миниатюра + шампунь)
(одеколон миниатюра + шампунь)
(парфюмерная вода + помада)
(туалетная вода + румяна)
(туалетная вода + гель для душа + гель для душа)
(парфюмерная вода + тушь)
(туалетная вода + парфюмерная вода + одеколон)
(туалетная вода + помада)
(парфюмерная вода миниатюра + лосьон для тела + крем для тела)
(парфюмерная вода + пуховка для пудры)
(парфюмерная вода + парфюмерная вода миниатюра + молочко для тела)
(духи + духи + лосьон после бритья)
(одеколон + крем для тела)
(туалетная вода + гель для душа + средство после бритья + туалетная вода миниатюра)
(парфюмерная вода + масло для тела + помада)
(парфюмерная вода + помада + тушь)
(туалетная вода пробник + лосьон для тела миниатюра)
(парфюмерная вода + помада + лак)
(туалетная вода миниатюра + гель для душа + лосьон для тела)
(одеколон миниатюра + гель для душа + лосьон для тела)
(туалетная вода + тушь + карандаш для глаз)
(одеколон миниатюра + гель для душа)
(туалетная вода миниатюра + гель для душа + лосьон для тела)
(парфюмерная вода миниатюра + крем для тела)
(парфюмерная вода + туалетная вода миниатюра)
(парфюмерная вода + блеск для губ)
Биологические молекулы • Джеймс Трефил, энциклопедия «Двести законов мироздания»
Жизнь — таинственная, сложная, загадочная — не что иное как совокупность достаточно крупных молекул и довольно простых химических реакций. Если бы вам понадобилось конструировать крупные молекулы, вы пошли бы по одному из двух путей. Либо, как в кустарном ювелирном деле, вы стали строить каждую молекулу «с нуля», проделывая каждый раз уникальную работу. Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала. Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Если бы вам понадобилось конструировать крупные молекулы, вы пошли бы по одному из двух путей. Либо, как в кустарном ювелирном деле, вы стали строить каждую молекулу «с нуля», проделывая каждый раз уникальную работу. Либо — этот путь используется в современных строительных технологиях — вы бы изготовили набор простых молекул, из которых можно собирать самые разнообразные молекулы большего размера, сочетая модули тем или иным образом. Оказывается, именно такое модульное строение имеют биологические молекулы. Согласно теории эволюции, таким и должен был быть самой простой путь к крупным молекулам, поскольку в начале эволюционного процесса необходимость в конструировании очень сложных молекул отсутствовала. Со временем же могли добавляться новые модули, расширяя коллекцию крупных разнородных элементов, что вполне соответствует духу эволюции.
Белки
Основной структурной единицей белков являются молекулы аминокислот. Чтобы понять, что такое аминокислота, представьте себе совокупность атомов, у которых с одной стороны наружу выступает водород, с другой — соединенные между собой кислород и водород, а посередине расположены разнообразные другие компоненты. Подобно тому как бусины нанизываются на нить, из этих аминокислот собираются белки — ион водорода (Н+) одной аминокислоты объединяется с ионом гидроксила (ОН–) другой аминокислоты с образованием молекулы воды. (Представьте, как каждый раз при соединении двух аминокислотных молекул между ними пробегает капелька воды.) Среди белков самую важную роль играют белки-ферменты (см. Катализаторы и ферменты), регулирующие химические реакции в клетках; но белки также являются важными структурными компонентами живых организмов. Например, ваши волосы и ногти состоят из белков.
Углеводы
Углеводы содержат кислород, водород и углерод в соотношении 1:2:1. Во многих живых системах молекулы углеводов выполняют роль источников энергии. Одним из важнейших углеводов можно считать сахар глюкозу, содержащую шесть атомов углерода (С6Н12О6).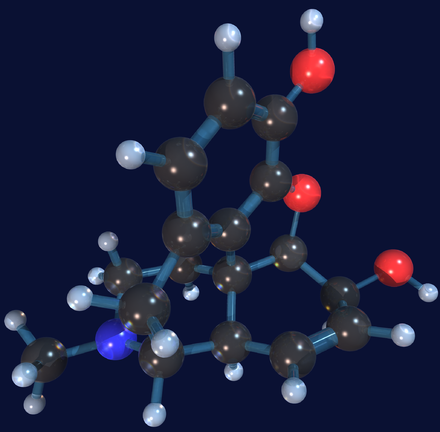 Глюкоза — конечный продукт фотосинтеза и, следовательно, основа всей пищевой цепи в биосфере. Соединяя молекулы глюкозы, как основные строительные модули, можно получить сложные углеводы. Как и белки, углеводы играют вспомогательную роль в клетках, поскольку входят в клеточные структуры. Например, растительные волокна состоят из целлюлозы, которая представляет собой вереницу сцепленных особым образом молекул глюкозы.
Глюкоза — конечный продукт фотосинтеза и, следовательно, основа всей пищевой цепи в биосфере. Соединяя молекулы глюкозы, как основные строительные модули, можно получить сложные углеводы. Как и белки, углеводы играют вспомогательную роль в клетках, поскольку входят в клеточные структуры. Например, растительные волокна состоят из целлюлозы, которая представляет собой вереницу сцепленных особым образом молекул глюкозы.
Липиды
Липиды — это нерастворимые в воде органические молекулы. Вы получите правильное представление о липидах, если вообразите капельки жира, плавающие на поверхности бульона. В живых организмах липиды выполняют две важные функции. Один класс молекул — фосфолипиды — состоят из маленькой головки, содержащей фосфатную группу (атом фосфора, соединенный с четырьмя атомами кислорода), и длинного углеводородного хвоста. Углеводородный хвост этой молекулы гидрофобен, то есть энергетическое состояние молекулы минимально, когда этот хвост находится не в воде. Напротив, фосфатная головка гидрофильна, то есть энергетическое состояние молекулы минимально при контакте головки с водой . Если поместить молекулы фосфолипидов в воду, они будут стремиться достичь минимального энергетического состояния и выстроятся таким образом, что их хвосты окажутся вместе, а головки — врозь. Такая двухслойная структура очень стабильна, поскольку головки будут в контакте с водой, но вода будет вытеснена из области, окружающей хвосты молекул. Для перемещения липидным молекулам необходима энергия — либо чтобы удалить гидрофильные участки из воды, либо чтобы поместить в воду гидрофобные участки. Из таких липидных двухслойных структур состоят клеточные мембраны и мембраны, разделяющие компоненты клетки. Эти пластичные и прочные молекулы отделяют живое от неживого.
Кроме того, в липидах запасается энергия. Липиды могут накапливать примерно вдвое больше энергии на единицу массы, чем углеводы. Вот почему, когда вы переедаете и ваш организм хочет запасти энергию на случай непредвиденных обстоятельств в будущем, когда пищи не будет, он станет запасать ее в форме жира. На этом простом факте строится многомиллиардная индустрия диетических продуктов.
На этом простом факте строится многомиллиардная индустрия диетических продуктов.
Нуклеиновые кислоты
Молекулы ДНК и РНК (см. Центральная догма молекулярной биологии) переносят информацию о химических процессах, идущих в клетке, и участвуют в передаче содержащейся в ДНК информации в цитоплазму клетки. В ДНК живого организма закодированы белки-ферменты, которые катализируют все химические реакции, происходящие в этом организме.
Молекулы-переносчики энергии
Жизнедеятельность требует затрат энергии. В частности, нужно, чтобы энергия, произведенная в одном месте, могла быть использована в другом. Эту функцию в клетке осуществляет целая армия специализированных молекул. Пожалуй, самые важные из них — аденозин трифосфат (АТФ) и аденозин дифосфат (АДФ). Обе молекулы устроены так: группа из атомов углерода, водорода и азота (она называется аденин) присоединена к молекуле рибозы (это сахар), и все это вместе крепится к хвосту из фосфатов. Из названий молекул понятно, что в хвосте АДФ содержится два фосфата, а в хвосте АТФ — три. Когда в клетке происходит химический процесс, например фотосинтез, образующаяся энергия идет на присоединение третьего фосфата к хвосту АДФ. Полученная молекула АТФ затем переносится в другие части клетки. Там запасенная энергия может быть использована в других химических процессах: она выделяется при отщеплении последнего фосфата от АТФ, в результате чего АТФ вновь превращается в АДФ.
Как мы уже упоминали, существуют и другие молекулы, которые переносят энергию в клетке. Набор таких молекул чем-то напоминает разные варианты оплаты счетов. Вы можете выбрать наличные, банковский перевод, кредитную карту и т. д. — в зависимости от того, какой способ вам удобнее. Так же и клетка для поддержания своей жизнедеятельности может использовать АТФ (эквивалент наличных денег) или любую другую из большого набора более сложных молекул.
См. также:
Сравнение Escentric Molecules и Molecule Escentric
Escentric Molecules или Molecule Escentric ???
Этим вопросом ежедневно задаются покупатели, решившие приобрести этот заветный аромат с магическим составом.
В чем же магия аромата и где подводные камни, которые вынудят Вас расстроиться ???
Настоящим прорывом в мире парфюмов стало открытие аромата ESCENTRIC MOLECULES. Уникальное творение принадлежит гениальному парфюмеру Геза Шоэну (Geza Schoen), который после презентации этого запаха получил мировую известность. Над ним он работал более 12 лет, вложив в творение не только свой талант, но и частичку души. Популярность парфюма во многом объясняется инновационным подходом к процессу, а также уникальным составом, не имеющим аналогов.
Открытие молекулы «Iso E Super»
Основа этого парфюма — оригинальная молекула, получившая название «Iso E Super». По своим свойствам и степени воздействия на человека этот компонент схож с феромонами. В небольших объемах она вырабатывается нашим телом и отвечает за создание личного аромата. Условно ее можно отнести к возбуждающим средствам, ведь именно по этой характеристике мы подсознательно выбираем симпатичных нам людей и даже находим любовь на всю жизнь. «Iso E Super» усиливает ваш естественный запах, а значит и сексуальность. Аромат обеспечит дополнительную притягательность для других людей, выделит и подчеркнет личность.
Появление молекулы произошло в 2006 году, когда автор продемонстрировал свой знаменитый парфюм MOLECULE. Его характерное отличие — сложный букет и медленное проявление. Поначалу может показаться, что аромат быстро исчезает, но его главное особенностью будет взаимодействие с флюидами и дальнейшее эффектное проявление. Вы словно будете окружены неповторимой и очень возбуждающей аурой, усиливающей вашу привлекательность в подсознании других людей. По сути «Iso E Super» позволяет проявиться вашей сексуальности, причем естественным образом усиливает ее притягательность в глазах окружающих.
ESCENTRIC включали в составе 65% концентрации «Iso E Super». Дополнительно парфюмерная композиция включает ладан, концентрат стираксового дерева и смолу мастикового дерева. Это совершенно новое сочетание, можно сказать прорыв в мире ароматов. Действие усиливается за счет древесных и мускусных ноток в составе, завораживая и восхищая. Парфюм не заглушает естественный запах тела, создавая некую дымку из натуральных ноток.
Действие усиливается за счет древесных и мускусных ноток в составе, завораживая и восхищая. Парфюм не заглушает естественный запах тела, создавая некую дымку из натуральных ноток.
Эволюция MOLECULE и ESCENTRIC, отличия и особенности
Molecule 01 представлен отчетливыми древесными нотками в составе. Он окутывает тело чувственным шлейфом, расслабляет и вдохновляет. Аромат понравится любителям ярких насыщенных тонов, а также натуральных запахов. Он заставляет мечтать и думать о великом. Подойдет для сильных и целеустремленных натур, не боящихся выйти за привычные рамки.
Escentric 01 — аромат, имеющий душу. Он несравним с любыми другими парфюмами, его состав уникален, а первое впечатление останется в памяти надолго. Главное отличие — полное разрушение канонов парфюмерного искусства. Запах не имеет трехступенчатую классификацию (базы, сердца, шлейфа), проявляется ярко и сразу. Он идеально дополнит образ энергичного и делового человека, станет его отличительной особенностью и «визитной карточкой». В составе можно различить тона розового перца, лайма и ириса. Это свежий и умопомрачительный аромат, очень актуальный в современном темпе жизни.
Второе поколение уникальных парфюмов автор продемонстрировал в 2008 году. Вторая молекула стала основой Molecule 02 и Escentric 02. В первом парфюме она является доминирующей, а для Escentric 02 создан целый букет дополнительных компонентов.
Molecule 02 считается довольно спорным парфюмом, который понравится далеко не каждому. «Iso E Super» может проявляться по-разному, в зависимости от пигментов кожи и естественного запаха обладателя. Именно поэтому обязательно стоит протестировать выбранный парфюм на своей коже. Так можно заранее оценить возможную комбинацию. Для одних это будет восхитительная древесная дымка, а для других — пустой запах с резкими нотками спирта.
Escentric 02 отличается свежестью, в составе отчетливо угадываются нотки мускуса, ириса, бузины и ветивера. Аромат считается универсальным, подходящим для представителей обеих полов. Такой эффект неслучаен, ведь аромат раскрывается совершенно разными гранями. Впервые почувствовав этот пряный букет, забыть его просто невозможно.
Такой эффект неслучаен, ведь аромат раскрывается совершенно разными гранями. Впервые почувствовав этот пряный букет, забыть его просто невозможно.
Презентация третьей коллекции «молекул» проводилась в конце осени в 2010 году. Долгожданное событие не принесло разочарования, ведь Molecule 03 и Escentric 03 позволили открыть формулу с совершенно новой стороны.
Molecule 03 базируется на основе ветивера, напоминая часто используемую при создании парфюмов индийскую траву. Это деликатные древесно – зеленые нотки, вызывающие контрастные ассоциации. В составе также присутствуют запахи зеленого чая, мексиканского лайма и египетского жасмина.
Escentric 03 в основе также имеет ветивер, но отличается более мощным и насыщенным ароматом. Букет из мексиканского лайма, имбиря, зеленого перца и ириса подарят чувство бодрости и свежести на целый день.
Уникальные ароматы Escentric Molecules находят отклик в душе, отличаясь простыми нотками естественной гаммы. В них влюбляются раз и на всю жизнь.
Жизненно важные молекулы. Эксперименты показали, что в космосе могут возникнуть биологические молекулы
Ученые из Объединенного института ядерных исследований (ОИЯИ) в Дубне совместно с коллегами из Италии проводили эксперименты по облучению протонами высоких энергий жидкого формамида и взвешенных в нём частичек метеоритов. Исследователи облучали эту смесь пучком протонов на ускорителе, имитируя влияние космических лучей.
«У нас в Объединенном институте ядерных исследований есть мощные ускорительные установки, которые позволяют разгонять до космических энергий ядра различных элементов, от протонов до тяжелых ядер. На фазотроне — ускорителе протонов, мы проводили эксперименты по облучению формамида в комбинации с различными классами метеоритов», — рассказал директор Лаборатории радиационной биологии ОИЯИ, член-корр. РАН Евгений Красавин.
Ученые использовали 12 видов метеоритов, вещество которых выступало катализатором процесса образования биологических молекул.
«Образуются все типы оснований, которые входят в состав ДНК и РНК, различные аминокислоты, в том числе незаменимые, сахара — все, из чего можно построить живые системы. Основной вывод, который можно сделать на основании этого: жизнь может зародиться в любых уголках Вселенной, то есть информационные макромолекулы могут построиться и, при наличии подходящих условий, двинуться в своем развитии дальше», — сказал Евгений Красавин.
Исследования условий, в которых могли возникнуть первые молекулы, необходимые для возникновения жизни, начались в 1950-х годах с экспериментами Миллера-Юри, которые показали возможность спонтанного возникновения аминокислот при пропускании электрического заряда в смеси газов, имитировавших атмосферу древней Земли. До сих пор в подобных экспериментах ученые больше сосредотачивались на воспроизведении земных условий. Теперь же результаты Красавина и его коллег позволяют строить предположения о возможности существования жизни, подобной земной, и в других частях Вселенной.
Формамид (амид муравьиной кислоты, HCONh3) — подходящий кандидат для подобных экспериментов, так как астрономы уже наблюдали это химическое вещество в составе огромного, массой в три миллиона раз больше солнечной, газопылевого облака Стрелец B2. Ученые предполагают, что формамид широко распространен во Вселенной. Кроме того, более ранние исследования показали, что при нагреве и воздействии ультрафиолетового излучения из формамида могут образовываться азотистые основания, из которых состоят молекулы, служащие для передачи наследственной информации в живых организмах, — ДНК и РНК.
Работа Евгения Красавина и его коллег опубликована в журнале Proceedings of the National Academy of Sciences.
Екатерина Боровикова
Ученые открыли подавляющую развитие коронавирусов молекулу РНК | Новости | Известия
Молекулярные биологи из России обнаружили в клетках человека и мышей короткую молекулу РНК, способную соединяться с частицами различных видов коронавирусов и замедлять их размножение.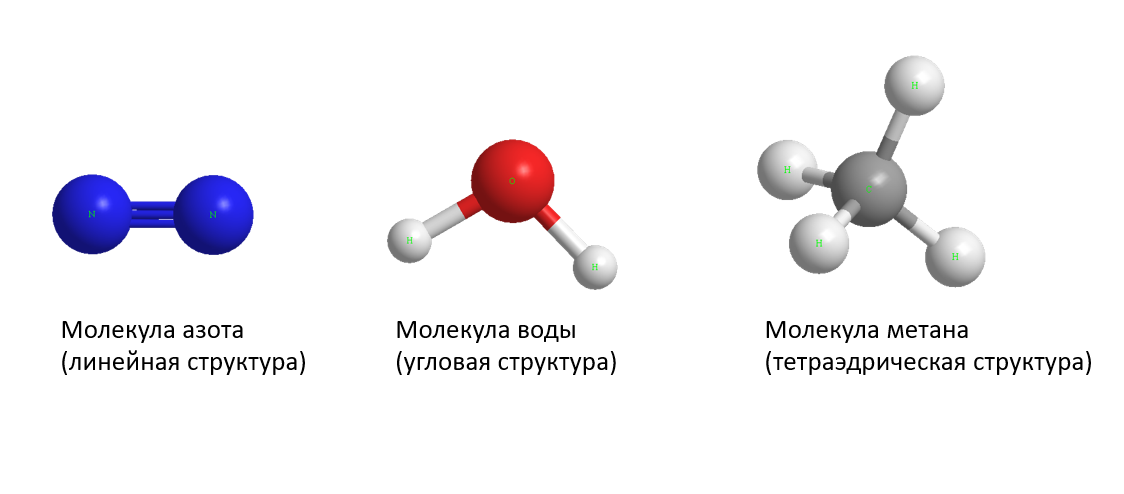 Об этом говорится в статье на сайте журнала Peerj.
Об этом говорится в статье на сайте журнала Peerj.
МикроРНК хозяина — важные регуляторы репликации вируса и патогенеза, отметили авторы работы. В ходе исследования оказалось, что микроРНК miR-21-3p обладает большим потенциалом для связывания со всеми коронавирусами, которые могут «использовать» ее для замедления своей репликации на первых порах заражения, для того чтобы отсрочить активный иммунный ответ.
Большое количество коротких нитей РНК вырабатывает большинство живых существ. Они управляют активностью тех или иных генов, связываясь с так называемой матричной РНК.
Искусственные копии подобных микроРНК в настоящее время активно используются в экспериментах и рассматриваются как один из возможных способов борьбы с раком и другими болезнями. Ученые проанализировали, как открытые молекулы микроРНК взаимодействуют с различными компонентами SARS-CoV-2 и других коронавирусов.
В итоге было выделено сразу четыре семейства микроРНК, которые могут связываться со всеми известными коронавирусами человека. Изучив характер их взаимодействий в организме мышей, зараженных вирусом атипичной пневмонии, биологи обнаружили, что концентрация одной из этих молекул, miR-21-3p, была примерно в восемь раз выше нормы в клетках легких больных грызунов.
Из заключения специалистов следует, что вирус эволюционно «накапливает» позиции связывания с данными молекулами микроРНК в процессе мутирования.
Ученые объяснили подобное действие коронавирусов тем, что они пользуются miR-21-3p в качестве замедлителя размножения инфекции. В итоге коронавирус менее заметен для иммунитета на первых этапах развития болезни, именно когда иммунная система может быстро уничтожить все следы вируса в организме.
Принимая во внимание высокое структурное сходство SARS-CoV и SARS-CoV-2, включая общие связывания miR-21-3p, а также тот факт, что эта miRNA обнаруживается в легких человека, полученные результаты открывают новые возможности в понимании патогенеза COVID- 19 и дальнейшего изучения лечения инфекции.
В июле ученые опровергли возможность заражения коронавирусом через укусы комаров.
По состоянию на 14 сентября в России выявлен 1 068 320 случаев коронавируса. Общее число вылечившихся достигло 878 700, скончались 18 635 пациентов, пишет «Газета.ру».
Вся актуальная информация по ситуации с коронавирусом доступна на сайтах стопкоронавирус.рф и доступвсем.рф, а также по хештегу #МыВместе. Телефон горячей линии по вопросам коронавируса: 8 (800) 2000-112.
Наука: Наука и техника: Lenta.ru
Согласно недавним исследованиям американских математиков, запахи следует делить на десять основных категорий. Не на шесть, не на семь и не на восемнадцать, как утверждали ученые в прошлом и позапрошлом веках, а именно на десять. Пытаясь разобраться, откуда взялась эта цифра, «Лента.ру» обнаружила, что о запахах современная наука знает гораздо меньше, чем принято считать, и уж точно меньше, чем хотелось бы. Тем не менее ученым-ольфактологам уже удалось создать «ароматный аналог» белого шума, музыкальный инструмент, играющий запахами, искусственный нос с искусственными соплями. А также целых две несовместимых друг с другом теории обоняния.
Обонятельная система пока остается самой загадочной из всех сенсорных систем человека. С другими органами чувств дела обстоят несколько проще — мы знаем, как воспринимаются и на какие компоненты раскладываются поступающие к ним сигналы. Восприятие цвета, например, основано на работе «красных», «зеленых» и «синих» светочувствительных клеток, пигменты которых улавливают световые волны соответствующей длины. Вкусовые ощущения тоже раскладываются на небольшое количество базовых компонентов, и для большинства из них идентифицированы собственные рецепторы (правда, к «классическим» сладкому, соленому, кислому и горькому вкусам в последнее время прибавляются и другие). Однако ольфактологии, науке об обонянии, до этого пока далеко: ученые не только не могут выделить базовые компоненты запахов, но толком даже не понимают, как устроен механизм их восприятия.
Одну из первых классификаций запахов предложил в XVIII веке шведский ученый, основоположник биологической систематики Карл Линней. В своей работе «Odores medicamentorum», созданной в дополнение к любимой им систематике растений, ученый выделил семь типов запахов: пряные, благовонные, амброво-мускусные, луковые (или чесночные), козлиные, отталкивающие и тошнотворные.
В 1895 году голландский физиолог Гендрик Цваардемакер (Hendrik Zvaardemaker) в монографии «Физиология запахов» переработал систему Линнея, добавив к ней еще два типа — эфирные и горелые — и выделив в каждом типе более мелкие категории. На этом Цваардемакер не остановился и несколькими годами позже изобрел ольфактометр — герметичный сосуд с отходящей от него трубкой, который до сих пор используют для измерения остроты обоняния. Ученый также показал, что некоторые запахи перестают восприниматься, если смешать их с определенными эфирными маслами — жидкими смесями пахучих веществ, выделенных из растений. Такие комбинации веществ получили название пар Цваардемакера, или Z-пар. Например, выяснилось, что запах аммиака заглушается розовым маслом, а запах табака — маслом горького миндаля.
Некоторые ученые пытались представить «летучее царство запахов» в трехмерном виде. Так, немецкий физиолог Ханс Хеннинг (Hans Henning) создал «парфюмерную призму», вершины которой образуют шесть основных, первичных запахов: цветочный, фруктовый, пряный, смолистый, горелый и гнилостный. Внутреннее пространство такой призмы занимают составные ароматы. Другая похожая классификация, предложенная американскими учеными Крокером и Хендерсоном (Crocker, Henderson), основывалась на четырех базовых запахах: ароматный, кислый, горелый и козлиный. Эти простые ароматы, оцененные по шкале от 1 до 8, использовались для описания составных; таким образом, система позволила описать несколько тысяч смесей.
В 1960-х годах британский биохимик Джон Эймур (John E. Amoore), проштудировав всю доступную на тот момент химическую литературу, составил список из семи наиболее часто встречающихся запахов, которые он назвал первичными: камфарные, эфирные, цветочные, мускусные, мятные, едкие и гнилостные. По Эймуру, все существующие запахи представляют собой комбинации семи первичных ароматов, которые в этом смысле аналогичны трем первичным цветам или четырем первичным вкусам. Под свою классификацию Эймур подвел теоретическую базу: предложенная им стереохимическая теория восприятия запахов до сих пор считается основной теорией в ольфактологии, и речь о ней пойдет чуть ниже.
По Эймуру, все существующие запахи представляют собой комбинации семи первичных ароматов, которые в этом смысле аналогичны трем первичным цветам или четырем первичным вкусам. Под свою классификацию Эймур подвел теоретическую базу: предложенная им стереохимическая теория восприятия запахов до сих пор считается основной теорией в ольфактологии, и речь о ней пойдет чуть ниже.
На рубеже XVIII — XIX веков, с развитием парфюмерии, классификацией запахов занялись производители духов. Так, в 1870 году французский химик и парфюмер Эжен Риммель (Eugene Rimmel) — кстати, придумавший первую тушь для ресниц в ее современном варианте — предложил систему из 18 категорий запахов. Такое же количество базовых ароматов было и в классификации Анри Робера (Henri Robert), «штатного» парфюмера Chanel и создателя Chanel No. 19. Но его система появилась почти столетием позже.
Одофон Септимуса Пьесса
В конце XIX века Французское общество парфюмеров разработало свою систему классификации, которая часто используется до сих пор. Последняя версия этой системы (1998 года) включает семь основных категорий: цитрусовые, цветочные, древесные, амбровые, кожаные, фужерные (папоротниковые) и шипровые (от французского Chypre — Кипр, где растет лишайник дубовый мох — один из компонентов таких ароматов).
Из любопытных изобретений парфюмеров стоит также отметить предложенный в 1887 году «одофон» Септимуса Пьесса. Каждому запаху в нем соответствует своя нота, что позволяет создавать гармоничные запаховые «аккорды»: например, ароматы из групп «до», «ми» и «соль» образуют духи «до мажор» (вспомните пианоктейль из «Пены дней» Бориса Виана).
В 1960-1970-х годах к классификации ароматов стали применять математические методы. Так, Сьюзен Шиффман (Susan S. Schiffman) из университета Дьюка с помощью многомерного шкалирования проанализировала набор из 50 пахучих молекул, разделенных предыдущими исследователями на две группы запахов — приятных и неприятных. Изучив целый ряд характеристик этих молекул, Шиффман выделила те признаки, которые коррелируют с распределением их по этим двум группам.
В числе таких признаков оказались молекулярная масса, природа функциональных групп и, в небольшой степени, размер и форма молекул. Так, «приятную» часть шкалы в основном занимали альдегиды, кетоны, эфиры и спирты, а также вещества с высокой молекулярной массой. В «неприятную» группу, напротив, попали вещества с низкой молекулярной массой, а также серо- и азотосодержащие молекулы. Шиффман, однако, отметила, что по отдельности ни один из этих параметров не может использоваться для классификации ароматов.
Наконец, недавно математики из Питсбургского университета составили новую классификацию запахов, разделив их на 10 основных категорий. Ученые проанализировали данные, приведенные в классическом Атласе запахов, изданном Эндрю Дравнеком (Andrew Dravnieks) в 1985 году. В атласе приведены описания запахов 144 чистых веществ. Описания представляют собой таблицу баллов от 0 до 5 по 60 категориям вроде степени фруктовости, сладости и так далее.
Взяв данные Дравнека и представив каждый запах в виде 146-размерного вектора, исследователи применили к ним статистический метод неотрицательной матричной факторизации. Этот метод позволяет разбить единую матрицу данных на несколько более простых матриц, которые в совокупности содержат ту же информацию, то есть, грубо говоря, разделить сложные данные на несколько кластеров естественным образом, без искусственных субъективных категорий.
10 кластеров запахов в двумерном семантическом пространстве. Каждому кругу соответствует запах одного чистого вещества.
Изображение: Jason B. Castro, Arvind Ramanathan, Chakra S. Chennubhotla
Группы запахов: благоухающие, древесные, фруктовые, химические, мятные, сладкие, запахи подобные попкорну, лимонные, едкие запахи и запахи разложения.
Ароматы распределились по 10 кластерам: ароматные, древесные, фруктовые (за исключением цитрусовых), лимонные, мятные, сладкие, запахи, подобные попкорну, химические, едкие и тошнотворные. Как указывают исследователи, полученные категории соответствуют функциям обоняния у млекопитающих, поскольку служат характеристиками съедобности/несъедобности пищи и ее качества.
Впрочем, авторы отмечают, что полученные данные ничего не говорят о том, когда именно происходит разбиение обонятельных сигналов на категории — на этапе рецепторного восприятия или на этапе обработки сигналов в головном мозге. Тут будет кстати вспомнить, как устроена обонятельная система и какие этапы преодолевает запах на пути к нашему мозгу.
Пахучее вещество может войти в наш организм двумя путями — через нос и через рот. Во втором случае, попав в рот с пищей, оно испаряется со слизистой и попадает на обонятельный эпителий (вспомните, например, как по-разному воспринимается горячий и холодный кофе). Именно этим механизмом объясняется «металлический вкус» батарейки, на самом деле являющийся не вкусовой, а обонятельной реакцией.
В 2012 году ученые из Калифорнийского и Стенфордского университетов открыли у дрозофил механизм, обеспечивающий специфичность обонятельных нейронов. Оказалось, что в начале развития нервной системы экспрессия всех генов, кодирующих рецепторы запахов, подавлена. Это обеспечивается эпигенетическими маркерами пассивности — метильными группами, присоединенными к гистонам, белкам-катушкам, на которые намотана ДНК. На примере рецепторов к запаху углекислого газа исследователи показали, что при созревании нейронов специальный белковый комплекс MMB/dREAM снимает маркеры пассивности с тех гистонов, на которые намотан ген рецептора CO2. В результате, этот конкретный ген начинает работать, а все остальные гены рецепторов остаются выключенными. Позже подобный механизм был обнаружен и у мышей. Причем оказалось, что белковый каскад, запускающий активацию гена «нужного» рецептора в конкретном нейроне, одновременно подавляет экспрессию всех остальных рецепторных генов.
Попав на обонятельный эпителий, пахучие вещества возбуждают рецепторы, расположенные на окончаниях обонятельных нейронов. Каждый обонятельный нейрон специфичен: он синтезирует только один тип рецепторов, воспринимающих ограниченное число пахучих веществ. Впервые это показали Ричард Аксель (Richard Axel) и Линда Бак (Linda Buck) из Колумбийского университета, за что в 2004 году они получили Нобелевскую премию по физиологии и медицине.
Впервые это показали Ричард Аксель (Richard Axel) и Линда Бак (Linda Buck) из Колумбийского университета, за что в 2004 году они получили Нобелевскую премию по физиологии и медицине.
Всего же ученые идентифицировали в геноме млекопитающих около тысячи генов, кодирующих обонятельные рецепторы. У человека, впрочем, в связи с утратой роли обоняния их осталось гораздо меньше, около 350.
Как же устроены обонятельные рецепторы и какой механизм позволяет им воспринимать запахи? На первый вопрос ответ известен: у млекопитающих обонятельные рецепторы относятся к группе рецепторов GPCR (G-protein-coupled receptor — G-белок-опосредованные рецепторы), которые, связываясь с сигнальной молекулой на поверхности клетки, активируют присоединенный к внутренней поверхности мембраны G-белок. Этот белок запускает цепь реакций, а они в итоге и приводят к возбуждению нейрона. У насекомых эта система проще: обонятельные рецепторы у них представляют собой обычные ионные каналы, которые при активации сигнальной молекулой меняют свою форму и «открываются», запуская в клетку поток ионов.
Однако на второй вопрос — как именно активируются обонятельные рецепторы — ученые пока ответить не могут. Сегодня на этот счет есть две основных теории — стереохимическая и вибрационная.
Стереохимическую теорию обоняния впервые предложил Джон Эймур, уже упоминавшийся выше. Согласно этой теории, восприятие запахов обусловлено формой и размером молекул пахучих веществ. Для каждого из семи предложенных им «первичных» запахов Эймур описал форму и размер молекул, а также соответствующие им формы рецепторов, которые работают по принципу «ключа и замка». Например, он показал, что все камфарные соединения, хотя и различаются по структурным формулам, обладают сходной округлой формой и даже имеют примерно одинаковый размер — около 7 ангстрем (0,7 нанометра). Мускусный запах, в свою очередь, характерен для дискообразных молекул диаметром около 10 ангстрем. Такого рода описания Эймур предложил для пяти из выделенных им первичных запахов. Исключения составили едкие и гнилостные запахи: форма и размеры их молекул оказались совершенно разными. Ученый, однако, заметил, что для этих ароматов важную роль играет заряд молекул: для веществ с едким запахом характерен положительный заряд молекул, а для веществ с гнилостным запахом — отрицательный. Свою теорию Эймур проверил экспериментально, синтезировав несколько молекул наперед заданной формы и предложив испытуемым различить их с помощью уже знакомого нам ольфактометра. Все синтезированные молекулы обладали предсказанным запахом.
Исключения составили едкие и гнилостные запахи: форма и размеры их молекул оказались совершенно разными. Ученый, однако, заметил, что для этих ароматов важную роль играет заряд молекул: для веществ с едким запахом характерен положительный заряд молекул, а для веществ с гнилостным запахом — отрицательный. Свою теорию Эймур проверил экспериментально, синтезировав несколько молекул наперед заданной формы и предложив испытуемым различить их с помощью уже знакомого нам ольфактометра. Все синтезированные молекулы обладали предсказанным запахом.
Иллюстрация стереохимической теории Эймура
Молекулы трех веществ с запахом миндаля: бензальдегид (А), а-нитротиофен (Б) и циклооктанон (В). Каждая из них укладывается в камфарный, цветочный и мятный рецепторные участки.
Однако не все первичные запахи Эймура пережили дальнейшие эксперименты. Опыты, проведенные французскими учеными Гилло и Ле Магненом (M. Guillot, J. Le Magnen) на добровольцах с частичной аносмией (неспособностью воспринимать определенные запахи), показали, что некоторые люди не различают запаха стеарина, принадлежащего к категории мускусных ароматов, но при этом хорошо чувствуют запахи других мускусов. А это значит, что мускусный запах не является первичным — по крайней мере в том смысле, который вкладывал в это понятие Эймур. Исходя из этого Гилло предположил, что существуют несколько видов рецепторов к мускусному запаху — и у некоторых людей тот или иной тип может отсутствовать.
Вибрационная, или квантовая, теория обоняния впервые была предложена Малкольмом Дайсоном (Malcolm Dyson) в 1938 году. Позже, с распространением теории «ключа и замка», о ней позабыли, однако в 1996 году ее возродил греческий биофизик Лука Турин (Luca Turin). Он предположил, что рецепторы, открытые Акселем и Бак, реагируют вовсе не на форму и размер пахучих молекул, а на их колебательные свойства, на движения атомов молекулы относительно друг друга.
Теория, позже получившая название «теории магнитной карты», в 2011 году была косвенно подтверждена в экспериментах, проведенных командой Турина. Ученые показали, что дрозофилы способны различать по запаху «легкие» и «тяжелые» изотопные формы одного и того же пахучего вещества. В опытах использовали различные изотопные варианты ароматического вещества ацетофенона, в которых часть «легких» изотопов водорода заменили на его «тяжелую» форму — дейтерий. По форме и химическим свойствам такие варианты молекул ничем друг от друга не отличаются, однако из-за разной массы они имеют разные колебательные энергии связей углерод-водород.
Ученые показали, что дрозофилы способны различать по запаху «легкие» и «тяжелые» изотопные формы одного и того же пахучего вещества. В опытах использовали различные изотопные варианты ароматического вещества ацетофенона, в которых часть «легких» изотопов водорода заменили на его «тяжелую» форму — дейтерий. По форме и химическим свойствам такие варианты молекул ничем друг от друга не отличаются, однако из-за разной массы они имеют разные колебательные энергии связей углерод-водород.
Выяснилось, что насекомые не только различают легкие и тяжелые «молекулы-близнецы», но и, научившись избегать одного из них, впоследствии избегают также соответствующую форму других пахучих веществ. Такие дрозофилы начинают избегать нитрилов — молекул с совершенно другой структурной формулой, но сходными колебательными свойствами.
Гобелен «Обоняние» из цикла шпалер «Дама с единорогом» в аббатстве Клюни
Недавно группа Турина провела подобный эксперимент на человеке. Добровольцы, которым предлагали варианты пахучего циклического вещества циклопентадеканона с разным содержанием «легких» и «тяжелых» атомов водорода, оказались способны различать их по запаху. В рамках стереохимической теории обоняния объяснить эти результаты трудно, ведь химические свойства изотопных вариантов были идентичны. Различаются изотопные варианты только колебательными свойствами связей водород-углерод — именно это, по мнению исследователей, и обусловливает разницу восприятия.
Однако большинство ученых относится к вибрационной теории скептически, и не без оснований. Например, исследование 2004 года, проведенное независимой группой ученых в Рокфеллеровском университете Нью-Йорка, противоречило теории Турина: добровольцы не смогли различить запах разных изотопных вариантов ацетофенона (вещество, использовавшееся в экспериментах с дрозофилами). Эти данные подтвердила и команда Турина в своей последней работе.
Критики теории (в том числе Ричард Аксель) считают результаты Турина косвенными и не подтверждающими напрямую вибрационный механизм обоняния.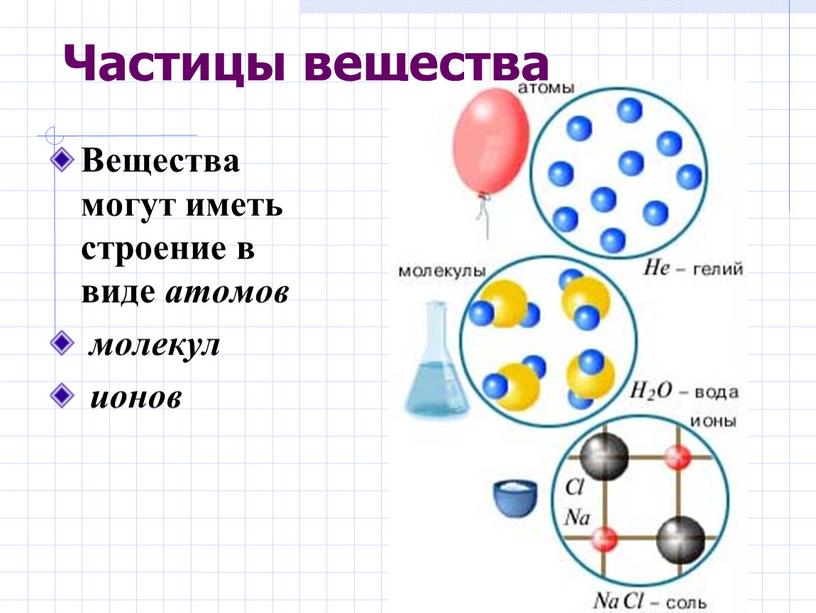 Известно, например, что изменение изотопного состава молекулы меняет ее теплоту адсорбции (количество тепла, выделяющегося при взаимодействии с адсорбентом) и температуры кипения и замерзания молекулы, а также силу водородных связей. Следовательно, при замене «легких» атомов водорода в пахучей молекуле на «тяжелые» изменяется константа связывания этой молекулы с рецептором — а значит, результаты Турина не служат прямым доказательством вибрационной теории, а всего лишь демонстрируют некоторый изотопный эффект, возникающий при обогащении пахучей молекулы атомами дейтерия.
Известно, например, что изменение изотопного состава молекулы меняет ее теплоту адсорбции (количество тепла, выделяющегося при взаимодействии с адсорбентом) и температуры кипения и замерзания молекулы, а также силу водородных связей. Следовательно, при замене «легких» атомов водорода в пахучей молекуле на «тяжелые» изменяется константа связывания этой молекулы с рецептором — а значит, результаты Турина не служат прямым доказательством вибрационной теории, а всего лишь демонстрируют некоторый изотопный эффект, возникающий при обогащении пахучей молекулы атомами дейтерия.
Недавно был опровергнут еще один довод, который Турин приводил в поддержку своей теории. В «классических» рецепторных системах, работающих по принципу «ключа и замка», всегда существуют лиганды, усиливающие работу рецептора (агонисты) или блокирующие его (антагонисты). В рамках же вибрационной теории никаких агонистов и антагонистов у обонятельных рецепторов быть не должно. Долгое время их действительно не обнаруживали, но в итоге все же нашли: японские ученые показали, что окисленная форма ароматического вещества изоэвгенола выступает в качестве антагониста к обонятельным рецепторам изоэвгенола у мышей. Вещества, работающие как обонятельные агонисты и антагонисты, были найдены также и в экспериментах с насекомыми.
От рецепторов сигналы по обонятельному нерву поступают в обонятельную луковицу, расположенную в переднем мозге. Луковица содержит многочисленные клубочки (гломерулы), каждый из которых воспринимает сигналы только от одного типа рецепторов. Различные запахи приводят к возбуждению разного набора клубочков. Именно здесь происходит первичная обработка и категоризация обонятельных сигналов: как показали швейцарские исследователи, постепенные изменения молекулярной структуры пахучих веществ приводят к дискретным изменениям активности отдельных групп клубочков. Обонятельная луковица, таким образом, разбивает все многообразие поступающих в нее сигналов на более крупные категории, которые затем отправляются в «высшие инстанции» мозга — корковый обонятельный центр.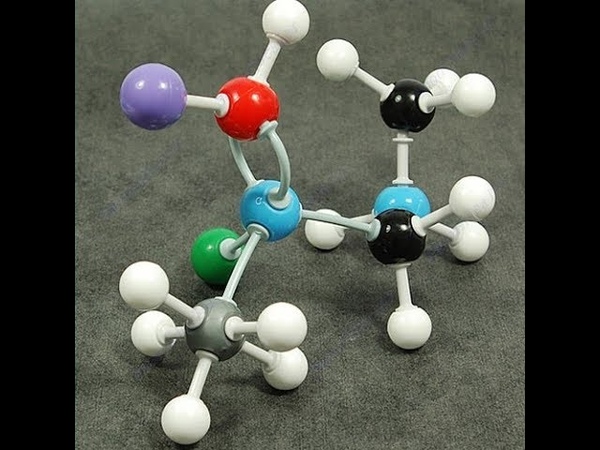
Именно этими механизмами, вероятно, отчасти объясняется феномен обонятельного «белого шума», открытый в 2012 году израильскими физиологами. Предлагая добровольцам сложные смеси из 86 пахучих веществ с одинаковой интенсивностью запаха, ученые показали, что при увеличении числа компонентов в смеси ее аромат становится все менее различимым. Смеси, состоящие из более чем 20 компонентов, чаще всего имели для участников эксперимента «очень сходный» запах, хотя содержали совершенно разные вещества. А смеси из более чем 30 компонентов не смог различить почти никто из добровольцев.
По словам авторов, этот феномен, вероятно, связан со спецификой обработки обонятельных сигналов в мозге. Он упрощает поступающую информацию, разбивая ее на категории. Поэтому нет никакого смысла в составлении сложных духов или специй из сотен компонентов: мозг все равно не захочет утруждать себя их идентификацией.
Впрочем, некоторая польза от таких многокомпонентных смесей все же может быть: как показали исследователи, искусственная смесь из 40 компонентов маскирует относительно «простой» четырехкомпонентный запах розы. Так что обонятельный «белый шум» можно использовать для маскировки запаха общественных туалетов или, например, кокаина и взрывчатых веществ.
Химический сенсор «искусственный нос»
Фото: warwick.ac.uk
Мир запахов пока далек от нашего понимания, но это не мешает ученым разрабатывать искусственные носы на основе выделенных из обонятельного эпителия человека рецепторов и даже снабжать их искусственными соплями. Такие носы планируется использовать для вынюхивания наркотиков, взрывчатых веществ, бактерий и аллергенов. Кроме того, их можно применять для биометрической идентификации личности и даже для диагностики рака. А от создания искусственных носов, наверное, недалеко и до понимания того, как работают носы настоящие.
Какие бывают молекулы?
Молекулы и материя
Молекулы одного вещества схожи по свойствам, но они отличаются от молекул других веществ, молекула состоит из крошечных структурных единиц, называемых атомами.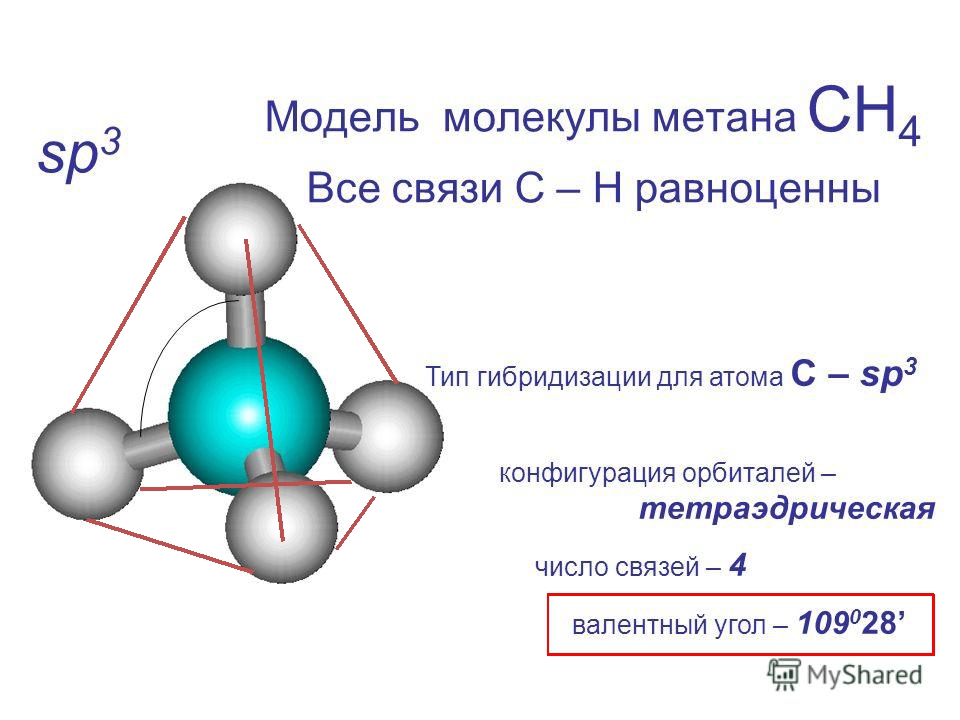 Молекула — это группа из двух или более атомов, которые слипаются, и они очень маленькие. что никто не может их увидеть, кроме как в электронный микроскоп.
Молекула — это группа из двух или более атомов, которые слипаются, и они очень маленькие. что никто не может их увидеть, кроме как в электронный микроскоп.
Различие в молекулах различных веществ обнаруживается в результате различия атомов, которые участвуют в структуре молекулы по количеству атомов, типу атомов и способу их сочетания.
Виды молекул
Виды молекул
Есть три типа молекул: молекула элемента, составная молекула и смесь.
Элемент молекула e
Молекула элемента состоит из одинаковых атомов (одного или нескольких атомов), которые соединяются вместе, Элемент представляет собой простейшую чистую форму материи, которую невозможно проанализировать химическим путем до более простой формы. Молекулы элементов, состоящие из единственного атома (одноатомного) в твердом (медь, железо, алюминий, сера, магний, углерод), жидком (ртуть) и нобелевских газах (гелий, неон, криптон, ксенон и радон).
Молекулы элементов, состоящие из двух атомов (двухатомных), таких как жидкость (бром) и активные газы (кислород, водород, хлор, азот и фтор). Молекулы активных газов двухатомные, например молекулы кислорода, в то время как молекулы инертных газов одноатомные, M эркурий — жидкий элемент, состоящий из одного атома, а бром — жидкий элемент, который является состоит из двух атомов.
Молекулы элементов состоят только из одного типа атомов, они не могут быть разбиты на более простой тип материи ни физическими, ни химическими средствами, и они могут существовать либо в виде атомов (например, аргона), либо в виде молекул. (например, азот).
Составная молекула
Составная молекула состоит из разных атомов. соединение представляет собой вещество, которое образовано из комбинации атомов двух или более различных элементов с постоянным массовым соотношением. Некоторые известные соединения, как молекула хлорида натрия (поваренная соль), молекула воды и молекула аммиака.
соединение представляет собой вещество, которое образовано из комбинации атомов двух или более различных элементов с постоянным массовым соотношением. Некоторые известные соединения, как молекула хлорида натрия (поваренная соль), молекула воды и молекула аммиака.
Составная молекула может быть разбита на более простой тип материи (элементы) химическими средствами, но не физическими средствами. Она имеет свойства, отличные от входящих в ее состав элементов, и всегда содержит то же соотношение составляющих ее элементов. составляющие атомы.
Молекула смеси
Молекула смеси состоит из двух или более различных элементов или соединений, физически перемешанных, Ее можно разделить на компоненты физическими средствами, и она часто сохраняет многие свойства своих компонентов.
Материя, свойства и виды молекул, процесс плавления и испарения
Теории, объясняющие ковалентную связь, правило октета и концепцию перекрывающихся орбиталей
Химическая комбинация, типы связей (химические связи и физические связи)
Координатная связь, Физические связи (водородная связь и металлическая связь)
Молекула — определение, типы и примеры
Определение молекулы
Молекула — это два или более атома, связанных вместе, чтобы образовать единое химическое соединение.Каждый атом несет определенное количество электронов, вращающихся вокруг ядра. Ядро состоит из протонов и нейтронов разного числа в разных элементах. Электроны, вращающиеся вокруг ядра, существуют в различных облаках или валентных оболочках . Эти оболочки предпочитают иметь определенное количество электронов в зависимости от оболочки. Иногда один атом отдает электроны другому атому. Эти атомы меняют свой электрический заряд и становятся ионами. Один будет положительным, а другой — отрицательным. Эти противоположные электрические эффекты притягиваются друг к другу и образуют ионных связей . Эти связи не образуют молекулы, а ионы легко разделяются. Однако иногда атом разделяет электроны.
Эти противоположные электрические эффекты притягиваются друг к другу и образуют ионных связей . Эти связи не образуют молекулы, а ионы легко разделяются. Однако иногда атом разделяет электроны.
Когда два атома имеют общий электрон или несколько электронов, между ними образуется прочная связь, когда электрон переходит от одного ядра к другому и обратно. Эта электронная активность связывает два атома вместе. Молекулы могут образовывать одинарную связь, двойную связь, тройную связь и даже больше, в зависимости от того, сколько электронов они разделяют.Совместное использование электрона известно как ковалентная связь и очень важно в биологии. Ковалентные связи не только сильнее ионных, но и накапливают больше энергии. Организмы могут использовать это в своих интересах, сохраняя энергию в химических связях. Это также означает, что ковалентные связи в пище должны быть разрушены, чтобы получить энергию. Вот почему в нашем организме есть миллионы ферментов, бактерий и грибков, которые действуют вместе, разрывая многие ковалентные связи, присутствующие в нашей пище, и высвобождают энергию.
Примеры молекул
Углеродные молекулы
Углерод, вероятно, является наиболее важным элементом для всех живых организмов. Углерод обладает уникальной способностью образовывать 4 ковалентные связи, которые могут приводить к длинным цепочкам молекул. Все органические молекулы содержат углерод, и способность управлять углеродными связями, вероятно, была очень ранним этапом эволюции жизни. Все типы молекул, описанные ниже, содержат углерод с большим количеством других атомов, ковалентно связанных с углеродом.Углерод, образуя двойные связи с другими атомами углерода, может вращаться вокруг связи. Это может создать молекулу, которая будет гибкой и может иметь различную форму. Большое разнообразие молекул углерода различной формы в биологическом мире вызывает уникальные взаимодействия.
Аденозинтрифосфат (АТФ)
Молекула, которую использует почти каждый организм, — это аденозинтрифосфат или АТФ. Аденозин — это молекула, состоящая из нескольких углеродных колец, как показано на правой стороне молекулы ниже.Левая сторона представляет собой цепочку фосфатных групп, которые представляют собой атомы фосфора, ковалентно связанные с атомами кислорода. Когда связи между этими фосфатными группами разрываются, высвобождается энергия. Обычно АТФ действует как кофермент , передавая энергию от связи ферменту, который может использовать энергию для ускорения химической реакции. Две молекулы присутствуют после разрыва, свободно плавающая фосфатная группа и аденозиндифосфат или ADP. В процессе гликолиза (расщепление глюкозы) и дыхания (использование кислорода для дальнейшего расщепления глюкозы) вырабатывается АТФ, который затем может использоваться для получения энергии в других клеточных процессах.
Аденозин — это молекула, состоящая из нескольких углеродных колец, как показано на правой стороне молекулы ниже.Левая сторона представляет собой цепочку фосфатных групп, которые представляют собой атомы фосфора, ковалентно связанные с атомами кислорода. Когда связи между этими фосфатными группами разрываются, высвобождается энергия. Обычно АТФ действует как кофермент , передавая энергию от связи ферменту, который может использовать энергию для ускорения химической реакции. Две молекулы присутствуют после разрыва, свободно плавающая фосфатная группа и аденозиндифосфат или ADP. В процессе гликолиза (расщепление глюкозы) и дыхания (использование кислорода для дальнейшего расщепления глюкозы) вырабатывается АТФ, который затем может использоваться для получения энергии в других клеточных процессах.
Типы биологических молекул
Свойства молекулы могут сильно отличаться от свойств атомов, из которых она состоит. Например, сахар — это комбинация углерода, кислорода и водорода. Углерод, как вы видели в конце пожара, представляет собой серо-пыльное вещество. Кислород и водород — оба газы. Каким-то образом в сочетании с ковалентными связями нитки углерода с кислородом и водородом становятся сладким и богатым энергией питательным веществом, от которого зависит выживание многих животных.В биологии животные производят множество молекул, но они бывают нескольких типов.
Белки
Белок является одним из наиболее важных типов молекул, продуцируемых клетками. Молекула белка — это полимер . Это означает, что он образован из множества более мелких молекул, известных как мономеры , . Эти молекулы называются аминокислотами. ДНК каждого организма кодирует определенные последовательности аминокислот. Соответствующие аминокислоты связаны друг с другом, и сложное взаимодействие между аминокислотами заставляет их складываться.Эти складки приводят к более сложным структурам. Структура белка позволяет ему функционировать по-разному.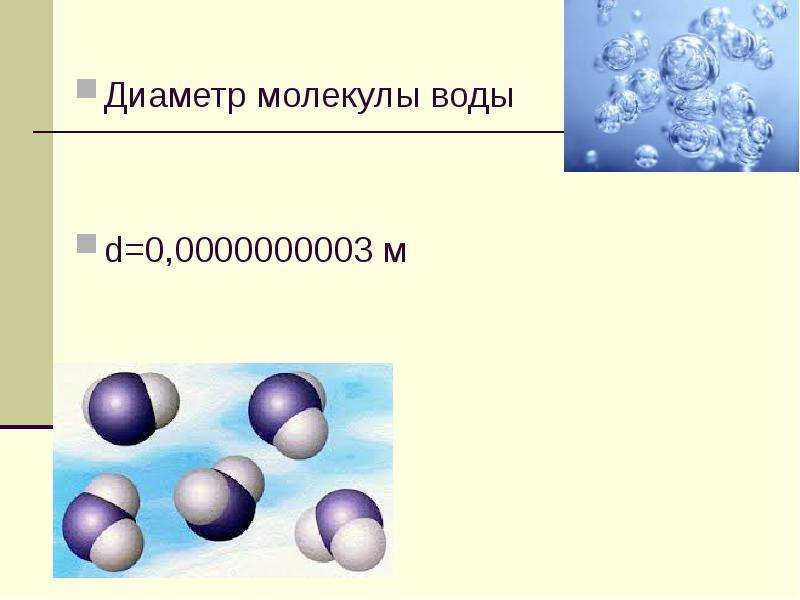
Клетки используют белковые молекулы для решения самых разных задач. Их можно использовать в качестве ферментов для катализирования определенных реакций. Они могут образовывать антитела как часть иммунной защиты организма. Некоторые белки просто хранят аминокислоты для дальнейшего использования. В клеточные мембраны встроены белки, которые позволяют ионам и другим молекулам проходить через мембраны. На нервных клетках белки используются для приема сигналов, посылаемых другими нервами, тем самым передавая сигнал.В мышечных клетках белки отвечают за сокращение мышц. Тем не менее другие белки используются просто как структурная опора. Список функций, для которых клетки используют белковые молекулы, огромен.
Липиды
Другой важный класс молекул — это класс липидов. Липиды — это молекулы, которые плохо смешиваются с водой, и называются гидрофобными . Часто связи в молекулах липидов не создают зарядов и являются неполярными. Эти неполярные молекулы не любят смешиваться с водой, очень полярной молекулой.Липиды также являются полимерами и состоят из двух более мелких молекул, глицерина и жирной кислоты. Эти липидные молекулы хранят много энергии и часто используются в жировых клетках для хранения энергии для организма. Иногда к молекулам липидов прикрепляется гидрофильная или водолюбивая фосфатная головка . Это создает фосфолипид. Многие фосфолипиды можно соединить вместе, чтобы создать клеточные мембраны. Иногда липиды могут превращаться в стероиды или химические вещества, которые заставляют клетки реагировать по-разному.Один из них, холестерин, может влиять на жесткость клеточных мембран, что, в свою очередь, может влиять на жесткость артерий и вен. Это одна из причин, по которой врачи рекомендуют снизить уровень холестерина, чтобы ткани имели правильную текстуру.
Углеводы
В то время как белки и липиды обеспечивают структуру, поддержку и функции ферментов, углеводы в основном отвечают за энергию. Большинство животных перерабатывают какой-либо сахар, чтобы их клетки могли функционировать.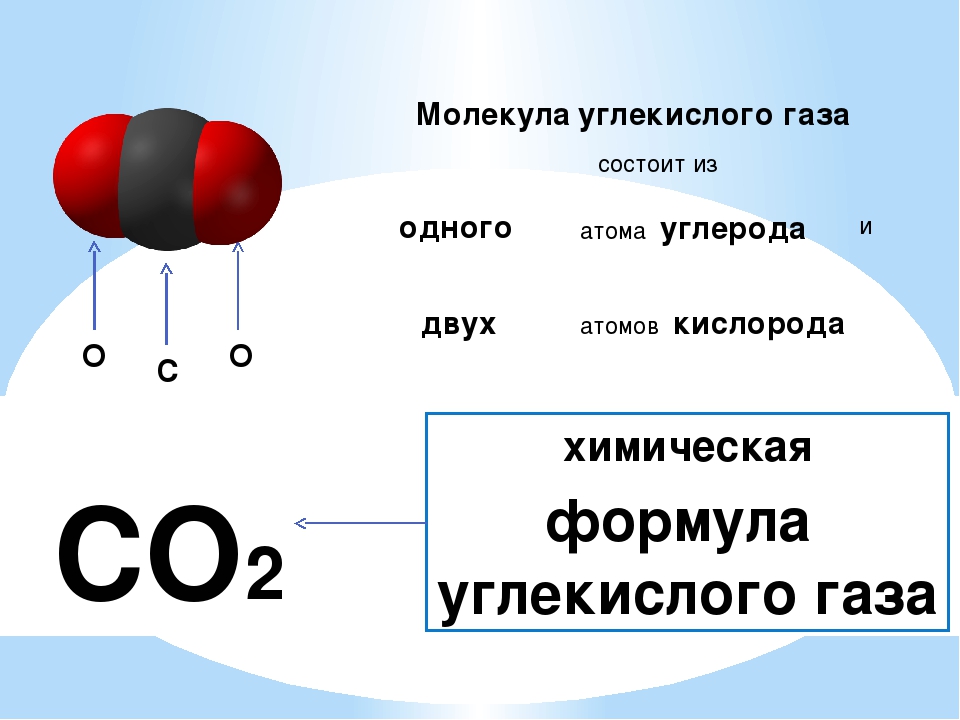 Растения часто хранят эти сахара в виде более сложных углеводов, таких как крахмалы.Отдельные сахара известны как моносахариды , в то время как несколько связанных сахаров называются полисахаридами . Иногда растения используют эти углеводные молекулы для других функций, например, для построения структуры. Основное использование структурных углеводов в растениях — целлюлоза, которую они используют для построения клеточных стенок вокруг своих клеток. При давлении на заполненную водой вакуоль внутри клетки молекулы целлюлозы сдвигаются вместе и становятся жесткими.
Растения часто хранят эти сахара в виде более сложных углеводов, таких как крахмалы.Отдельные сахара известны как моносахариды , в то время как несколько связанных сахаров называются полисахаридами . Иногда растения используют эти углеводные молекулы для других функций, например, для построения структуры. Основное использование структурных углеводов в растениях — целлюлоза, которую они используют для построения клеточных стенок вокруг своих клеток. При давлении на заполненную водой вакуоль внутри клетки молекулы целлюлозы сдвигаются вместе и становятся жесткими.
Как молекула энергии, растения производят глюкозы посредством фотосинтеза.Используя энергию света, растения могут хранить энергию в связях глюкозы. Хотя глюкоза — это молекула, из которой легко получить энергию, ее неудобно хранить. Вместо этого растения объединяют молекулы глюкозы вместе, чтобы сформировать более крупные полисахариды, которые можно складывать и хранить в специализированных клетках для дальнейшего использования. Животные хорошо осведомлены об этом факте, а травоядные могут выжить только за счет глюкозы и других углеводов, присутствующих в растительной материи. Фактически, даже люди могут преуспеть на травоядной диете, потому что растения содержат все необходимые человеку углеводы и белки.
Нуклеиновые кислоты
Самая важная молекула жизни, ДНК, состоит из переплетенных цепочек нуклеиновых кислот. Нуклеиновые кислоты — это молекулы, которые сами по себе ничего не значат, но при последовательном соединении содержат информацию. Информация, которую они несут, может быть «прочитана» определенными белками, которые работают вместе для перевода кодонов ДНК в цепочки аминокислот, которые складываются в функциональные белки. Этот процесс создания белков из информации, содержащейся в молекулах, известен как биосинтез и является основой всей жизни.Организмы могут копировать свои информационные молекулы и передавать свою генетику потомству.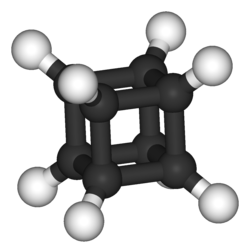 Зарождение жизни, вероятно, началось всего с одной или двух из этих самовоспроизводящихся молекул, и за миллиарды лет расширилось (и сократилось) до того разнообразия, которое мы видим сегодня.
Зарождение жизни, вероятно, началось всего с одной или двух из этих самовоспроизводящихся молекул, и за миллиарды лет расширилось (и сократилось) до того разнообразия, которое мы видим сегодня.
- Валентная оболочка — Электронная оболочка атомов, взаимодействующая с другими атомами.
- Ковалентная связь — Связь между атомами, в которой электроны являются общими.
- Ионная связь — Связь между атомами, вызванная электрическим притяжением между атомами.
- Атом — Отдельная единица элемента или ядро протонов и нейтронов, окруженное электронами.
Тест
1. Что из перечисленного НЕ является молекулой?
A. H 2 O
B. Cl —
C. O 2
Ответ на вопрос № 1
B правильный. Cl — представляет собой пример иона или заряженного атома. Поскольку существует только один атом, это не молекула.O 2 состоит из 2 атомов кислорода, объединенных вместе, образуя молекулу кислорода.
2. Поваренная соль состоит из двух ионов, Na + и Cl — , находящихся в матрице. Ионы не связываются друг с другом, а притягиваются друг к другу и образуют поваренную соль или NaCl. NaCl — это молекула?
A. Да
B. Нет
C. Только когда в матрице
Ответ на вопрос № 2
B правильный.Только ковалентно связанные атомы могут образовывать молекулы. Даже в матрице ионных связей, которая существует в соли, существует только слабая ассоциация между ионами, и они легко могут быть растворены отдельно с помощью растворителя.
3. Полимеры — это связанные вместе мономеры. Пример чего мономеры?
A. Молекулы
B. Атомы
Атомы
C. Ядра
Ответ на вопрос № 3
A правильный. Мономеры и полимеры считаются молекулами, потому что они состоят из атомов, связанных вместе.Полимеры обычно считаются макромолекулами , потому что они очень большие.
молекула | Определение, примеры, структуры и факты
Молекула , группа из двух или более атомов, которые образуют наименьшую идентифицируемую единицу, на которую может быть разделено чистое вещество, но при этом сохраняют состав и химические свойства этого вещества.
Несколько методов представления структуры молекулы. В структурах Льюиса символы элементов представляют атомы, а точки — окружающие их электроны.Пара общих электронов (ковалентная связь) также может быть показана одной чертой. Модель шарика и ручки лучше иллюстрирует пространственное расположение атомов. Для ароматических соединений обычна структура Кекуле, в которой каждая связь представлена тире, атомы углерода подразумеваются там, где встречаются две или более линий, а атомы водорода обычно опускаются. Формулы связи, аналогичные структуре Кекуле, часто используются для сложных неароматических органических соединений. Сахара часто изображают в виде проекций Фишера, в которых углеродный «каркас» изображен в виде прямой вертикальной линии с атомами углерода, подразумеваемыми там, где горизонтальные линии пересекаются с вертикальной.
© Merriam-Webster Inc.
Британская викторина
По химии
Возможно, вы знаете, что элементы составляют воздух, которым мы дышим, и воду, которую мы пьем, но знаете ли вы о них больше? Какой элемент почти такой же легкий, как водород? Что вы называете смесью двух химических элементов? Узнайте ответы в этой викторине.
Разделение образца вещества на все более мелкие части не приводит к изменению ни его состава, ни его химических свойств до тех пор, пока не будут получены части, состоящие из отдельных молекул. Дальнейшее деление вещества приводит к еще более мелким частям, которые обычно отличаются от исходного вещества по составу и всегда отличаются от него по химическим свойствам. На этой последней стадии фрагментации химические связи, удерживающие атомы вместе в молекуле, разрываются.
Атомы состоят из одного ядра с положительным зарядом, окруженного облаком отрицательно заряженных электронов. Когда атомы сближаются друг с другом, электронные облака взаимодействуют друг с другом и с ядрами. Если это взаимодействие таково, что полная энергия системы снижается, тогда атомы связываются вместе, образуя молекулу. Таким образом, со структурной точки зрения молекула состоит из совокупности атомов, удерживаемых вместе валентными силами. Двухатомные молекулы содержат два атома, которые химически связаны.Если два атома идентичны, как, например, в молекуле кислорода (O 2 ), они составляют гомоядерную двухатомную молекулу, а если атомы разные, как в молекуле монооксида углерода (CO), они составляют гетероядерная двухатомная молекула. Молекулы, содержащие более двух атомов, называются многоатомными молекулами, например, диоксид углерода (CO 2 ) и вода (H 2 O). Молекулы полимера могут содержать многие тысячи составляющих атомов.
молекула воды
Молекула воды состоит из двух атомов водорода и одного атома кислорода.Одиночный атом кислорода содержит шесть электронов в своей внешней оболочке, которая может содержать в общей сложности восемь электронов. Когда два атома водорода связаны с атомом кислорода, внешняя электронная оболочка кислорода заполняется.
Encyclopædia Britannica, Inc.
Отношение количества атомов, которые могут быть связаны вместе с образованием молекул, является фиксированным; например, каждая молекула воды содержит два атома водорода и один атом кислорода.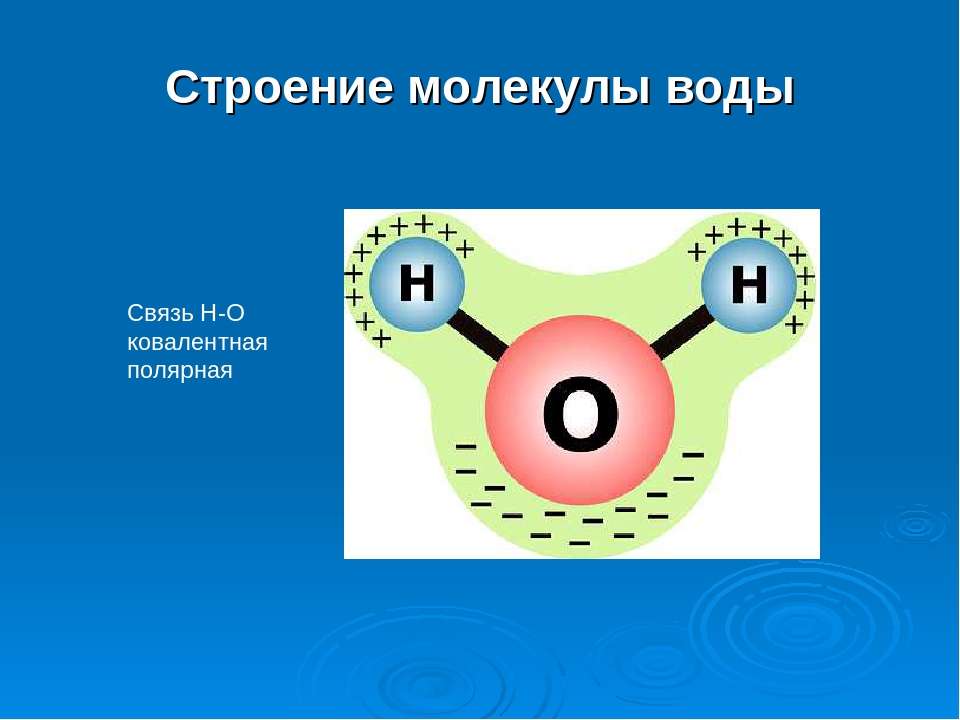 Именно эта особенность отличает химические соединения от растворов и других механических смесей.Таким образом, водород и кислород могут присутствовать в механических смесях в любых пропорциях, но при искрообразовании они соединяются только в определенных пропорциях с образованием химического соединения воды (H 2 O). Одни и те же виды атомов могут объединяться в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода будут химически связываться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически связываться с двумя атомами кислорода с образованием молекулы пероксида водорода (H 2 O 2 ).Кроме того, атомы могут связываться вместе в одинаковых пропорциях с образованием разных молекул. Такие молекулы называются изомерами и различаются только расположением атомов внутри молекул. Например, этиловый спирт (CH 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) оба содержат один, два и шесть атомов кислорода, углерода и водорода, соответственно, но эти атомы связаны по-разному.
Именно эта особенность отличает химические соединения от растворов и других механических смесей.Таким образом, водород и кислород могут присутствовать в механических смесях в любых пропорциях, но при искрообразовании они соединяются только в определенных пропорциях с образованием химического соединения воды (H 2 O). Одни и те же виды атомов могут объединяться в разных, но определенных пропорциях, образуя разные молекулы; например, два атома водорода будут химически связываться с одним атомом кислорода с образованием молекулы воды, тогда как два атома водорода могут химически связываться с двумя атомами кислорода с образованием молекулы пероксида водорода (H 2 O 2 ).Кроме того, атомы могут связываться вместе в одинаковых пропорциях с образованием разных молекул. Такие молекулы называются изомерами и различаются только расположением атомов внутри молекул. Например, этиловый спирт (CH 3 CH 2 OH) и метиловый эфир (CH 3 OCH 3 ) оба содержат один, два и шесть атомов кислорода, углерода и водорода, соответственно, но эти атомы связаны по-разному.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишитесь сейчас
Не все вещества состоят из отдельных молекулярных единиц. Хлорид натрия (обычная поваренная соль), например, состоит из ионов натрия и ионов хлора, расположенных в решетке, так что каждый ион натрия окружен шестью равноудаленными ионами хлора, а каждый ион хлора окружен шестью равноудаленными ионами натрия. Силы, действующие между любым натрием и любым соседним ионом хлора, равны. Следовательно, не существует отчетливого агрегата, идентифицируемого как молекула хлорида натрия. Следовательно, в хлориде натрия и во всех твердых телах подобного типа понятие химической молекулы не имеет значения.Следовательно, формула такого соединения задается как простейшее соотношение атомов, называемое формульной единицей — в случае хлорида натрия — NaCl.
Молекулы удерживаются вместе с помощью общих электронных пар или ковалентных связей. Такие связи являются направленными, что означает, что атомы занимают определенные положения относительно друг друга, чтобы максимизировать прочность связи. В результате каждая молекула имеет определенную, довольно жесткую структуру или пространственное распределение своих атомов. Структурная химия связана с валентностью, которая определяет, как атомы соединяются в определенных соотношениях и как это связано с направлениями и длинами связей.Свойства молекул коррелируют с их структурой; например, молекула воды структурно изогнута и поэтому имеет дипольный момент, тогда как молекула диоксида углерода линейна и не имеет дипольного момента. Выяснение способа реорганизации атомов в ходе химических реакций очень важно. В некоторых молекулах структура не может быть жесткой; например, в этане (H 3 CCH 3 ) существует практически свободное вращение вокруг одинарной связи углерод-углерод.
Положение ядер в молекуле определяется либо из микроволновых колебательно-вращательных спектров, либо с помощью дифракции нейтронов. Электронное облако, окружающее ядра в молекуле, может быть изучено с помощью экспериментов по дифракции рентгеновских лучей. Дополнительную информацию можно получить с помощью методов электронного спинового резонанса или ядерного магнитного резонанса. Достижения в электронной микроскопии позволили получать визуальные изображения отдельных молекул и атомов. Теоретически молекулярная структура определяется путем решения квантовомеханического уравнения движения электронов в поле ядер (называемого уравнением Шредингера).В молекулярной структуре длины связей и валентные углы — это те, для которых молекулярная энергия наименьшая. Определение структур путем численного решения уравнения Шредингера стало высокоразвитым процессом, предполагающим использование компьютеров и суперкомпьютеров.
Молекулярная масса молекулы — это сумма атомных масс составляющих ее атомов./vitamin-c-molecular-model-483948223-582c8a523df78c6f6a473f1c.jpg) Если вещество имеет молекулярную массу M , то M грамм вещества называется одним моль.Количество молекул в одном моль одинаково для всех веществ; это число известно как число Авогадро (6.022140857 × 10 23 ). Молекулярные массы можно определить масс-спектрометрией и методами, основанными на термодинамике или явлениях кинетического переноса.
Если вещество имеет молекулярную массу M , то M грамм вещества называется одним моль.Количество молекул в одном моль одинаково для всех веществ; это число известно как число Авогадро (6.022140857 × 10 23 ). Молекулярные массы можно определить масс-спектрометрией и методами, основанными на термодинамике или явлениях кинетического переноса.
Типы молекулярных связей — University Physics Volume 3
Химические единицы образуются множеством различных видов химических связей. Ионная связь образуется, когда электрон переходит от одного атома к другому. Ковалентная связь возникает, когда два или более атома разделяют электроны.Связь Ван-дер-Ваальса возникает из-за притяжения заряженно-поляризованных молекул и значительно слабее, чем ионные или ковалентные связи. Также существует множество других типов связи. Часто связывание происходит с помощью более чем одного механизма. Основное внимание в этом разделе уделяется ионной и ковалентной связи.
Ионные связи
Ионная связь, пожалуй, самый простой для понимания тип связи. Это объясняет образование солевых соединений, таких как хлорид натрия, NaCl. Атом натрия (символ Na) имеет такое же электронное расположение, что и атом неона, плюс один 3 s электрон.Чтобы удалить этот электрон из атома натрия, требуется всего 5,14 эВ энергии. Следовательно, Na может легко отдать или отдать этот электрон соседнему (соседнему) атому, достигая более стабильного расположения электронов. Хлору (символ Cl) требуется всего один электрон для завершения своей валентной оболочки, поэтому он легко принимает этот электрон, если он находится рядом с атомом натрия. Поэтому мы говорим, что хлор имеет большое сродство к электрону, которое представляет собой энергию, связанную с принятым электроном. Энергия, отдаваемая атомом хлора в этом процессе, равна 3.62 эВ. После того, как электрон переходит от атома натрия к атому хлора, атом натрия становится положительным ионом, а атом хлора становится отрицательным ионом. Полная энергия, необходимая для этой передачи, равна
Полная энергия, необходимая для этой передачи, равна
.
Положительный ион натрия и отрицательный ион хлорида испытывают притягивающую кулоновскую силу. Потенциальная энергия, связанная с этой силой, равна
.
где и — расстояние между ионами.
Когда ионы натрия и хлора движутся вместе («спускаются с холма потенциальной энергии»), сила притяжения между ионами становится сильнее.Однако, если ионы становятся слишком близкими, волновые функции остовных электронов в двух ионах начинают перекрываться. Из-за принципа исключения это действие продвигает остовные электроны — и, следовательно, всю молекулу — в более высокое энергетическое состояние. Равновесное разделительное расстояние (или длина связи) между ионами возникает, когда молекула находится в самом низком энергетическом состоянии. Для двухатомного NaCl это расстояние составляет 0,236 нм. (Рисунок) показывает полную энергию NaCl как функцию расстояния между ионами.
График зависимости энергии от ионного разделения для хлорида натрия. Равновесное разделение происходит, когда полная энергия минимальна.
Полная энергия, необходимая для образования единого солевого блока, составляет
где — энергия, связанная с отталкиванием электронов остова в соответствии с принципом исключения Паули. Значение должно быть отрицательным, чтобы связь образовалась спонтанно. Энергия диссоциации определяется как энергия, необходимая для разделения единицы на составляющие ионы, записывается как
Каждая двухатомная формульная единица имеет свою собственную характерную энергию диссоциации и равновесную длину разделения.Примерные значения приведены на (Рисунок).
Энергия соли Какова энергия диссоциации формульной единицы соли (NaCl)?
Стратегия Хлорид натрия (NaCl) представляет собой соль, образованную ионными связями. Изменение энергии, связанное с этой связью, зависит от трех основных процессов: ионизации Na; принятие электрона от атома Na атомом Cl; и кулоновское притяжение образующихся ионов (). Если ионы подходят слишком близко, они отталкиваются из-за принципа исключения (0,32 эВ).Равновесное разделительное расстояние составляет 900 · 10
Если ионы подходят слишком близко, они отталкиваются из-за принципа исключения (0,32 эВ).Равновесное разделительное расстояние составляет 900 · 10
Решение Изменение энергии, связанное с переносом электрона от Na к Cl, составляет 1,52 эВ, как обсуждалось ранее в этом разделе. При равновесном разделении атомы разнесены. Электростатическая потенциальная энергия атомов 900 · 10
Полная разница энергии, связанная с образованием формульной единицы NaCl, составляет
Следовательно, энергия диссоциации NaCl составляет 4,26 эВ.
Значение Образование формульной единицы NaCl посредством ионной связи является энергетически выгодным.Энергия диссоциации или энергия, необходимая для разделения единицы NaCl на ионы, составляет 4,26 эВ, что соответствует (рисунок).
Проверьте свое понимание Почему потенциальная энергия, связанная с принципом исключения, положительна на (Рисунок)?
Это соответствует силе отталкивания между остовными электронами в ионах.
Для иона натрия в ионном кристалле NaCl выражение для кулоновской потенциальной энергии должно быть изменено на коэффициент, известный как постоянная Маделунга.Этот фактор учитывает взаимодействие иона натрия со всеми соседними ионами хлорида и натрия. Константа Маделунга для кристалла NaCl составляет около 1,75. Это значение подразумевает равновесное расстояние между ионами 0,280 нм, что немного больше, чем для двухатомного NaCl. Мы еще вернемся к этому вопросу позже.
Ковалентные связи
В ионной связи электрон переходит от одного атома к другому. Однако в ковалентной связи электрон распределяется между двумя атомами.Механизм ионной связи не может объяснить существование таких молекул, как и CO, поскольку не существует разделительного расстояния, для которого отрицательная потенциальная энергия притяжения больше по величине, чем энергия, необходимая для создания ионов. Понимание того, как именно такие молекулы связаны ковалентной связью, основывается на более глубоком понимании квантовой механики, которое выходит за рамки данной книги, но мы качественно опишем механизмы в следующем разделе.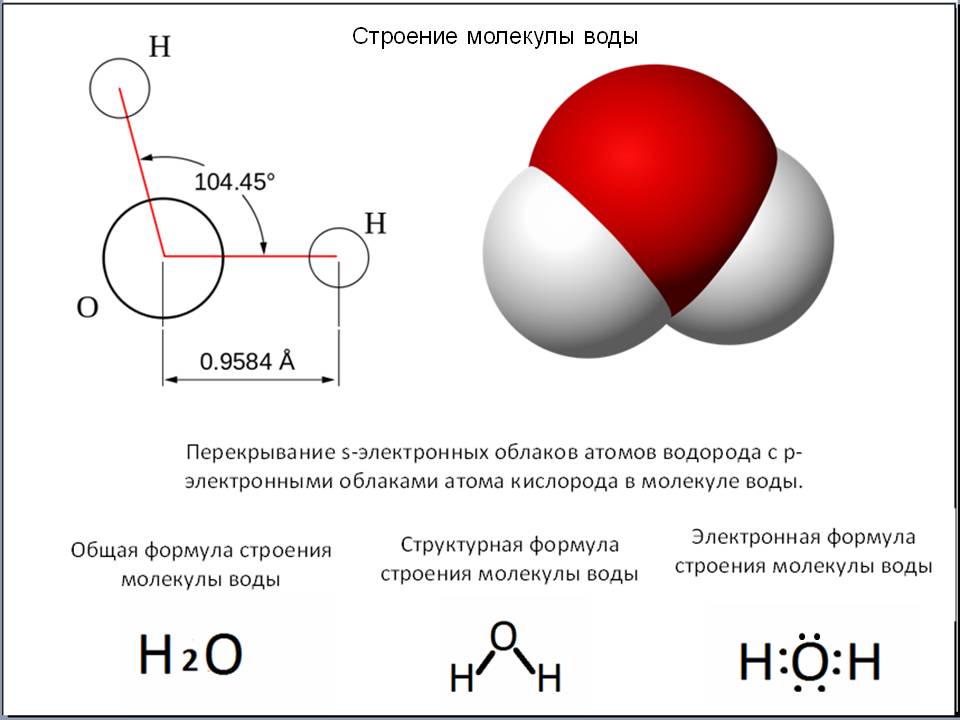
Ковалентные связи можно понять на простом примере молекулы, которая состоит из одного электрона в электрическом поле двух протонов.Эту систему можно смоделировать электроном в двойной квадратной яме ((Рисунок)). Вероятность обнаружения электрона в каждой лунке одинакова, поэтому волновая функция либо симметрична, либо антисимметрична относительно точки на полпути между лунками.
Одномерная модель ковалентной связи в молекуле. (а) Симметричная волновая функция электрона, общая для двух положительно заряженных протонов (представленная двумя конечными квадратными ямами). (б) Соответствующая антисимметричная волновая функция.
А теперь представьте, что две скважины разделены большим расстоянием.В основном состоянии волновая функция существует в одном из двух возможных состояний: либо одиночный положительный пик (синусоидальный «горб») в обеих лунках (симметричный случай), либо положительный пик в одной лунке и отрицательный пик. в другом (антисимметричный случай). Эти состояния имеют одинаковую энергию. Однако, когда ямы сводятся вместе, симметричная волновая функция становится основным состоянием, а антисимметричное состояние становится первым возбужденным состоянием, другими словами, уровень энергии электрона расщепляется.Обратите внимание, что пространственно-симметричное состояние становится энергетически выгодным (с более низкой энергией).
Такой же анализ подходит для электрона, связанного с двумя атомами водорода. Здесь формы волновых функций основного состояния имеют вид или в одномерном измерении. Энергетически выгодное пространственно-симметричное состояние подразумевает высокую плотность заряда на полпути между протонами, где электроны могут стягивать положительно заряженные протоны вместе.
Если к этой системе добавляется второй электрон, чтобы образовать молекулу, волновая функция должна описывать обе частицы, включая их пространственные отношения и относительные спины.Эта волновая функция также должна учитывать неразличимость электронов. («Если вы видели один электрон, вы видели их все».) В частности, переключение или обмен электронами , а не должно вызывать наблюдаемый эффект, свойство, называемое обменной симметрией. Обменная симметрия может быть симметричной , не вызывающей изменения волновой функции, или антисимметричной , производящей общее изменение знака волновой функции — ни одна из которых не наблюдается.
(«Если вы видели один электрон, вы видели их все».) В частности, переключение или обмен электронами , а не должно вызывать наблюдаемый эффект, свойство, называемое обменной симметрией. Обменная симметрия может быть симметричной , не вызывающей изменения волновой функции, или антисимметричной , производящей общее изменение знака волновой функции — ни одна из которых не наблюдается.
Как мы обсудим позже, полная волновая функция двух электронов должна быть антисимметричной при обмене.Например, два электрона, связанные с молекулой водорода, могут находиться в пространственно-симметричном состоянии с антипараллельными спинами или в пространственно-антисимметричном состоянии с параллельными спинами. Состояние с антипараллельными спинами энергетически выгодно и поэтому используется в ковалентной связи. Однако, если протоны стянуты слишком близко друг к другу, становится важным отталкивание между протонами. (В других молекулах этот эффект обеспечивается принципом исключения.) В результате достигается равновесное разделение около 0.074 нм с энергией связи 4,52 эВ.
Квантовая механика исключает многие типы молекул. Например, молекула не образуется, потому что, если третий атом H приближается к двухатомному водороду, волновая функция электрона в этом атоме перекрывается с электронами в двух других атомах. Если все три электрона находятся в основных состояниях своих соответствующих атомов, одна пара электронов имеет одинаковые квантовые числа, что запрещено принципом исключения. Вместо этого один из электронов переводится в более высокое энергетическое состояние.Не существует разделения между тремя протонами, для которых полное изменение энергии этого процесса отрицательно, то есть когда связывание происходит спонтанно. Точно так же он не связан ковалентно при нормальных условиях, потому что у этих атомов нет общих валентных электронов. Когда атомы объединяются, волновые функции остовных электронов перекрываются, и из-за принципа исключения электроны переводятся в более высокое энергетическое состояние. Не существует разделения, для которого такая молекула является энергетически выгодной.
Не существует разделения, для которого такая молекула является энергетически выгодной.
типов химических облигаций | Химия [Магистр]
Введение в склеивание
Химическая связь описывает множество взаимодействий, которые удерживают атомы вместе в химических соединениях.
Цели обучения
Перечислите типы химических связей и их общие свойства
Основные выводы
Ключевые моменты
- Химические связи — это силы, которые удерживают атомы вместе, чтобы образовать соединения или молекулы.
- Химические связи включают ковалентные, полярные ковалентные и ионные связи.
- Атомы с относительно схожей электроотрицательностью обмениваются электронами между собой и связаны ковалентными связями.
- Атомы с большой разницей в электроотрицательности переносят электроны с образованием ионов. Затем ионы притягиваются друг к другу. Это притяжение известно как ионная связь.
Ключевые термины
- связь : связь или сила между соседними атомами в молекуле или соединении.
- ионная связь : притяжение между двумя ионами, используемое для создания ионного соединения. Это притяжение обычно возникает между металлом и неметаллом.
- ковалентная связь : Взаимодействие между двумя атомами, которое включает в себя совместное использование одного или нескольких электронов, чтобы каждый атом удовлетворял правилу октетов. Это взаимодействие обычно возникает между двумя неметаллами.
- внутримолекулярный : Относится к взаимодействиям внутри молекулы.
- межмолекулярные силы : Относится к взаимодействиям между двумя или более молекулами.
Химические связи
Химические связи — это связи между атомами в молекуле. Эти связи включают как сильные внутримолекулярные взаимодействия , так и взаимодействия , такие как ковалентные и ионные связи.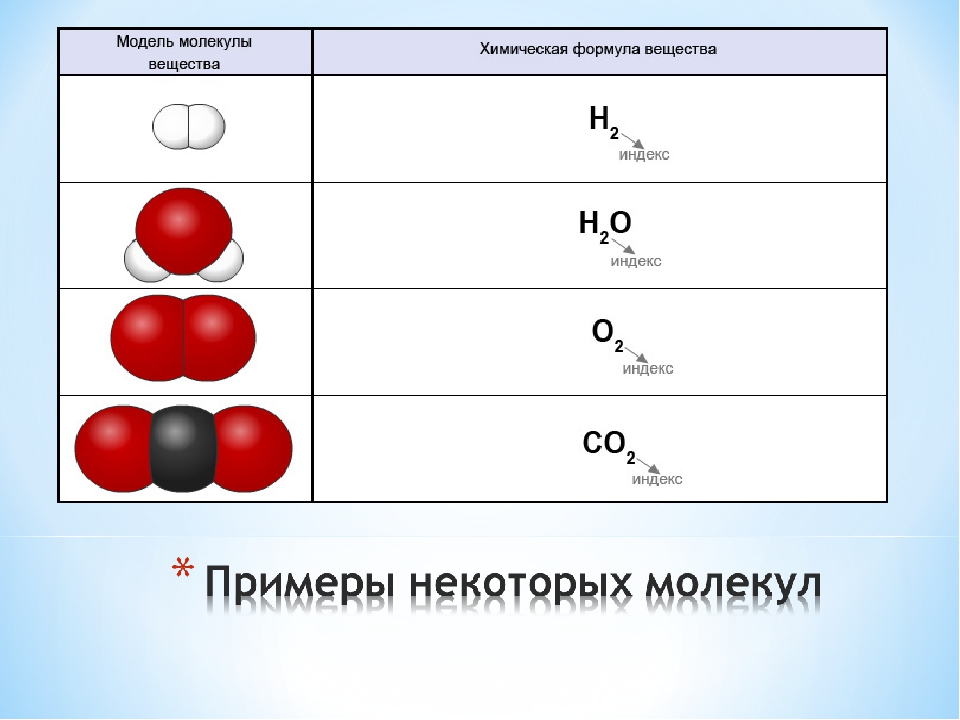 Они связаны с более слабыми межмолекулярными силами , такими как диполь-дипольные взаимодействия, лондонские дисперсионные силы и водородные связи. Более слабые силы будут обсуждены в более поздней концепции.
Они связаны с более слабыми межмолекулярными силами , такими как диполь-дипольные взаимодействия, лондонские дисперсионные силы и водородные связи. Более слабые силы будут обсуждены в более поздней концепции.
Химические связи : На этих рисунках показаны примеры химической связи с использованием точечной нотации Льюиса.Водород и углерод не связаны, в то время как в воде существует одинарная связь между водородом и кислородом. Связи, особенно ковалентные связи, часто представляют в виде линий между связанными атомами. Ацетилен имеет тройную связь, особый тип ковалентной связи, который будет обсуждаться позже.
Ковалентные облигации
Химические связи — это силы притяжения, связывающие атомы вместе. Связи образуются при взаимодействии валентных электронов, электронов внешней электронной «оболочки» атома.Характер взаимодействия между атомами зависит от их относительной электроотрицательности. Атомы с равной или подобной электроотрицательностью образуют ковалентные связи, в которых валентная электронная плотность распределяется между двумя атомами. Электронная плотность находится между атомами и притягивается к обоим ядрам. Этот тип связи чаще всего образуется между двумя неметаллами.
Когда разница в электроотрицательности больше, чем между ковалентно связанными атомами, пара атомов обычно образует полярную ковалентную связь.Электроны по-прежнему распределяются между атомами, но электроны не одинаково притягиваются к обоим элементам. В результате большую часть времени электроны обычно находятся около одного конкретного атома. Опять же, между неметаллами обычно возникают полярные ковалентные связи.
Ионные связи
Наконец, для атомов с наибольшей разницей в электроотрицательности (таких как металлы, связывающиеся с неметаллами), связывающее взаимодействие называется ионным, а валентные электроны обычно представляются как передающиеся от атома металла к неметаллу.После того, как электроны были перенесены на неметалл, и металл, и неметалл считаются ионами. Два противоположно заряженных иона притягиваются друг к другу, образуя ионное соединение.
Два противоположно заряженных иона притягиваются друг к другу, образуя ионное соединение.
Связи, стабильность и соединения
Ковалентные взаимодействия являются направленными и зависят от перекрытия орбиталей, в то время как ионные взаимодействия не имеют особой направленности. Каждое из этих взаимодействий позволяет задействованным атомам получить восемь электронов в своей валентной оболочке, удовлетворяя правило октетов и делая атомы более стабильными.
Эти атомные свойства помогают описывать макроскопические свойства соединений. Например, ковалентные соединения меньшего размера, которые удерживаются вместе более слабыми связями, часто бывают мягкими и податливыми. С другой стороны, дальнодействующие ковалентные взаимодействия могут быть довольно сильными, что делает их соединения очень прочными. Ионные соединения, хотя и состоят из сильных связывающих взаимодействий, имеют тенденцию образовывать хрупкие кристаллические решетки.
Ионные связи
Ионные связи — это подмножество химических связей, которые возникают в результате передачи валентных электронов, обычно между металлом и неметаллом.
Цели обучения
Обобщить характерные особенности ионных связей
Основные выводы
Ключевые моменты
- Ионные связи образуются за счет обмена валентными электронами между атомами, обычно между металлом и неметаллом.
- Потеря или усиление валентных электронов позволяет ионам подчиняться правилу октетов и становиться более стабильными.
- Ионные соединения обычно нейтральны. Таким образом, ионы объединяются таким образом, чтобы нейтрализовать их заряды.
Ключевые термины
- валентных электронов : электроны атома, которые могут участвовать в образовании химических связей с другими атомами. Это самые дальние электроны от ядра.
- правило октетов : атом наиболее стабилен, когда в его валентной оболочке восемь электронов.

Образование иона
Ионные связи — это класс химических связей, которые возникают в результате обмена одного или нескольких валентных электронов от одного атома, обычно металла, на другой, обычно неметалл.Этот обмен электронами приводит к электростатическому притяжению между двумя атомами, которое называется ионной связью. Атом, который теряет один или несколько валентных электронов, чтобы стать положительно заряженным ионом, известен как катион, в то время как атом, который приобретает электроны и становится отрицательно заряженным, известен как анион.
Этот обмен валентными электронами позволяет ионам достигать электронных конфигураций, имитирующих конфигурацию благородных газов, удовлетворяющую правилу октетов. Правило октета гласит, что атом наиболее стабилен, когда в его валентной оболочке восемь электронов.Атомы с менее чем восемью электронами, как правило, удовлетворяют правилу дуэта, имея два электрона в их валентной оболочке. Удовлетворяя правилу дуэта или правилу октетов, ионы становятся более стабильными.
Катион обозначается положительным индексом заряда (+ что-то) справа от атома. Анион обозначается отрицательным индексом заряда (- что-то) справа от атома. Например, если атом натрия теряет один электрон, он будет иметь на один протон больше, чем электрон, что дает ему общий заряд +1.Химический символ иона натрия — Na +1 или просто Na + . Точно так же, если атом хлора получает дополнительный электрон, он становится ионом хлора, Cl — . Оба иона образуются, потому что ион более стабилен, чем атом, из-за правила октетов.
Формирование ионной связи
Когда образуются противоположно заряженные ионы, они притягиваются своими положительными и отрицательными зарядами и образуют ионное соединение. Ионные связи также образуются, когда между двумя атомами существует большая разница в электроотрицательности.Это различие вызывает неравное распределение электронов, так что один атом полностью теряет один или несколько электронов, а другой атом получает один или несколько электронов, например, при создании ионной связи между атомом металла (натрия) и неметаллом (фтор).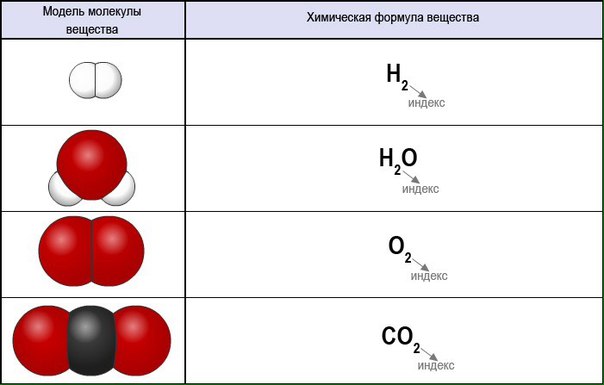 .
.
Образование фторида натрия : Перенос электронов и последующее притяжение противоположно заряженных ионов.
Определение формулы ионного соединения
Для определения химических формул ионных соединений должны выполняться следующие два условия:
- Каждый ион должен подчиняться правилу октетов для максимальной стабильности.
- Ионы соединятся таким образом, что все ионное соединение будет нейтральным. Другими словами, заряды ионов должны уравновешиваться.
Магний и фтор образуют ионное соединение. Какая формула соединения?
Mg чаще всего образует ион 2+. Это связано с тем, что Mg имеет два валентных электрона, и он хотел бы избавиться от этих двух ионов, чтобы подчиняться правилу октетов. Фтор имеет семь валентных электронов и обычно образует ион F —, потому что он получает один электрон, чтобы удовлетворить правилу октетов.Когда Mg 2+ и F — объединяются с образованием ионного соединения, их заряды должны уравновешиваться. Следовательно, одному Mg 2+ нужны два иона F — для нейтрализации заряда. 2+ Mg уравновешивается наличием двух заряженных ионов -1. Следовательно, формула соединения — MgF 2 . Нижний индекс два указывает, что есть два фтора, которые ионно связаны с магнием.
В макроскопическом масштабе ионные соединения образуют структуры кристаллической решетки, которые характеризуются высокими температурами плавления и кипения и хорошей электропроводностью при плавлении или растворении.
Пример
Магний и фтор образуют ионное соединение. Какая формула соединения?
Mg чаще всего образует ион 2+. Это связано с тем, что Mg имеет два валентных электрона, и он хотел бы избавиться от этих двух ионов, чтобы подчиняться правилу октетов. Фтор имеет семь валентных электронов и, как таковой, обычно образует ион F —, потому что он получает один электрон, чтобы удовлетворить правилу октетов.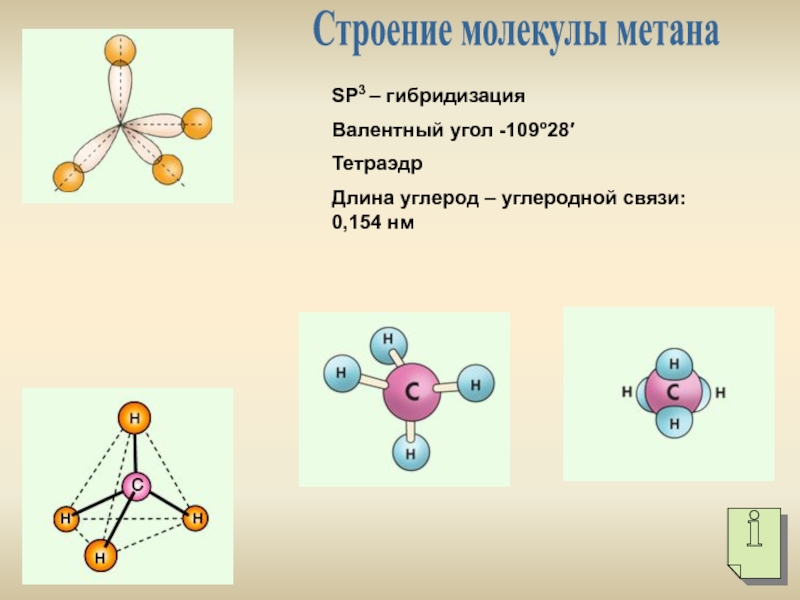 Когда Mg 2+ и F — объединяются с образованием ионного соединения, их заряды должны уравновешиваться.Следовательно, для баланса одного Mg 2+ необходимы два иона F —. 2+ Mg уравновешивается наличием двух заряженных ионов -1. Следовательно, формула соединения — MgF 2 . Нижний индекс два указывает, что есть два фтора, которые ионно связаны с магнием.
Когда Mg 2+ и F — объединяются с образованием ионного соединения, их заряды должны уравновешиваться.Следовательно, для баланса одного Mg 2+ необходимы два иона F —. 2+ Mg уравновешивается наличием двух заряженных ионов -1. Следовательно, формула соединения — MgF 2 . Нижний индекс два указывает, что есть два фтора, которые ионно связаны с магнием.
Ковалентные облигации
Ковалентная связь включает в себя два атома, обычно неметаллов, которые разделяют валентные электроны.
Цели обучения
Различение ковалентных и ионных связей
Основные выводы
Ключевые моменты
- Ковалентные связи включают два атома, обычно неметаллов, которые имеют общую электронную плотность, чтобы сформировать сильные связывающие взаимодействия.
- Ковалентные связи включают одинарные, двойные и тройные связи и состоят из сигма- и пи-связывающих взаимодействий, в которых совместно используются 2, 4 или 6 электронов соответственно.
- Ковалентные соединения обычно имеют более низкие температуры плавления и кипения, чем ионные соединения.
Ключевые термины
- электроотрицательность : тенденция атома или молекулы притягивать электроны и, таким образом, образовывать связи.
- одинарная связь : Тип ковалентной связи, при которой только два электрона разделяются между атомами.
Формирование ковалентных связей
Ковалентные связи — это класс химических связей, в которых валентные электроны распределяются между двумя атомами, обычно двумя неметаллами. Образование ковалентной связи позволяет неметаллам подчиняться правилу октетов и, таким образом, становиться более стабильными. Например:
- Атом фтора имеет семь валентных электронов. Если у него один электрон совместно с атомом углерода (который имеет четыре валентных электрона), у фтора будет полный октет (его семь электронов плюс тот, который он делит с углеродом).

- Углерод будет иметь пять валентных электронов (четыре и один общий с фтором). Ковалентное разделение двух электронов также известно как «одинарная связь». Углерод должен будет образовать четыре одинарные связи с четырьмя различными атомами фтора, чтобы заполнить свой октет. В результате получается CF 4 или четырехфтористый углерод.
Ковалентное связывание требует определенной ориентации между атомами для достижения перекрытия между связывающими орбиталями. Взаимодействия ковалентного связывания включают сигма-связывание ( σ ) и пи-связывание ( π ).Сигма-связи являются самым сильным типом ковалентного взаимодействия и образуются за счет перекрытия атомных орбиталей вдоль оси орбиты. Перекрытые орбитали позволяют общим электронам свободно перемещаться между атомами. Связи Pi представляют собой более слабый тип ковалентных взаимодействий и являются результатом перекрытия двух долей взаимодействующих атомных орбиталей выше и ниже оси орбиты.
Ковалентные связи могут быть одинарными, двойными и тройными связями.
- Одинарные связи возникают, когда два электрона являются общими и состоят из одной сигма-связи между двумя атомами.
- Двойные связи возникают, когда четыре электрона разделяются между двумя атомами и состоят из одной сигма-связи и одной пи-связи.
- Тройные связи возникают, когда шесть электронов разделяются между двумя атомами и состоят из одной сигма-связи и двух пи-связей (см. Более подробную информацию о пи- и сигма-связях).
Ионные соединения против молекулярных соединений
В отличие от ионной связи, ковалентная связь сильнее между двумя атомами с аналогичной электроотрицательностью.Для атомов с равной электроотрицательностью связь между ними будет неполярным ковалентным взаимодействием. В неполярных ковалентных связях электроны поровну распределяются между двумя атомами. Для атомов с разной электроотрицательностью связь будет полярным ковалентным взаимодействием, при котором электроны не будут распределяться поровну.
Ионные твердые вещества обычно характеризуются высокими температурами плавления и кипения наряду с хрупкими кристаллическими структурами. С другой стороны, ковалентные соединения имеют более низкие температуры плавления и кипения.В отличие от ионных соединений, они часто не растворяются в воде и не проводят электричество при растворении.
типов молекулярных моделей | Музей Уиппла
Бета-марганец
Во многих металлах все атомы находятся на одинаковом расстоянии друг от друга и окружены 12 другими атомами (очень похоже на стопки апельсинов в супермаркетах). Однако в случае марганца по не совсем понятным причинам это не так. При комнатной температуре одни расстояния короче других.Это делает расположение управляемых атомов в кристаллической решетке более сложным, чем у большинства других металлов.
При нагревании металлического марганца кристаллическая решетка претерпевает изменения в своей структуре до того, как металл плавится. Эти различные состояния известны как аллотропы и называются альфа, бета, гамма и дельта, чтобы различать их. Между температурами от 700 до 1100 градусов по Цельсию марганец находится в бета-состоянии. Как и в альфа-состоянии, не все атомы находятся на одинаковом расстоянии друг от друга; но, кроме того, атомы существуют в двух различных геометрических формах (показаны красными и зелеными шарами на изображениях 5 и 6).Это не означает, что они представляют собой атомы другого типа, просто их соседние атомы расположены по-другому.
Студентам, изучающим кристаллографию, часто трудно понять концепции различных геометрических узлов в кристаллической решетке, эта проблема усугубляется в сложной кристаллической решетке, такой как бета-марганец. Ч. Э. Чепмен создал эту модель специально, чтобы помочь студенту визуализировать расположение таких участков. Подобные модели до сих пор используются в обучении.
Список литературы
- Гриффин и др., «Атомные модели Курто», Journal of Scientfic Instruments Vol.
 32 (1955), 195–195.
32 (1955), 195–195.
Рут Хорри, «Модели с шаром и спицами», «Изучите коллекции Уиппла», Музей истории науки Уиппла, Кембриджский университет, 2006 г.
Рут Хорри, «Модели, заполняющие пространство», «Изучение коллекций Уиппла», Музей истории науки Уиппла, Кембриджский университет, 2008 г.
Джеймс Хислоп, «Модели кристаллической решетки», Изучите коллекции Уиппла, Музей истории науки Уиппла, Кембриджский университет, 2008.
Chem4Kids.com: Атомы: Соединения
Начнем с молекул. Молекула — это общий термин, используемый для описания любых атомов, связанных химическими связями. Каждая комбинация атомов — это молекула. Соединение — это молекула, состоящая из атомов разных элементов. Все соединения являются молекулами, но не все молекулы являются соединениями. Газообразный водород (H 2 ) представляет собой молекулу, но не соединение, поскольку состоит только из одного элемента. Воду (H 2 O) можно назвать молекулой или соединением, потому что она состоит из атомов водорода (H) и кислорода (O).
Существует два основных типа химических связей, которые удерживают атомы вместе: ковалентные и ионные / электровалентные связи. Атомы, которые разделяют электроны в химической связи, имеют ковалентные связи. Молекула кислорода (O 2 ) — хороший пример молекулы с ковалентной связью. Ионные связи возникают, когда электроны передаются от одного атома другому. Поваренная соль (NaCl) — распространенный пример соединения с ионной связью.
Вы также можете узнать о третьем типе облигаций. Между атомами металлов возникают металлические связи.Мы собираемся сосредоточиться на ионных и ковалентных связях.
Когда мы обсуждаем фазовые изменения в материи, мы смотрим на физических изменения. Одни только физические силы (если вы не находитесь внутри Солнца или чего-то экстремального) редко разрушают соединения полностью.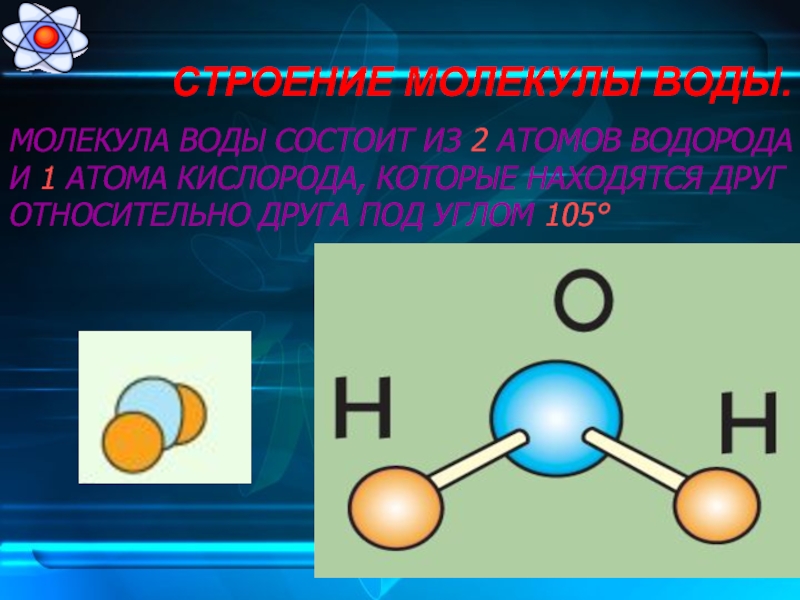 Вы можете растопить кубик льда теплом, но молекулы воды не изменятся. Вы также можете налить чашку воды в емкость и уменьшить давление. Вода в конечном итоге закипит, но молекулы не изменятся.
Вы можете растопить кубик льда теплом, но молекулы воды не изменятся. Вы также можете налить чашку воды в емкость и уменьшить давление. Вода в конечном итоге закипит, но молекулы не изменятся.
Химические изменения в соединениях происходят, когда химические связи создаются или разрушаются. Силы действуют на связи между атомами, изменяя молекулярную структуру вещества. Вы можете налить жидкую кислоту на твердое вещество и наблюдать, как твердое вещество растворяется в . Этот процесс является химическим изменением, потому что создаются и разрушаются молекулярные связи. Геологи поливают камни кислотами, чтобы проверить наличие определенных соединений.
Вокруг вас миллионы различных соединений. Вероятно, все, что вы видите, — это тот или иной тип соединения.Когда элементы соединяются и становятся составными, они теряют многие из своих индивидуальных черт. Один только натрий (Na) очень реактивен . Но когда натрий и хлор (Cl) объединяются, они образуют нереактивное вещество , называемое хлоридом натрия (поваренная соль, NaCl). Новые соединения имеют мало или совсем не обладают физическими или химическими характеристиками исходных элементов. У них есть собственная новая жизнь.
Если вы посмотрите на хлорид натрия, он скреплен одной ионной / электровалентной связью. А как насчет хлорида магния (MgCl 2 )? Он содержит один атом магния (Mg) и два атома хлора (Cl).Есть две ионные связи. Метан (CH 4 ) состоит из одного углерода (C) и четырех атомов водорода (H). Есть четыре связи, и все они ковалентны.
У этих примеров очень простые химические связи. Однако большинство соединений имеют комбинации ионных и ковалентных связей. Давайте посмотрим на гидроксид натрия (Na-OH) …
Вы можете увидеть часть натрия (Na) слева и часть гидроксид (-OH) справа. Связь, которая связывает водород (H) с кислородом (O), является ковалентной.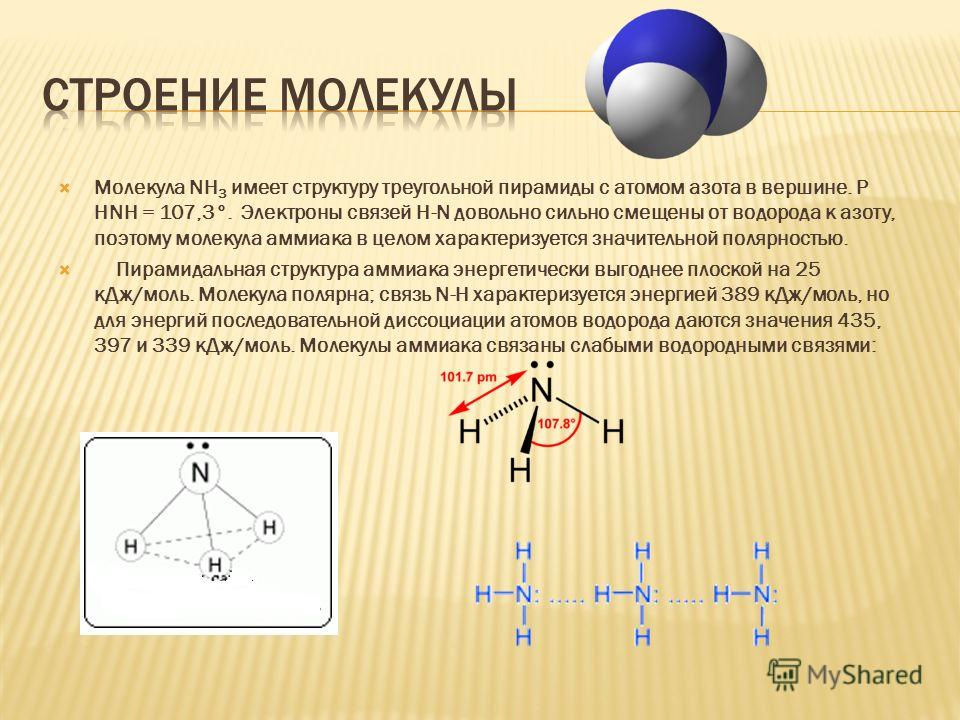


 32 (1955), 195–195.
32 (1955), 195–195.